利用纤维素水解液中的纤维二糖发酵制备丁二酸
2013-08-02奚永兰张九花戴文宇万月佳陈可泉
徐 蓉,奚永兰,张九花,戴文宇,万月佳,陈可泉,姜 岷
(南京工业大学生物与制药工程学院,材料化学工程国家重点实验室,江苏 南京 211816)
丁二酸又名琥珀酸,是一种重要的碳四平台化合物,其作为一种重要的化工原料在医药、食品以及表面活性剂等行业有着广泛的用途。传统的丁二酸生产方法以不可再生的石油资源为原料带来了高成本、高污染等问题,限制了琥珀酸作为基本化工原料的广泛应用。而微生物发酵法生产丁二酸具有利用可再生资源、固定温室气体CO2等优点,近年来成为国内外研究的热点,并在菌种选育和发酵培养条件优化等方面取得了重要的进展[1-3]。
目前研究的丁二酸生产菌株主要集中在产琥珀酸放线 杆菌(Actinobacillus succinogenes)[4-5]、产琥珀酸厌氧螺菌( Anaerobiospirillum succiniproducens )[6-7]、 产 琥 珀 酸 曼 式 杆 菌(Mannheimia succiniciproducens)[8]、重组大肠杆菌(Escherichia coli)[9]。其中,产琥珀酸防线杆菌是一种从瘤胃中分离、耐渗透压的兼性厌氧细菌,这种细菌可以高产琥珀酸,而且它可以在厌氧条件下利用和同化多种糖类,如葡萄糖、果糖、乳糖、半乳糖、蔗糖、纤维二糖和甘露醇等[10]。产琥珀酸放线杆菌的这一特点,使它能够利用各种各样的糖类作为碳源高效生产丁二酸。据报道,一些废弃的廉价可再生纤维素资源如秸秆[11]、玉米皮[12]、甘蔗渣[13]等经过处理后得到的水解液可作为产琥珀酸放线杆菌生产丁二酸的原料,而这些水解液中往往含有多种糖类,如木糖、葡萄糖、阿拉伯糖、纤维二糖等,但是很少有研究者去考察产琥珀酸防线杆菌利用二糖生产丁二酸的情况,以及水解液中二糖的存在对菌体利用其它单糖的影响。
纤维素水解液中通常含有纤维二糖,这是一种还原性的二糖,是纤维素的基本组成单位。本文考察了Actinobacillus succinogenes NJ113 利用纤维二糖作为碳源发酵生产丁二酸的能力,并利用纤维素酶酶解甘蔗渣纤维素制备纤维二糖的水解糖液,从而用于考察以纤维二糖为主要糖分的水解糖液作为碳源对菌体发酵生产丁二酸的影响。
1 实验材料和方法
1.1 原料
甘蔗渣由广州甘蔗糖业研究所提供。
1.2 生产菌株
Actinobacillus succinogenes NJ113(本实验室筛选并保存)。
1.3 培养基
1.3.1 种子培养基
葡萄糖10 g/L (分开灭菌),酵母膏5 g/L,玉米浆干粉 2.5 g/L,NaHCO310 g/L,NaH2PO4·2H2O 9.6 g/L,K2HPO4·3H2O 15.5 g/L,NaCl 1 g/L,121 ℃灭菌15 min。
1.3.2 发酵培养基
糖类30~70 g/L(分开灭菌),酵母膏10 g/L,玉米浆干粉7.5 g/L ,乙酸钠1.36 g/L,K2HPO43 g/L,NaCl 1 g/L,CaCl20.2 g/L,NaH2PO4·2H2O 1.6 g/L,Na2HPO4·3H2O 0.31 g/L,121 ℃灭菌15 min。
1.4 培养方法
种子培养:将冻存于-70℃冰箱的菌种接种于100 mL 血清瓶培养,装液量50 mL,接种量3%,于37 ℃、200 r/min 摇床中培养10 h 后作为种子液。
血清瓶培养:100 mL 血清瓶装液量30 mL,接种量3%,于37 ℃、200 r/min 摇床中培养。
3 L 发酵罐(BioFlo 110 fermentor;New Brunswick Scientific Co.,Edison,N.J.)培养:装液量1.5 L,接种量6%(体积分数),在37 ℃、搅拌转速200 r/min、CO2通气量0.5 L/min、以25%NaCO3为pH 调节剂维持pH 值在6.8。
1.5 制备含大量纤维二糖的纤维素水解液
将一定量的甘蔗渣洗净、烘干,粉碎后过40目筛,然后用2%稀硫酸121 ℃下酸解2 h,过滤去除液体,洗涤残渣,残渣的主要成分即为未能酸解的蔗渣中的纤维素。将残渣置于3 L 大三角瓶中,加入一定量的水控制固液比为1∶5,pH 值调至5.0,添加液体纤维素酶Celluclast 1.5 L(丹麦诺维信公司)15 U/mg,在50 ℃、150 r/min 下振荡酶解72 h后,过滤去除残余固体得水解糖液。
1.6 分析方法
1.6.1 菌体密度的测定
将发酵液用去离子水稀释适当倍数,使A660值在0.2~0.8 之间,用紫外可见分光光度计(Spectrumlab 752s)测定。菌液浊度OD660=A660×稀释倍数。
1.6.2 糖类及有机酸含量的测定
蔗渣纤维素水解液中各种糖含量的测定、发酵液中残糖和有机酸含量的测定采用高效液相色谱法,色谱柱为Aminex HPX-87H 型离子排斥色谱柱(300 mm ×Φ7.8 mm,5 μm),以 0.005 mol/L of H2SO4作为流动相,流速0.6 mL/min-1,进样体积20 μL,柱温55 ℃。纤维二糖、葡萄糖、木糖、阿拉伯糖等利用示差折光检测器检测[14],丁二酸、乙酸等利用紫外检测器检测,检测波长为215 nm。
2 结果与讨论
2.1 纤维二糖与纤维素水解液中其它常见碳源发酵情况的比较
纤维素水解液中含有多种糖类,如葡萄糖、木糖、阿拉伯糖、纤维二糖等。本实验在100 mL 的血清瓶中进行厌氧发酵,分别考察不同碳源(葡萄糖、木糖、阿拉伯糖、纤维二糖)对菌体发酵产丁二酸的影响,设定初始糖浓度为30 g/L,发酵24 h,结果见图1。
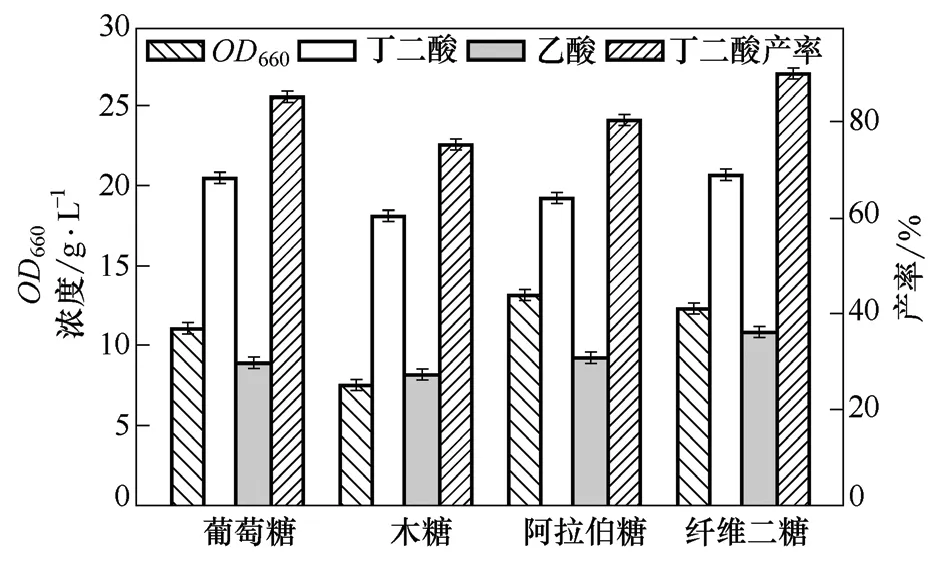
图1 纤维素水解液中常见糖类作为碳源发酵产丁二酸的结果
由图1可以看出,对于这4种碳源,Actinobacillus succinogenes NJ113 都有较强的利用能力,丁二酸的产率均达到60%以上。木糖和阿拉伯糖作为碳源时,丁二酸产量分别为18.1 g/L 和19.1 g/L;当葡萄糖和纤维二糖作为碳源时,丁二酸产量分别达到20.49 g/L 和20.67 g/L,明显优于其它两种碳源。进行至发酵终点时,葡萄糖、木糖、阿拉伯糖均完全消耗,但纤维二糖还有少量残余,而且当纤维二糖作为碳源时,发酵液中的乙酸量较高,丁二酸与乙酸的摩尔比为0.98,而葡萄糖、木糖和阿拉伯糖作为碳源发酵时,丁二酸与乙酸的摩尔比分别为1.19、1.14和1.07。由此可见,纤维二糖可以作为碳源用于丁二酸的生产,但存在一些不足,如菌体不能将碳源完全消耗,且副产物乙酸的量较高。
以前的研究发现,A.succinogenes 利用激酶途径和PEP-PTS 摄入葡萄糖,而且PEP-PTS 还负责转运果糖、甘露糖、山梨醇、β-葡萄糖苷(如纤维二糖、熊果苷)等[3,15-16]。细胞外的碳源进入PTS 的糖转运通道后被磷酸化,与此同时细胞内的一部分磷酸烯醇式丙酮酸(PEP)转变为丙酮酸,这导致了C4途径通量的减少,而C3 途径的通量增加,进而导致副产物乙酸的增多。因此,在纤维二糖作为碳源发酵生产丁二酸时,可能由于PTS 发挥作用,导致副产物乙酸的量较多,究其原因还需要进一步研究。
2.2 不同浓度的纤维二糖作为碳源对菌体生长及产丁二酸的影响
本实验在100 mL 的血清瓶中进行厌氧发酵36 h,分别考察不同浓度的纤维二糖(30 g/L、40 g/L、50 g/L、60 g/L、70 g/L)作为碳源时对菌体的生长及产丁二酸的影响,结果见表1。
由表1 可以看出,当纤维二糖浓度为30 g/L 时,纤维二糖的利用率为95.5%,丁二酸的产率高达72.15%,可见产琥珀酸防线杆菌NJ113 有很强的利用纤维二糖发酵产丁二酸的能力;但随着纤维二糖浓度的继续增大,残糖量不断增多,OD 值呈现先增加后减少的趋势;产物丁二酸的浓度也随着纤维二糖的增加而增多,但产率却有所降低。当糖浓度为70 g/L 时,糖利用率仅为83.4%,丁二酸浓度为38.91 g/L,产率为66.65%,较30 g/L 时降低了7.6%,此时的收率只有55.59%。由此可知,高浓度的纤维二糖对于菌体生长有一定的抑制,从而导致丁二酸的产量和收率也有明显的降低。
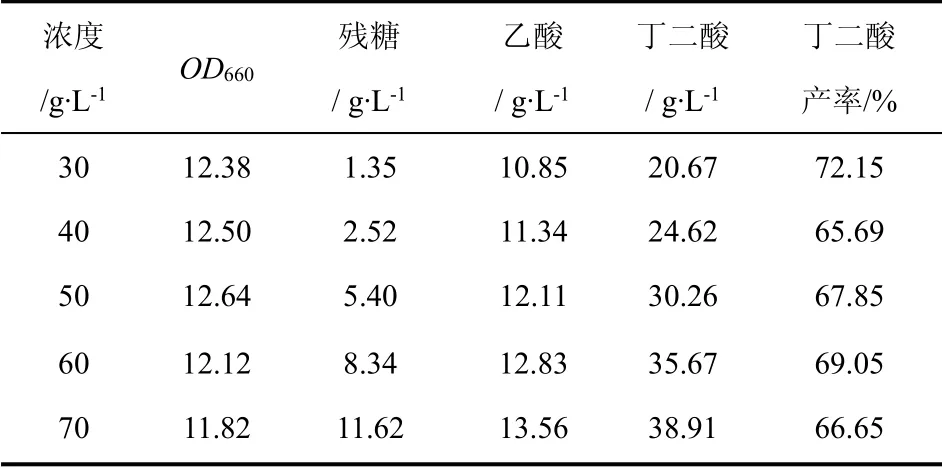
表1 不同浓度的纤维二糖作为碳源发酵产丁二酸的结果
2.3 纤维二糖作为碳源发酵制备丁二酸
在3 L 发酵罐中考察以纤维二糖作为碳源发酵制备丁二酸的情况。设定初始纤维二糖浓度为35 g/L,厌氧发酵30 h,发酵结果见图2。
从图2 可以看出,当发酵进行至4 h 时,菌体生长进入对数期,开始大量消耗纤维二糖,发酵至26 h 时,培养基中的纤维二糖被完全消耗,总的耗糖速率达到1.35 g/h/L,此时丁二酸的浓度为23.51 g/L,产率为67.17%。由此可见,当纤维二糖作为碳源用于产琥珀酸放线杆菌生产丁二酸时,可以获得较高的丁二酸产率。另外,从发酵结果不难发现,利用纤维二糖作为碳源发酵生产丁二酸时,副产物乙酸的量较高,由图2 可以看出,发酵至终点时,副产物乙酸的量为12.44 g/L,丁二酸与乙酸的浓度比为1.89,乙酸产量高的原因还需要进一步考察。
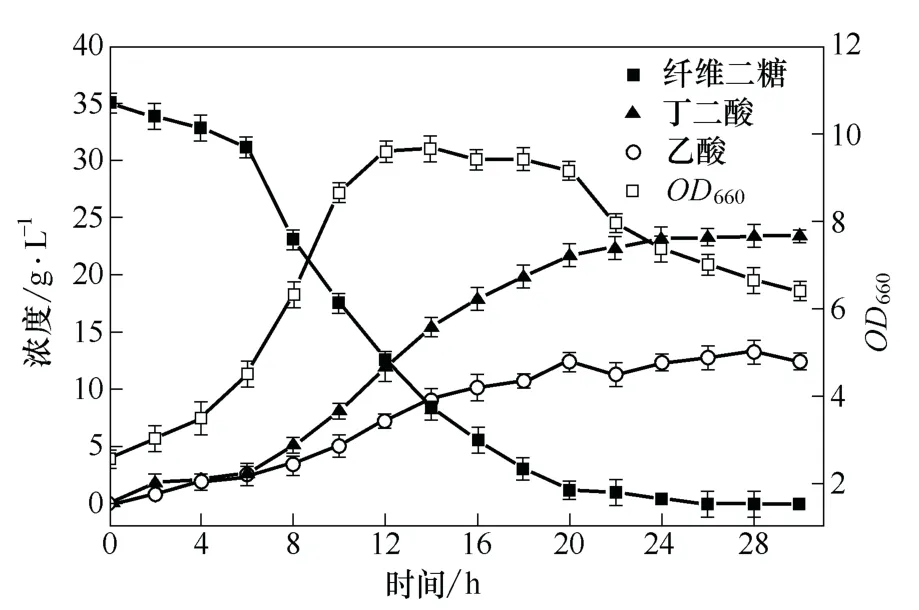
图2 纤维二糖作为碳源发酵产丁二酸的结果
2.4 蔗渣纤维素水解液作为碳源发酵制备丁二酸
在3 L 发酵罐中考察以甘蔗渣纤维素水解液作为碳源发酵产丁二酸的情况。设定初始糖浓度为35 g/L,其中18 g/L 纤维二糖、8 g/L 葡萄糖、5 g/L 阿拉伯糖、4 g/L 木糖,发酵33 h,结果见图3。
从图3 可以看出,当发酵进行至9 h 时,菌体密度(OD660)达到最大值9.73,此时培养基中的葡萄糖和木糖全部被消耗,葡萄糖的消耗速率明显大于木糖的消耗速率,而此时菌体消耗的纤维二糖的量只有2.34 g/L。当发酵进行至16 h 时,阿拉伯糖也被全部消耗,此时发酵液中的所有单糖成分已均被菌体利用。从发酵9 h 至24 h,发酵液中纤维二糖的量快速减少,当发酵进行至33 h 时,剩余4.10 g/L 纤维二糖,丁二酸浓度为20.00 g/L,乙酸13.27 g/L,丁二酸产率64.73%。由此可见,菌体优先利用单糖,且单糖的消耗速率明显高于纤维二糖的消耗速率。但菌体并非是先将单糖消耗完全后再开始利用纤维二糖,而是二糖的利用要比单糖的利用滞后。另外,到达发酵终点时还有纤维二糖残留,菌体无法将纤维二糖完全利用,这可能是由于从发酵21 h 开始,菌体进入衰亡期,导致菌体无法继续利用纤维二糖生产丁二酸。
3 结 论
本文考察了A.succinogenes NJ113 利用纤维二糖发酵产丁二酸的能力,并利用甘蔗渣中的纤维素制备纤维二糖用于发酵生产丁二酸。实验结果表明:在3 L 发酵罐中,以35 g/L 纤维二糖作为碳源,发酵33 h,丁二酸的浓度达到23.51 g/L,丁二酸产率为67.17%;在3 L 发酵罐中,以蔗渣纤维素水解液作为碳源发酵,初糖浓度为35 g/L(其中纤维二糖18 g/L),发酵33 h,丁二酸产率达到64.73%。因此,A.succinogenes NJ113 有较强的利用纤维二糖的能力,纤维素水解液中的纤维二糖可作为碳源发酵制备丁二酸。

图3 蔗渣纤维素水解液作为碳源发酵产丁二酸的结果
[1] Kim D Y,Yim S C,Lee P C,et a1. Batch and continuous fermentation of succinic acid from wood hydrolysate by Mannheimia succiniciproducens MBEL55E[J]. Enzyme and Microbial Technology,2004,35:648-653.
[2] Lee P C,Lee W G,Kwon S,et a1.Batch and continuous cultivation of Anaerobiospirillum succiniciproducens for the production of succinic acid from whey[J]. Applied Microbiology and Biotechnology,2000,54:23-27.
[3] van der Werf M J,Guettler M V,Jain M K,et a1.Environmental and physiological factors affecting the succinate product ratio during carbohydrate fermentation by Actinobacillus sp.130Z[J]. Arch.Microbiol.,1997,167:332-342.
[4] Zeikus J G,Jain M K,Elankovan P.Biotechnology of succinic acid production and markets for derived industrial products[J]. Applied Microbiology and Biotechnology,1999,51:545-552.
[5] Kim P,Laivenieks M,McKinlay J,et al. Construction of a shuttlevector for theoverexpressionof recombinant proteins in Actinobacillus succinogenes[J].Plasmid,2004,51(2) :108-115.
[6] Lee P C,Lee W G,Lee S Y,et al. Succinic acid production by Anaerobiospirillum succiniciproducens:Effects of the H2/CO2supply and glucose concentration[J]. Enzyme and Microbial Technology,1999,24:549-554.
[7] SamuelovNS,Datta R,Jain M K,et al. Whey fermentation by Anaerobiospirillum succiniciproducens for production of a succinate based animal feed additive[J]. Applied and Environmental Microbiology,1999,65:2260-2263
[8] Kim DY,Yim S C,Lee P C,et a1.Batch and continuous fermentation of succinic acid from wood hydrolyaste by Mannheimia succiniciproducens MBEL55E[J]. Enzyme and Microbial Technology,2004,35(6):648-653.
[9] Isar J,Agarwal L,Saran S,et al.A statistical method for enhancing the production of succinic acid from Escherichia coli under anaerobic conditions[J].Bioresource Technology,2006,97(13):1443-1448.
[10] Guettler M V,Rumler D,Jain M K.Actinobacillus succinogenes sp.nov.,a novel succinic-acid-producing strain from the bovine rumen[J].Int.J.Syst.Bacteriol,1999,49:207-216.
[11] Zheng P,Dong J J,Sun Z H,et a1. Fermentative production of succinic acid from straw hydrolysate by Actinobacillus succinogenes[J].Bioresource Technology,2009,100:2425-2429.
[12] Chen K Q,Jiang M,Wei P,et a1.Succinic acid production from acid hydrolysate of corn fiber by Actinobacillus succinogenes[J]. Applied Biochemistry and Biotechnology,2010,160:477-485.
[13] Elcio R B,Nei P J. Succinic acid production from sugarcane bagasse hemicellulose hydrolysate by Actinobacillus succinogenes[J].Journal of Industrial Microbiology&Biotechnology,2011,38:1001-1011.
[14] 陈可泉,韦萍,蔡婷,等.反相高效液相色谱在制备琥珀酸中的应用[J]. 生物加工过程,2005,3(2):50-52.
[15] McKinlay J B,Laivenieks M,Schindler B D,et a1. A genomic perspective on the potential of Actinobacillus succinogenes for industrial succinate production[J].BMC Genomics,2010,11:680.
[16] McKinlay J B,Zeikus J G,Vieille C.Insights into the Actinobacillus succinogenes fermentative metabolism in a chemically defined growth medium[J].Applied and Environmental Microbiology,2005,71:6651-6656.
