HBsAg定量对聚乙二醇干扰素治疗HBeAg阴性慢性乙型肝炎疗效预测价值
2013-08-02谭淑燕邹敏超上官辉
谭淑燕,邹敏超,上官辉
(佛山市第二人民医院感染科1、血液内科2,广东佛山528000)
HBsAg定量对聚乙二醇干扰素治疗HBeAg阴性慢性乙型肝炎疗效预测价值
谭淑燕1,邹敏超1,上官辉2
(佛山市第二人民医院感染科1、血液内科2,广东佛山528000)
目的评估HBsAg水平变化对聚乙二醇干扰素(PEG-IFNα-2a)治疗HBeAg阴性慢性乙型肝炎疗效预测价值。方法HBeAg阴性慢性乙型肝炎患者,采用PEG-IFNα-2a每次180 μg,皮下注射,每周1次治疗,疗程48周。Architect HBsAg定量检测系统检测HBsAg,实时荧光定量PCR法检测HBV DNA定量。以治疗24周时HBsAg下降1 lg IU/ml为临界点,比较高于临界点和低于临界点患者持续病毒学应答率差异,分别计算持续病毒学应答(SVR)的阳性预测值、阴性预测值和符合率。结果完成48周疗程61例。其中有43例(70.5%)在48周疗程结束时获得病毒学应答;随访24周,有23例(37.7%)患者获得SVR,20例复发。获得SVR患者HBsAg基线水平低于非SVR患者(P<0.05)。获得SVR患者在治疗24周时HBsAg下降幅度较复发及无应答患者显著(P<0.05)。治疗24周时HBsAg下降≥1 lg IU/ml对获得SVR的阳性预测值为95.5%,阴性预测值为94.9%,符合率为95.1%。结论对于应用PEG-IFNα-2a治疗的HBeAg阴性慢性乙型肝炎患者,治疗前HBsAg的水平以及治疗24周HBsAg的下降幅度是推断治疗应答状况的有效预测指标。
乙型肝炎;慢性;肝炎表面抗原,干扰素α-2a;聚乙烯二醇类
对于HBeAg阴性的患者,在干扰素治疗前预测获得持久病毒学应答的因素不是很明确。为了解HBsAg水平变化对聚乙二醇干扰素(PEG-IFNα-2a)治疗HBeAg阴性慢性乙型肝炎疗效的预测价值,我们进行了如下研究。
1 资料与方法
1.1 病例选择我科2010年8月至2012年8月住院和门诊就诊的HBeAg阴性慢性乙型肝炎患者63例,男性38例,女性25例,年龄27~46岁,平均37.4岁,ALT平均值152.0 U/L,HBV DNA为4~7 lg copies/ml。入组病例根据2010年《慢性乙型肝炎防治指南》[1]明确诊断。妊娠、精神病史(如严重抑郁症)、未能控制的癫痫、未戒断的酗酒/吸毒者、未经控制的自身免疫性疾病、失代偿期肝硬化、有症状的心脏病、治疗前中性粒细胞计数<1.0×109/L和治疗前血小板计数<50×109/L的患者不予入组,并排除甲型、丙型、丁型、戊型肝炎病毒以及巨细胞病毒、EB病毒和HIV合并感染。
1.2 治疗方法PEG-IFNα-2a(上海罗氏制药公司产品)180 μg,皮下注射,每周1次治疗,基本疗程48周。如出现血白细胞<3.8×109/L和(或)血小板计数<100×109/L,则加用利血生片等辅助治疗。当0.75× 109/L≤中性粒细胞计数<1.0×109/L和(或)30×109/L≤血小板计数<50×109/L则减量,改用PEG-IFNα-2a 135 μg皮下注射,1次/周,治疗并加用升白细胞药物辅助治疗,1~2周后复查,如恢复,则逐渐增加至180 μg。当中性粒细胞<0.75×109/L和(或)血小板计数<30×109/L则停止PEG-IFNα-2a注射。
1.3 检测项目和监测指标所有患者分别在治疗基线、24周、48周和治疗结束后24周收集血液标本,每次检测HBsAg(Architect HBsAg定量检测系统检测)、HBV DNA定量(实时荧光定量PCR法,中山大学达安基因股份有限公司,检测下限为500 copies/ml)、ALT(正常值上限为40 IU/L)、甲状腺功能、空腹血糖。治疗期间每2周查1次血常规并注意药物的其他不良反应。
1.4 疗效判断(1)治疗结束时病毒学应答:治疗结束时血清HBV DNA检测阴性。(2)持续病毒学应答(SVR):治疗结束时取得病毒学应答的患者在治疗结束后24周检测血清HBV DNA仍为阴性。(3)复发:治疗结束时取得病毒学应答的患者在治疗结束后24周检测血清HBV DNA阳性;(4)无应答:治疗结束时血清HBV DNA检测阳性。
1.5 统计学方法采用SPSS13.0统计软件。检验各组变量正态分布情况,偏态分布的定量资料用M(QR)表达。比较两组或多组定量资料是否存在差异采用Mann-Whiney检验和Kruskal-Wallis检验。以治疗24周时HBsAg下降1 lgIU/ml为临界点,比较高于临界点和低于临界点患者持续病毒学应答率差异采用较正χ2检验,并分别计算SVR的阳性预测值、阴性预测值和符合率。以P<0.05为差异有统计学意义。
2 结果
2.1 治疗结果63例患者中有2例女性患者因不能耐受副反应而停药,不纳入疗效观察范围,完成48周疗程61例。其中有43例(70.5%)在48周治疗结束时获得病毒学应答;随访24周,有23例(37.7%)患者获得SVR,20例复发。
2.2 SVR和非SVR患者治疗前基线情况比较SVR和非SVR患者在年龄、性别、基线ALT和HBV DNA水平方面差异无统计学意义(P>0.05),SVR患者HBsAg基线水平低于非SVR患者(P<0.05),见表1。

表1 持续病毒学应答和非持续病毒学应答患者治疗前基线水平指标
2.3 治疗过程中患者HBsAg水平的动态变化情况SVR患者在治疗过程中和治疗结束后随访24周HBsAg定量呈下降趋势,见图1。SVR患者、复发患者和无应答患者治疗24周时HBsAg下降幅度分别为1.3(1.1~1.7)lg IU/ml、0.5(0.3~0.7)lg IU/ml和0.4 (0.2~0.6)lg IU/ml,其中SVR患者治疗24周时HBsAg下降幅度较复发、无应答患者差异无统计学意义(P<0.05)。
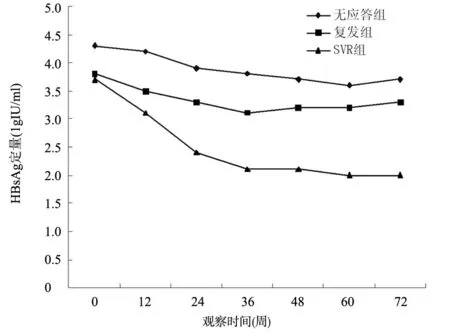
图1 治疗过程中患者HBsAg水平变化情况
2.4 治疗24周时HBsAg下降≥1 lg IU/ml对获得SVR的预测价值治疗24周时有22例(36.1%)患者HBsAg下降超过1 lg IU/ml,其中21例获得SVR,获得SVR的21例患者中有2例获得HBsAg清除;39例(63.9%)患者HBsAg无下降或下降低于1 lg IU/ml,其中2例获得SVR。由表2可见,治疗24周时HBsAg下降≥1 lg IU/ml对获得SVR有高度的预测价值(阳性预测值95.5%,阴性预测值94.9%,符合率为95.1%)。
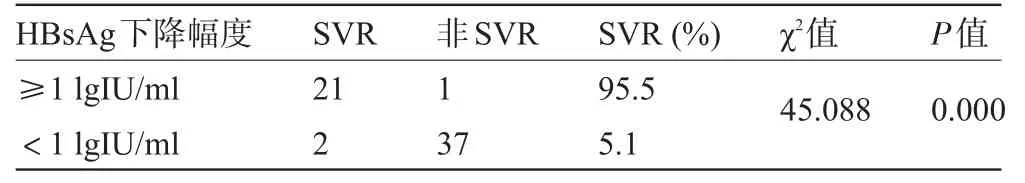
表2 治疗24周时不同HBsAg下降幅度患者持续病毒学应答率比较
3 讨论
干扰素通过直接抗病毒和调节免疫,发挥抑制HBV复制及清除HBV作用[2]。与普通干扰素相比较,PEG-IFNα-2a由于在药代动力学上有所改进,具有更强的抗病毒活性[3]。但其费用贵且不良反应大,应尽早识别可能无应答者或者复发者,对预期疗效不佳的患者,及时调整治疗策略。
HBV cccDNA的长期存在与慢性乙型肝炎的病程及抗病毒治疗复发有密切关系。有研究表明抗病毒治疗过程中通过对HBsAg滴度的定量监测可以间接反映肝细胞内HBV cccDNA水平[4,5]。目前HBV cccDNA检测在临床工作中难以广泛开展,而血清HBsAg滴度相对容易检测。因此可通过监测HBsAg水平替代肝组织中的HBV cccDNA,了解患者对于治疗的应答情况。HBsAg水平的明显下降甚至转阴,提示患者免疫功能在逐渐增强。本研究统计学分析SVR和非SVR患者在年龄、性别、基线ALT和HBV DNA水平方面差异无统计学意义,但SVR患者HBsAg基线水平低于非SVR患者,提示血清HBsAg基线水平较低者出现SVR的可能性较大。
研究表明,使用干扰素治疗的患者HBsAg的明显下降出现在开始干扰素治疗后12~24周[6,7]。本研究发现获得SVR患者在治疗24周时HBsAg下降幅度较复发患者和无应答患者差异有统计学意义(P<0.05),该结果与国外报道[8]相符合。
李磊等[9]研究认为干扰素治疗HBeAg阳性慢性乙型肝炎过程中动态监测HBsAg和HBeAg水平相对于HBV DNA具有更大的疗效预测价值。孙海霞等[10]研究认为长效干扰素治疗24周HBsAg下降水平对未出现早期病毒显著抑制的HBeAg阳性慢乙肝患者加用阿德福韦酯后的疗效具有预测作用。本研究发现治疗24周时HBsAg下降≥1 lg IU/ml对获得SVR的阳性预测值为95.5%,阴性预测值为94.9%,提示治疗24周时血清HBsAg定量下降对于PEG-IFNα-2a治疗HBeAg阴性慢性乙型肝炎患者疗效同样具有较好的预测作用。可在治疗期间对接受PEG-IFNα-2a治疗的患者进行HBsAg定量监测。如经过24周治疗,患者HBsAg水平下降较快,建议患者坚持完成48周标准疗程;如经过24周治疗,HBsAg水平不降低,可考虑停止治疗或与其他药物联合治疗。
我们的研究结果提示,对于应用PEG-IFNα-2a治疗的HBeAg阴性慢性乙型肝炎患者,治疗前HBsAg的水平以及治疗24周HBsAg的下降幅度是推断治疗应答状况的有效预测指标。但在人体天然免疫或干扰素治疗压力下,HBV的S基因区和前S基因易发生突变,此时HBsAg定量值不能反映真实变化,HBsAg定量测定中仍存在一些问题如标本稀释程序可能导致检验误差等,而本研究样本量较少,统计学处理中可能存在偏差,因此需要提高检测技术,扩大病例数,甚至更长期的治疗做进一步研究。
[1]中华医学会肝病学分会和感染病学分会.慢性乙型肝炎防治指南(2010年版)[J].实用肝脏病杂志,2011,14(2):81-89.
[2]Perrillo R.Benefits and risks of interferon therapy for hepatitis B [J].Hepatology,2009,49(5 Suppl):S103-111.
[3]Cootksley WG,Piratvisuth T,Lee SD,et al.Peginterferon alpha-2a (40kDa):an advance in the treatment of hepatitis B e antigen-positive chronic hepatitis H[J].J Viral Hepat,2003,10:298-305.
[4]Werle-Lapostolle B,Bowden S,Locamini S,et al.Persistence of cccDNA during the natural history of chronic hepatitis B and decline during adefovir dipivnxil therapy[J].Gastroenterology,2004, 126(7):1750-1758.
[5]Chan HL,Wong VW,Tse AM,et al.Serum hepatitis B surface antigen quantitation can reflect hepatitis B virus in the liver and predict treatment response[J].Clin Gastroenterol Hepatol,2007,5: 1462-1468.
[6]Manensis EK,Hadziyannnis ES,Angelopoulou OP,et al.Prediction of treatment-related HBsAg loss in HBeAg-negative chronic hepatitis B:a clue from serum HBsAg levels[J].Antivir Ther,2007,12: 73-82.
[7]Gish RG,Lau DT,Schmid P,et al.A pilot study of extended treatment duration peginterferon alfa-2a for patients with hepatitis B e antigen-negative chronic hepatitis B[J].Am J Gastroenterol,2007, 102:2718-2723.
[8]Moucari R,Mackiewicz V,Lada O,et al.Early serum HBsAg drop: a strong predictor of sustained virological response to pegylated interferon alfa-2a in HBeAg-negative patients[J].Hepatology,2009, 49:1151-1157.
[9]李磊,李宜,高人焘,等.HBsAg和HBeAg定量在干扰素治疗HBeAg阳性慢性乙型肝炎疗效预测中的价值[J].实用肝脏病杂志,2012,15:232-234.
[10]孙海霞,曹红,张卡,等.HBV抗原定量对干扰素联合阿德福韦酯治疗HBeAg阳性慢乙肝的疗效预测[J].中华实验和临床病毒学杂志,2011,25:132-134.
Value of serum HBsAg quantification in predicting response of PEG-IFNα-2a in the treatment of patients with HBeAg-negative chronic hepatitis B.
TAN Shu-yan1,ZOU Min-chao1,SHANGGUAN Hui2.Department of Infectious Disease1,Department of Hematology2,Foshan Second People's Hospital,Foshan 528000,Guangdong,CHINA
ObjectiveTo explore the value of serum HBsAg quantification in predicting response of PEG-IFNα-2a in the treatment of patients with HBeAg-negative chronic hepatitis B(CHB).MethodsPatients diagnosed as HBeAg-negative CHB were given PEG-IFNα-2a(180 μg/week,subcutaneously)once a week for a period of 48 weeks.The Abbott Architect HBsAg QT assay and realtime fluorescence quantitative PCR were used to evaluate the amount of HBsAg and the expression levels of HBV.Rates of sustained virological response(SVR)were compared between patients showing a decease of serum HBsAg level≥1l gIU/ml and≤1l gIU/ml at week 24 of PEG-IFNα-2a therapy.The positive predictive value(PPV),negative predictive value(NPV)and coincidence rate were calculated by statistical method.ResultsOf all 61 patients,43(70.5%)showed an end of treatment response at week 48.Twenty-four weeks after cessation,23 patients(37.7%)achieved SVR,while 20 patients relapsed.Baseline serum HBsAg level was lower in patients who developed SVR comparing with in patients who did not.Patients who developed SVR showed a marked decrease in serum HBsAg at week 24.The cutoff of 1 lgIU/ml HBsAg decrease had a PPV of 95.5%,the NPV of 94.9%,and coincidence rate of 95.1%at week 24.ConclusionThe results suggest that low baseline serum HBsAg level and a marked decease of serum HBsAg level at week 24 may be used to predict better response in patients of HBeAg-negative CHB under PEG-IFNα-2a treatment.
Hepatitis B;Chronic;Hepatitis B surface antigens;Interferon alfa-2a;Polyethylene glycols
R512.6+2
A
1003—6350(2013)19—2818—03
10.3969/j.issn.1003-6350.2013.19.1179
2013-04-07)
广东省佛山市卫生局课题资助项目(编号:2011098)
谭淑燕。E-mail:tan_shuyan@126.com
