自噬对大肠癌LoVo/Adr细胞多药耐药性的影响
2013-08-02马强常宗宏王彪猛王维邓尚新
马强,常宗宏,王彪猛,王维,邓尚新
自噬对大肠癌LoVo/Adr细胞多药耐药性的影响
马强,常宗宏,王彪猛,王维,邓尚新
目的探讨大肠癌耐药LoVo/Adr细胞自噬状态对多药耐药(MDR)的影响。方法体外培养LoVo/Adr细胞,应用透射电镜观察细胞自噬体形成情况,采用MDC荧光染色及流式细胞术定量分析自噬率,MTT法测定细胞对阿霉素(ADR)的半数抑制浓度(IC50),RT-PCR检测MDR1基因的mRNA水平,Western blotting检测P糖蛋白(P-gp)表达水平。结果LoVo/Adr细胞中可见散在自噬体或点状绿色荧光分布,自噬率为3.1%±0.5%;ADR和雷帕霉素(RAPA)单独作用时,自噬体明显增多,自噬率分别为33.6%±5.1%和45.2%±6.1%(P<0.05),ADR和RAPA联合作用时可见大量自噬体形成,自噬率为76.2%±7.4%,显著高于二者单独作用时(P<0.05);LoVo/Adr细胞对ADR的IC50为3.05±0.52mg/L,RAPA作用后IC50降至1.12±0.21mg/L(P<0.01),RAPA具有逆转耐药的作用,逆转倍率为2.26倍;LoVo/Adr细胞MDR1 mRNA和P-gp蛋白呈高表达,在RAPA作用下,MDR1 mRNA表达量由1.42±0.31降至0.54±0.20(P<0.05),P-gp蛋白表达量由0.67±0.14降至0.15±0.08(P<0.01),RAPA显著下调了MDR1 mRNA及蛋白的表达。结论多药耐药的LoVo/Adr细胞呈低自噬状态,RAPA可通过提高细胞的自噬活性而逆转MDR,逆转途径可能与促进细胞自噬性死亡和下调MDR1基因的表达有关。
自噬;多药耐药相关蛋白质类;P糖蛋白;结直肠肿瘤
大肠癌是消化道常见肿瘤,术后化疗引起多药耐药(multidrug resistance,MDR)是导致肿瘤复发、转移及预后不良的关键因素。MDR是指肿瘤细胞对分子结构不同、作用机制各异的化疗药物产生的交叉耐药[1-2]。如何逆转MDR是大肠癌治疗中亟待解决的问题。作为细胞死亡的一种方式,自噬(autophagy)与肿瘤耐药的关系越来越引起人们的关注[3-4]。本研究以此为切入点,通过调控细胞自噬活性观察大肠癌多药耐药LoVo/Adr细胞对阿霉素(ADR)敏感性的变化,探讨自噬对大肠癌MDR的影响。
1 材料与方法
1.1 主要试剂及仪器 多药耐药LoVo/Adr细胞株由本研究组采用ADR浓度递增法诱导大肠癌敏感株LoVo细胞构建,能在1.0mg/L ADR培养基中生长,具有多药耐药特性[5]。小牛血清(杭州四季青生物制品研究所);RPMI 1640培养液(Gibco公司);DAB Kit试剂盒(北京中杉生物技术有限公司);兔抗P糖蛋白(P-glycoprotein,P-gp)多克隆抗体、辣根过氧化物酶标记的小鼠抗兔二抗(北京博奥森生物技术有限公司);RNA提取试剂盒、RT-PCR试剂盒(德国宝灵曼公司);ADR、噻唑蓝(MTT)、西罗莫司(雷帕霉素,RAPA)和单丹磺酰戊二胺(MDC,Sigma公司);青霉素和链霉素(华北制药厂);Model 550型酶联免疫检测仪、垂直式电泳仪及湿转装置(美国Bio-Rad公司);FACS-420型流式细胞仪(美国Coulter公司);日立H-600Ⅳ透射电镜(日本日立公司)。MDR1引物由上海生工生物工程公司合成。
1.2 方法
1.2.1 细胞培养 LoVo/Adr细胞在37℃、5%CO2、饱和湿度的培养箱中培养,培养基为含10%热灭活小牛血清、100U/ml青霉素和100mg/L链霉素的RPMI 1640,在培养体系中加入终浓度为1.0mg/L的ADR以维持耐药。每48h换液1次,用0.25%胰蛋白酶消化传代。
1.2.2 电镜及荧光显微镜下观察LoVo/Adr细胞自噬体变化 实验分为对照组、ADR组、RAPA组和ADR+RAPA组。取对数生长期LoVo/Adr细胞,消化后以每孔6×104个细胞加入到24孔板(150μl/孔)中,各组细胞加用相应药物(ADR终浓度3mg/L,RAPA终浓度50μmol/L)培养24h,胰酶消化,PBS洗5min×3次,2.5%戊二醛前固定,1%锇酸后固定,系列乙醇脱水,氧化丙烯浸透,环氧树脂包埋并制成切片,醋酸双氧铀及柠檬酸铅双重染色,透射电镜观察并摄片。将上述各组细胞加入相应药物处理后继续培养24h,PBS洗2次,加入0.1mmol/L MDC,37℃培养箱孵育2h,荧光显微镜下观察,摄片,荧光显微镜加用488nm发射滤片和570nm阻断滤片。
1.2.3 流式细胞术定量分析LoVo/Adr细胞自噬率将上述各组细胞制成单细胞悬液,MDC染色,上流式细胞仪,以488nm激发波长测定3000个细胞,MDC阳性细胞率即为自噬率,结果用Cellquest软件分析。实验重复3次。
1.2.4 MTT法检测RAPA对LoVo/Adr细胞ADR敏感性的影响 将LoVo/Adr细胞分为对照组和RAPA组。取对数生长期LoVo/Adr细胞,消化后以每孔1×104个细胞加入到96孔板(200μl/孔)中。RAPA组ADR给药前1h加入终浓度50μmol/L的RAPA,ADR终浓度分别为0.02、0.04、0.08、0.16、0.32、0.64、 1.28、2.56、5.12mg/L共9个浓度梯度,每孔设3个平行孔。培养板放入37℃、5%CO2、相对湿度90%的培养箱中继续培养72h后取出,加入MTT溶液,培养箱孵育4h,弃培养基,加入DMSO,37℃保温箱中放置10min,取出震荡几秒钟,使结晶物充分溶解,用酶标仪在570nm处测定吸光度(A)值,重复3次,取平均值。计算ADR对LoVo/Adr细胞的抑制率。以药物浓度为横轴,存活率为纵轴绘制浓度效应曲线,确定半数抑制浓度(IC50)。
1.2.5 RT-PCR检测RAPA对MDR1基因表达的影响实验分对照组和RAPA组。细胞培养方法及加药情况同1.2.4,再培养24h后,采用异硫氰酸胍一步法提取细胞总RNA。引物按文献[6]设计合成。MDR1:正义5'-AAGCTTAGTACCAAAGAGGCTCTG-3',反义5'-GGCTAGAAACAATAGTGAAAACAA-3',扩增片段长度为243bp;β2-微球蛋白(β2-MG):正义5'-ACCCCCACTGAAAAAGATGA-3',反义5'-ATCTTCAAACCTCCATGATG-3',扩增片段长度为115bp。RT-PCR参照试剂盒说明书操作。50℃反转录30min后行PCR反应:94℃ 30s,52℃ 30s,60℃ 45s,共35个循环;60℃延伸10min。取扩增产物10μl,在含有溴化乙啶(EB,终浓度为0.5μg/ml)的1.5%琼脂糖凝胶上电泳,激光密度扫描仪扫描凝胶,用Gelbase/Gelblotpro软件进行分析,以β2-MG作为内参照对PCR产物进行相对定量,实验重复3次,取平均值。
1.2.6 Western blotting检测RAPA对P-gp蛋白表达的影响 细胞分组同1.2.4,加入适量裂解液提取蛋白,用考马斯亮蓝法测定蛋白量并定量,使各组蛋白浓度一致,行SDS-PAGE电泳,将蛋白转移至PVDF膜上。5%脱脂奶粉封闭,加入一抗以及β-actin的一抗4℃孵育过夜,加入二抗孵育1h,TBST室温洗膜5min×3次,DAB显色,照相。条带经Quantity One软件分析并计算A值。实验重复3次。
1.3 统计学处理 采用SPSS软件进行分析。数据结果以±s表示,多组间比较采用单因素方差分析,两组间比较采用t检验。P<0.05为差异有统计学意义。
2 结 果
2.1 电镜下LoVo/Adr细胞的自噬状态 如图1所示,对照组LoVo/Adr细胞中可见散在的双层膜结构、含胞质成分的自噬体;分别给予自噬体激动剂RAPA或ADR时,LoVo/Adr细胞中的自噬体较对照组显著增多;同时加入RAPA及ADR时,细胞中出现大量自噬体。

图1 电镜下观察LoVo/Adr细胞自噬体Fig.1 Autophagosomes in LoVo/Adr cells observed by transmission electronic microscopy
2.2 荧光显微镜下LoVo/Adr细胞自噬体形成情况荧光显微镜观察结果如图2所示,与电镜观察结果基本一致:常态下对照组LoVo/Adr细胞内可见少量点状绿色荧光,分布于胞质及核周;加入RAPA或ADR后,细胞中点状绿色荧光显著增多,同时加入RAPA及ADR时,细胞中出现大量绿色荧光。
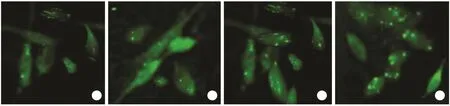
图2 荧光显微镜下观察LoVo/Adr细胞自噬体Fig.2 Fluorescence microscopy used to confirm autophagosomes in LoVo/Adr cells
2.3 流式细胞仪定量分析LoVo/Adr细胞自噬率对照组LoVo/Adr细胞为低自噬状态,自噬率为3.1%±0.5%,单独应用ADR和RAPA时自噬率均较对照组显著增高,分别为33.6%±5.1%和45.2%±6.1%(P<0.05);ADR与RAPA共同作用时自噬率为76.2%±7.4%,较两者单独应用时显著增高(P<0.05),表明二者具有协同作用(图3)。
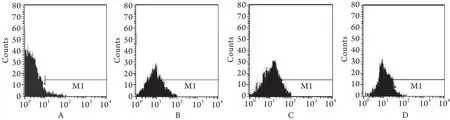
图3 FCM检测各组LoVo/Adr细胞的自噬率Fig.3 Flow cytometric analysis of autophagy rate in LoVo/Adr cells
2.4 RAPA对LoVo/Adr细胞ADR敏感性的影响LoVo/Adr细胞ADR的IC50值为3.05±0.52mg/L,加入浓度为50μmol/L的RAPA时细胞ADR的IC50值降至1.12±0.21mg/L(P<0.01),提示自噬激动剂RAPA可显著提高LoVo/Adr细胞对ADR的敏感性,具有逆转耐药的作用,逆转倍率为2.26倍。
2.5 RAPA对MDR1基因表达的影响 LoVo/Adr细胞的MDR1 mRNA呈高水平表达(1.42±0.31),加入RAPA后,其表达量显著下降(0.54±0.20,P<0.05,图4)。
2.6 RAPA对P-gp蛋白表达的影响 P-gp蛋白表达与MDR1 mRNA表达基本一致,在LoVo/Adr细胞中,P-gp蛋白呈高表达(0.67±0.14),RAPA作用后P-gp蛋白表达明显下降(0.15±0.08,P<0.05,图5),表明自噬活性可影响MDR1的蛋白表达。
3 讨 论
自噬又称为Ⅱ类程序性细胞死亡,是细胞对于营养不足或代谢应激作出的一种分解代谢反应[7]。自噬的主要功能是通过降解未进行正确折叠或发生凝聚的蛋白质和细胞器来维持细胞内的代谢平衡[8-9]。尽管细胞自噬的调控过程十分复杂,但是已有明确的实验证据显示,自噬可单独作用或与凋亡共同作用,从而影响肿瘤对化疗药物的敏感性。综合国内外研究成果,发现自噬与MDR关系存在两种截然相反的结论,如Galoian等[10]认为自噬增强可逆转耐药,而Ahn等[11]的研究表明抑制自噬可增加药物敏感性。为此,我们通过调控多药耐药的大肠癌LoVo/Adr细胞的自噬活性,观察耐药指数的变化,进一步明确自噬与耐药的关系,并探讨可能的发生机制。

图4 LoVo/Adr细胞中mdr1 mRNA表达的RT-PCR电泳图Fig.4 Electrophoretogram of RT-PCR amplification of mdr1 mRNAs in LoVo/Adr cells
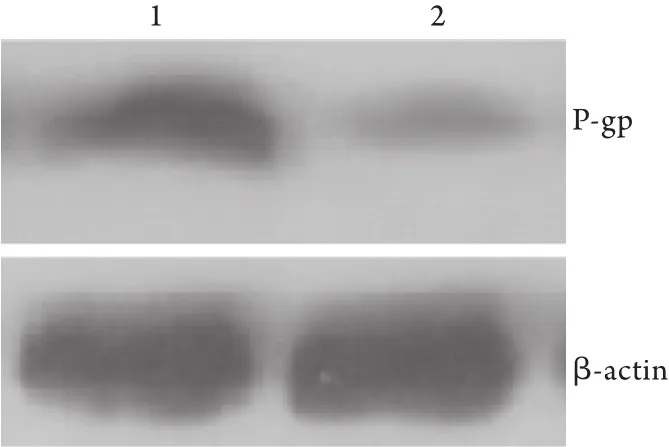
图5 LoVo/Adr细胞中P-gp蛋白表达的Western blotting检测Fig.5 Protein expression of P-gp in LoVo/Adr cells by Western blotting
RAPA是mTOR特异性抑制剂,具有阻止mTOR通路、促进自噬的作用,是特异性的自噬激动剂[12]。本研究首先通过RAPA干预耐药LoVo/Adr细胞,再定性及定量地观察细胞的自噬活性,结果表明,耐药LoVo/Adr细胞呈低自噬状态,单独给予ADR或RAPA时,均可使细胞自噬活性增强,而二者联合应用时具有协同作用。虽然ADR与RAPA均可引起细胞的自噬活性增强,但其机制不同:自噬是细胞的一种防御应激反应,ADR作为不良刺激增强了细胞的防御机制,表现为自噬活性增加,从而清除化疗杀伤的一些细胞器,隔离有害物质,促进细胞逃避药物诱导的死亡的发生,发挥保护作用,而过度的自噬可引发自噬性死亡;RAPA作为mTOR抑制剂,可抑制mTOR通路,激活自噬,引起细胞自噬活性增强。
进一步观察自噬活性变化对大肠癌LoVo/Adr细胞ADR敏感性的影响发现,自噬激动剂RAPA可显著提高LoVo/Adr细胞对ADR的敏感性,具有逆转耐药的作用,逆转倍率为2.26倍,提示抑制自噬可提高肿瘤细胞的化疗敏感性,与Eum等[13]的研究结果一致。大多数学者认为该逆转机制可能与RAPA通过增加自噬启动细胞主动性Ⅱ型细胞死亡程序,导致细胞自噬性死亡,从而逆转耐药有关。
P-gp是耐药细胞膜上过度表达的一种跨膜大分子糖蛋白[14],由MDR1基因编码,分子量为170kD,其主要功能是在细胞膜上形成一个通道,水解ATP获得能量,将已进入胞内的药物泵出胞外,使细胞内药物浓度降低,从而免遭化疗药物的杀伤[15]。为了研究自噬调控MDR是否与MDR1基因的表达有关,我们又进行了深入研究,结果表明:自噬活性增高可下调MDR1基因的mRNA及蛋白表达水平,从而减少细胞内药物的外泵,增强细胞毒性作用,具有增敏作用。Pop等[16]的研究也发现,在多药耐药的B淋巴细胞系中,RAPA能使P-gp泵失活,与本研究结果类似。
总之,本研究观察到耐药细胞呈低自噬状态,ADR可通过提高耐药细胞的自噬活性而逆转耐药,其逆转途径可能与促进细胞自噬性死亡和下调mdr1基因的表达有关。由于自噬调控机制十分复杂,很多问题仍未阐明,甚至存在许多疑问和矛盾,但可以证实的是调控自噬有助于恢复大肠癌细胞对化疗的敏感性,细胞自噬有望成为潜在的逆转肿瘤细胞耐药性的治疗靶点。
[1] Rodrigues AS, Dinis J, Gromicho M. et al. Genomics and cancer drug resistance[J]. Curr Pharm Biotechnol, 2012, 13(5): 651-673.
[2] Li L, Fu ZX, Qin Y, et al. Effects of curcumin on2-D electrophoresis profiles of proteins in drug-resistant HCT-8/ VCR cells of human colon carcinoma[J]. Med J Chin PLA, 2011, 36(12): 1286-1290. [李雷, 傅仲学, 覃勇, 等. 姜黄素对人结肠癌耐药细胞HCT-8/VCR蛋白质双向电泳图谱的影响[J]. 解放军医学杂志, 2011, 36(12): 1286-1290.]
[3] Kong D, Ma S, Liang B. et al. The different regulatory effects of p53 status on multidrug resistance are determined by autophagy in ovarian cancer cells[J]. Biomed Pharmacother, 2012, 66(4): 271-278.
[4] Bristol ML, Emery SM, Maycotte P. et al. Autophagy inhibition for chemosensitization and radiosensitization in cancer: do the preclinical data support this therapeutic strategy[J]? J PharmacolExp Ther, 2013, 344(3): 544-552.
[5] Ma Q, Zhang ZS, Wang QY, et al. Establishment and expression of multidrug resistance-related genes of human colon carcinoma LoVo/Adr cell line[J]. Chin J Dig, 2002, 22(7):412-415. [马强, 张振书, 王群英, 等. 结肠癌细胞多药耐药模型LoVo/Adr的建立及其耐药相关基因的表达[J]. 中华消化杂志, 2002, 22(7): 412-415.]
[6] Stavrovskaya AA. Cellular mechanisms of multidrug resistance of tumor cells[J]. Biochemistry Mosc, 2000, 65(1): 95-106.
[7] Yang JR, Hong Q, Cai GY, et al. Effects of miR-34a on regulating the autophagy of HEK293 cells miR-34a[J]. Med J Chin PLA, 2010, 35(2): 166-168. [杨聚荣, 洪权, 蔡广研, 调控HEK293细胞自噬作用的初步研究[J]. 解放军医学杂志, 2010, 35(2): 166-168.]
[8] Choi AM, Ryter SW, Levine B. Autophagy in human health and disease[J]. N Engl J Med, 2013, 368(7): 651-662.
[9] Han X, Li D, Lin CR, et al. Progress on autophagy[J]. Med J Chin PLA, 2010, 35(10): 1267-1269. [韩笑, 李丹, 林成仁.自噬研究新进展[J]. 解放军医学杂志, 2010, 35(10): 1267-1269.]
[10] Galoian K, Temple HT, Galoyan A. mTORC1 inhibition and ECM-cell adhesion-independent drug resistance via PI3K-AKT and PI3K-RAS-MAPK feedback loops[J]. Tumour Biol, 2012, 33(3): 885-890.
[11] Ahn JH, Lee M. Suppression of autophagy sensitizes multidrug resistant cells towards Src tyrosine kinase specific inhibitor PP2[J]. Cancer Lett, 2011, 310(2): 188-197.
[12] Kimmelman AC. The dynamic nature of autophagy in cancer[J]. Genes Dev, 2011, 25(19): 1999-2010.
[13] Eum KH, Lee M. Targeting the autophagy pathway using ectopic expression of Beclin 1 in combination with rapamycin in drugresistant v-Ha-ras-transformed NIH 3T3 cells[J]. Mol Cells, 2011, 31(3): 231-238.
[14] Ma SR. K+channel and malignant tumor of digestive tract[J]. Chin J Pract Intern Med, 2006, 26(24): 1934-1936. [麻树人. 钾离子通道与消化道恶性肿瘤[J]. 中国实用内科杂志, 2006, 26(24): 1934-1936.]
[15] Breier A, Gibalova L, Seres M, et al. New insight into p-glycoprotein as a drug target[J]. Anticancer Agents Med Chem, 2013, 13(1): 159-170.
[16] Pop IV, Pop LM, Ghetie MA, et al. Targeting mammalian target of rapamycin to both downregulate and disable the P-glycoprotein pump in multidrug- resistant B-cell lymphoma cell lines[J]. Leuk Lymphoma, 2009, 509(7): 1155-1162.
Effects of autophagy on multidrug resistance of drug resistant LoVo/Adr cells of colon carcinoma
MA Qiang, CHANG Zong-hong, WANG Biao-meng, WANG Wei, DENG Shang-xin
Department of Gastroenterology, General Hospital of Lanzhou Command, Lanzhou 730050, China
ObjectiveTo observe the effects of autophagy on multidrug resistance (MDR) of drug resistant LoVo/Adr cells of colon carcinoma.MethodsThe formation of autophagosomes was monitored with transmission electron microscopy, and autophagy rate was measured with the aid of MDC staining and flow cytometry. IC50value of adriamycin (ADR) on colon carcinoma cells was detected by MTT assay. The mRNA level of MDR1 gene was measured by RT-PCR, and P-gp protein expression was detected by Western blotting.ResultsThe sporadic autophagosomes or green epoptic dots were found to distribute in LoVo/ Adr cells with an autophagy rate of 3.1%±0.5%. A large number of autophagosomes were seen after being treated with ADR or rapamycin (RAPA) with the autophagy rates of 33.6%±5.1% and 45.2%±6.1%, respectively (P<0.05). After being treated with ADR combining RAPA, autophagosomes appeared abundantly with an autophagy rate of 76.2%±7.4%, which was significantly higher than that when treated with ADR or RAPA alone (P<0.05). The IC50value of LoVo/Adr cells on ADR was 3.05±0.52mg/L, which decreased to 1.12±0.21mg/L after being treated with RAPA (P<0.01). RAPA could reverse MDR with a reversal ratio of 2.26. High expression of mRNA and protein of MDR1 gene were observed in LoVo/Adr cells. When treated with RAPA, the expression of MDR1 mRNA decreased from 1.42±0.31 to 0.54±0.20 (P<0.05), and the expression of P-gp protein also decreased significantly from 0.67±0.14 to 0.15±0.08 (P<0.01).ConclusionMDR LoVo/Adr cell shows a low autophagic activity, and RAPA can reverse MDR by increasing autophagy activity. The reversal path might be related with the increase of cell autophagic death and the decrease in MDR1 gene expression in LoVo/Adr cells.
autophagy; multidrug resistance-associated proteins; P-glycoprotein; colorectal neoplasms
R735.35
A
0577-7402(2013)11-0900-05
10.11855/j.issn.0577-7402.2013.11.007
2013-06-27;
2013-9-03)
(责任编辑:熊晓然)
马强,医学博士,副主任医师。主要从事大肠癌疾病的基础及临床研究工作
730050 兰州军区总医院消化科(马强、常宗宏、王彪猛、王维、邓尚新)
