一株拮抗绿脓杆菌的抗菌蛋白产生菌的分离与鉴定
2013-08-01汪雅琴张孝彬卫泽峰
余 瑛,汪雅琴,张孝彬,卫泽峰
(重庆理工大学药学与生物工程学院,重庆 400054)
绿脓杆菌(pseudomonas aeruginosa,PA)为人类三大机会致病菌之一,对机体免疫功能低下人群有强致病性。近年来该菌的临床感染率逐年增高,且耐药菌株不断出现,使得感染后的治疗越来越困难。抗菌蛋白(或抗菌肽)是一类普遍存在于生物体内的阳离子多肽,具有抗菌谱广、作用强、起效快、不易产生耐药性等优点[1],已日益引起广泛关注,成为一类极具开发潜力的新型抗感染制剂。本研究从土壤微生物中筛选出一株拮抗PA的菌株,并对其活性成分进行分离和鉴定,为将来进行新型抗PA药物研发奠定基础。
1 材料与方法
1.1 材料
1)供试菌株。PA标准菌株PA01,由第三军医大学西南医院惠赠。
2)土壤样品。取自第三军医大学西南医院周边土壤。
3)培养基。LB液体培养基:胰蛋白胨10%,酵母膏5%,NaCl 10%,pH值为7.2。发酵培养基:酵母膏3%,胰蛋白胨5%,葡萄糖3%,NaCl 5%,pH值为7.2。抑菌平板培养基:琼脂1%,胰蛋白胨 2.5%,酵母膏 1.3%,NaCl 2.5%,pH 值为7.2。筛选培养基:胰蛋白胨5%,酵母膏2.5%,NaCl 5%,琼脂1%,pH 值为7.2。
4)主要试剂。宽分子量蛋白Marker(TaKa-Ra);柱式小量细菌基因组DNA抽提试剂盒(上海华舜生物技术有限公司生产);16S rDNA Bacterial Identification PCR Kit(TaKaRa)Sephadex G-100(Rharmacia)。
1.2 方法
1)土壤的采集。采用多点取样法采集医院周边土壤,取回后于4℃保存。
2)拮抗PA的菌株的分离采用双层平板法。取过夜培养的PA01 1 mL与50℃筛选培养基混匀,倒入平板自然冷却,待其凝固即制成下层培养基。将土壤样品充分研磨,静置1 h后取上清。对土壤上清进行梯度稀释,取1 mL与50℃筛选培养基混匀,倒入冷却的下层培养基上,待其自然冷却凝固即制成双层培养基。37℃培养,观察是否有抑菌圈形成。
用灭菌牙签挑取在双层平板上产生透明抑菌圈的菌落,点接到新的双层平板上,37℃培养3 d,观察其是否再次产生抑菌圈。将再次产生抑菌圈的菌株在LB平板上进行划线培养,连续继代3次纯化菌种并保存。
3)拮抗PA的菌株鉴定采用形态学方法和16SrDNA分析法。形态学观察包括对分离菌株在LB平板上的菌落形态观察和革兰氏染色[2]观察。16S rDNA分析方法如下:从平板上挑取分离菌株的单克隆接种于LB液体培养基,37℃,250 r/min过夜培养。次日收集菌体,按照柱式小量细菌基因组DNA抽提试剂盒的说明提取其基因组DNA。以基因组DNA为模板,采用16S rDNA Bacterial I-dentification PCR Kit扩增16S rDNA,扩增产物交上海博尚生物有限公司进行测序。对测序结果进行BLAST和RDB分析。
4)拮抗PA活性的测定参照A.Berger[1]的方法,并做如下改进:在直径100 mm的平板中加入50 mL 50℃左右的抑菌平板培养基,待冷却后,在其上均匀涂布100 μLPA菌悬液。用打孔器在指示平板上打直径9 mm的孔,加入发酵液或目标蛋白,37℃孵育24 h,观察并测量抑菌圈大小。
5)分离菌的发酵培养及拮抗PA抗菌蛋白的分离。挑取分离菌株的单克隆,接种100 mL LB液体培养基,37℃,250 r/min培养24 h。取培养液按体积比1∶100接种发酵培养基,发酵48 h后离心收集上清。用饱和度为30%和60%的硫酸铵分步沉淀发酵上清,弃30%硫酸铵沉淀物。60%的硫酸铵沉淀后,离心收集沉淀。用 pH值为7.4,50 mmol/L的Tris-HCl按体积比1:1溶解沉淀,然后转入Sephadex G-100层析柱进行分离,流速为3 mL/min。用OD280检测,收集各吸收峰的流出液,并测定其抗PA活性。SDS-PAGE电泳[3]测定各吸收峰蛋白质分子量。
6)进行拮抗PA抗菌蛋白的特性分析。①高温耐受性分析:稀释活性峰流出液至50 μg/mL,各取 100 μL,分别于 4℃、37℃、45℃、65℃、100℃处理15 min,测定其抗PA活性。② 蛋白酶K的敏感性分析:稀释活性峰流出液至50 μg/mL,各取 100 μL加入 l mg/mL蛋白酶 K,37℃ 温育30 min,测定其抗PA活性。
2 结果与分析
2.1 拮抗PA的菌株筛选与鉴定结果
采用筛选培养基筛选、分离出菌株 B105。B105在LB固体平板上菌落呈现乳白色,半透明,圆形,中间凸起(见图1(a))。革兰氏染色阴性,菌体长1.2 ×1.0 μm,为短杆菌(见图 1(b))。

图1 B105的形态特征
以提取的各分离菌的基因组DNA为模板,分别采用16S rDNA Bacterial Identification PCR Kit中的引物 P1、P2和 P1、P3扩增16S rDNA。扩增产物在1.5%琼脂糖凝胶中进行电泳。结果显示,扩增产物大小与预期大小一致(见图2),P1、P2扩增产物为500 bp,P1、P3扩增产物为1 500 bp。
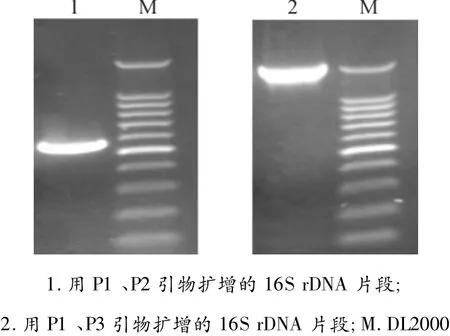
图2 16S rDNA扩增结果
16S rDNA扩增产物测序后,经BLAST比对及RDB分析,得出B105与Acinetobacter Iwoffii DSM 2403高度同源,同源性达99%,即 B105属于Acinetobacter(不动杆菌属)。
2.2 B105的发酵培养与拮抗PA活性成分的分离
将B105进行发酵培养后,离心收集发酵液。用饱和度为30%、60%的硫酸铵分步沉淀发酵上清。30%硫酸铵沉淀弃去,60%的硫酸铵沉淀用pH值为7.4的Tris-HC溶解后,采用G100层析柱进行分离,紫外检测显示流出液有2个主吸收峰。采用SDS-PAGE检测得出2个主吸收峰分离出的蛋白相对分子量约为50KD(峰1)和35KD(峰2)(见图3)。抗PA活性测定表明第2个主吸收峰流出液有拮抗PA活性。将第2个吸收峰流出液收集用于高温耐受性和蛋白酶K敏感性分析。
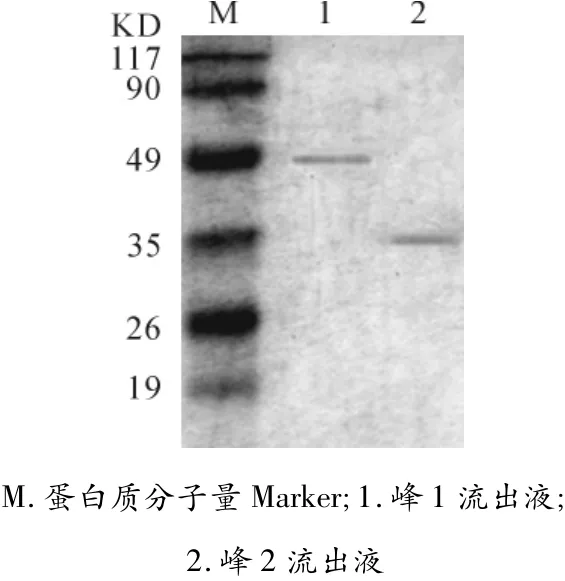
图3 SDS-PAGE电泳测定B105抗菌蛋白的分子量
2.3 B105拮抗PA的活性成分的特性分析
取上述第2个吸收峰流出液稀释液100 μL,分别用4℃、45℃、65℃、100℃处理测定其拮抗PA的活性。抑菌活性测定结果显示,B105产生的抗菌蛋白在经45℃以上高温处理后抑菌环直径变小甚至丧失(见图4)。该结果提示B105产生的抗菌蛋白抗菌活性不稳定,45℃以上高温可破坏其抗PA活性。
取上述第2个吸收峰流出液稀释液100μL,用蛋白酶K处理后进行抑菌活性测定,结果显示其抑菌活性显著降低(见图5)。该结果提示B105拮抗PA的活性成分对蛋白酶K敏感。
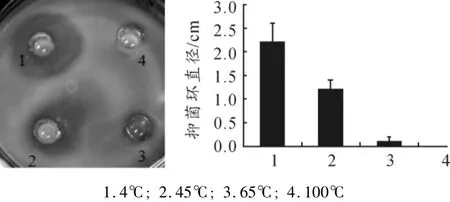
图4 B105抗菌蛋白的高温耐受性测定

图5 B105拮抗PA的活性成分的蛋白酶K敏感性测定
3 讨论
PA广泛存在于自然界中,也分布于正常人的皮肤、呼吸道和肠道等与外界相通的腔道中,特别是在呼吸道中定植菌或感染菌最为常见,当机体免疫功能下降时,易发生感染。据文献报告,绿脓杆菌感染主要发生于重症监护室、呼吸科、肿瘤科与老年病科。临床上以肺炎、败血症、腹腔炎症、烧伤、脓毒症、尿路感染最为常见,其中绿脓杆菌肺炎病死率高达30%以上,绿脓杆菌败血症的病死率达80%以上[4]。研究发现PA具有多种针对抗生素的耐药机制[5],耐药菌株不断增多使得抗PA感染治疗药物日益匮乏,寻找新型抗PA药物已刻不容缓。抗菌蛋白或抗菌肽的抗菌机制与抗生素完全不同,不易产生抗药性,是理想的替代抗生素的新型抗感染药物候选分子。在适当抑菌浓度下,抗菌蛋白或抗菌肽能在体内以直接杀死病原菌的方式起作用,与生物膜组成成分或胞内细胞器等多种微生物靶位相互作用,破坏其完整性,干扰细胞正常代谢活动,导致细菌死亡。抗菌蛋白或抗菌肽同样也可以作为免疫效应分子来启动、调节宿主免疫体系,促进免疫功能,从而消除感染,保护宿主免受病原微生物伤害[6-8]。然而,天然抗菌蛋白或抗菌肽作为药物使用也存在不足,如具有抗菌活性不稳定、进入体内后易被蛋白酶水解等普遍问题。本项目筛选出的不动杆菌产生的抗菌蛋白具有很好的抗PA活性,是进行抗PA药物研发的理想的候选分子,但它在高温或蛋白酶K处理后抗PA活性容易丧失,还需要进行结构修饰、改造等相关研究来增强其抗菌活性的稳定性及提高其抗水解能力,以延长其半衰期。
[1]Berger A,Htran A,Dedier H,et al.Antimicrobial properties of hemokinin-1 against strains of Pseudomonas aeruginosa[J].Life Sciences,2009,85:700 -703.
[2]周长林.微生物学实验与指导[M].北京:中国医药科技出版社,2008.
[3]王家政,范明.蛋白质技术手册[K].北京:科学出版社,2001.
[4]Bergmans D,Bonten M,van Tiel F H,et al.Cross-colonisation with Pseudomonas aeruginosa of patients in an intensive care unit[J].Thorax,1998,53(12):1053-1058.
[5]Zavascki A P,Carvalhaes C G,Picao R C,et al.Multidrug-resistant pseudomonas aeruginosa and acinetobacter baumannii:resistance mechanisms and implications for therapy[J].Expert Rev Anti Infect Ther,2010,8(1):71-93.
[6]Bolintimeanu D,Hazrati E,Tdavis H,et al.Antimicrobial mechanism of pore-forming protegrin peptides:100 pores to kill E.coli[J].Peptides,2009(31):1 -8.
[7]Oyston P C,Fox M A,Richards S J,et al.Novel peptie therapeutics for treatment of infections[J].J Med Microbiol,2009(58):977 -987.
[8]Vad B,Athomsen L,Bertelsen K,et al.Divorcing folding from function:How acylation affects the membrane-perturbing properties of an antimicrobial peptide[J].Biochimicaet Biophysica Acta,2010,1804(4):806 -820.
