鬼针草提取物对去势所致的干眼症雄兔泪液分泌影响的实验研究
2013-07-29施炜张传伟王育良
施炜 张传伟 王育良
干眼症为任何原因所致泪液质或量或动力学的异常,从而导致泪膜不稳定和(或)眼表面的异常,并伴有眼部不适症状的一类疾病。引起干眼症的病因很多,近年来国内外研究表明,性激素,尤其是雄激素水平下降后,对泪腺调节作用异常,导致泪膜不稳定、局部炎症反应加重,最终导致干眼症。鬼针草为菊科植物鬼针草的全草。全草含生物碱、鞣质、皂甙、黄酮甙。黄酮类化合物化学结构与雄激素类似,可能起到拟雄激素活性作用,同时鬼针草中含大量胆碱,非消炎成分,却可引起不良反应如唾液分泌、流泪等。我们制作去势兔干眼模型,旨在探讨鬼针草提取物对抗雄激素水平下降导致干眼的作用机制以及治疗效果。
1 材料和方法
1.1 主要材料及试剂 0.125%荧光素溶液,Schirmer试纸(天津晶明新技术开发有限公司),鬼针草颗粒剂(江苏省中医院)。
1.2 动物选择与分组 将2 月龄13 只新西兰雄性大白兔,随机分为3 组,空白组(A 组)3 只、模型组(B 组)5 只、鬼针草提取物治疗组(C 组)5 只,将B、C 组实验雄兔行双侧睾丸切除术制作雄激素水平下降所导致的干眼模型,对C 组以鬼针草提取物连续灌胃6 周。
对全部实验兔造模前后行角膜荧光染色(FI),泪膜破膜时间(BUT)测定、基础泪液分泌量SchirmerⅠ试验。
1.3 用药方法 鬼针草提取物稀释液根据兔体质量配比率0.1g/(ml·kg)予治疗组每天上午10 点灌胃1次。每组分别于造模前及造模后第7、14、21、28、35、42 天行表面麻醉后Fl、BUT、基础泪液分泌量检测,检测由同一人在同一环境中进行。
1.4 检查方法 检查前结膜囊先滴倍诺喜眼液表面麻醉,10 min 后,将Schirmer 试纸圆头端沿折线处折叠插入兔下方结膜囊后半部5 min 后,取出试纸测量其湿长。FI 及BUT 实验按常规进行。
1.5 FI 评分标准 过角膜中心作水平与垂直两条线将角膜分为四个区,每个区按0、1、2、3 评分,规定无染色为0,有染色则分轻、中、重3 级,共12 分[1]。
1.6 统计学分析 采用SPSS 18.0 软件包进行统计学分析。自身前后比较采用配对t 检验,两组间比较采用成组t 检验,P <0.05 为差异有统计意义。
2 结果
2.1 基础泪液分泌量比较 A 组基础泪液分泌量无显著性变化。B 组造模后2 周基础泪夜分泌量明显减少(P <0.05),C 组造模后1 ~3 周基础泪夜分泌量明显增加(P <0.05),造模后4 ~5 周与造模前相比无显著性差异,C 组各时段基础泪液分泌量较B 组明显增加(P <0.05)。见表1。
表1 3 组基础泪液分泌量造模前后比较(±s,分)

表1 3 组基础泪液分泌量造模前后比较(±s,分)
注:与造模前比较,* P <0.05;与模型组比较,△P <0.05
组别造模前第7 天第14 天第21 天第28 天第35 天第42天120.67 ±1.2121.67 ±2.4221.17 ±1.94(n=3)B 组14.75 ±1.6713.63 ±4.7210.13 ±3.34*9.50 ±3.21*8.75 ±3.33*8.63 ±3.02*7.75 ±2.49*(n=5)C 组15.00 ±1.0518.00 ±3.16*△ 18.60 ±2.55*△ 17.10 ±1.97*△ 16.30 ±1.77△ 15.70 ±1.70△ 16.80 ±2.25△(n=5)A 组20.50 ±2.1720.17 ±2.3219.83 ±0.9821.33 ±1.5
2.2 角膜FI 比较 A 组角膜FI 无显著性变化。B 组造模后3 周角膜FI 无显著性差异,其余时段角膜FI增加(P <0.05),C 组角膜FI 在各时段无显著性差异。见表2。
表2 3 组角膜FI 造模前后比较(±s,分)
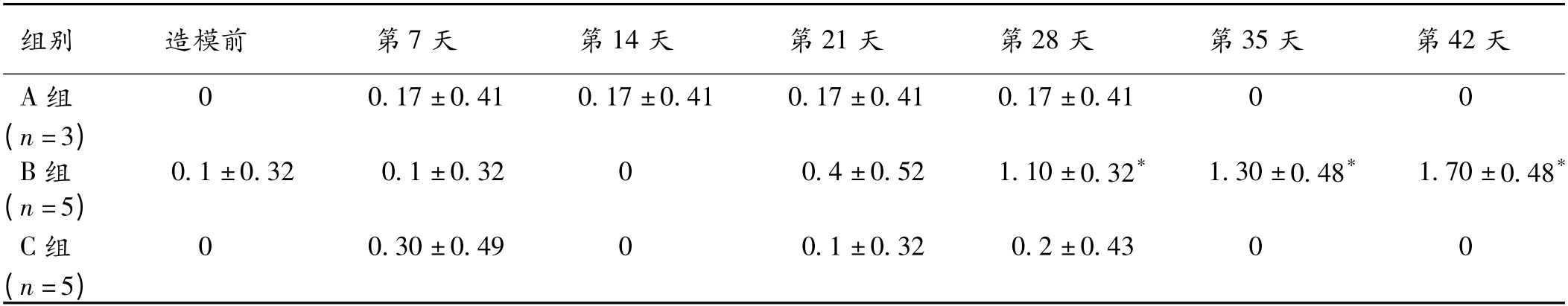
表2 3 组角膜FI 造模前后比较(±s,分)
注:与造模前比较,* P <0.05
组别造模前第7 天第14 天第21 天第28 天第35 天第42天0.17 ±0.410.17 ±0.410.17 ±0.410.17 ±0.4100(n=3)B 组0.1 ±0.320.1 ±0.3200.4 ±0.521.10 ±0.32*1.30 ±0.48*1.70 ±0.48*(n=5)C 组00.30 ±0.4900.1 ±0.320.2 ±0.4300(n=5)A 组0
2.3 BUT 比较 A 组BUT 无显著性变化。B 组造模后1 ~2 周BUT 与造模前相比减少不明显,3 ~6 周BUT与造模前相比明显减少(P <0.05);C 组在造模后1 周BUT 稍延长,无显著性差异,2 ~5 周明显延长(P <0.05);B 组于2 ~6 周,BUT 明显减少,C 组BUT 增加或维持不变,2 组相比有显著性差异(P <0.05)。见表3。
表3 3 组BUT 造模前后比较(±s,分)
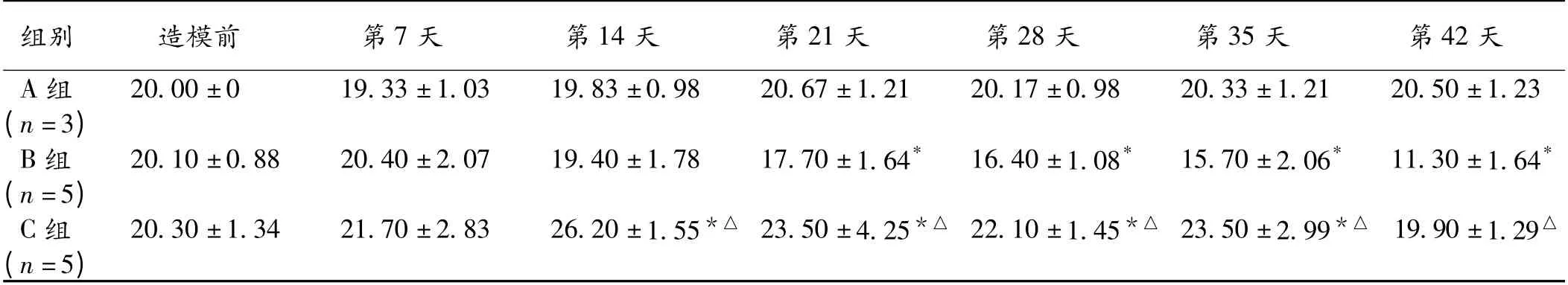
表3 3 组BUT 造模前后比较(±s,分)
注:与造模前比较,* P <0.05;与B 组比较,△P <0.05
组别造模前第7 天第14 天第21 天第28 天第35 天第42天.17 ±0.9820.33 ±1.2120.50 ±1.23(n=3)B 组20.10 ±0.8820.40 ±2.0719.40 ±1.7817.70 ±1.64*16.40 ±1.08*15.70 ±2.06*11.30 ±1.64*(n=5)C 组20.30 ±1.3421.70 ±2.8326.20 ±1.55*△ 23.50 ±4.25*△ 22.10 ±1.45*△ 23.50 ±2.99*△ 19.90±1.29△(n=5)A 组20.00 ±019.33 ±1.0319.83 ±0.9820.67 ±1.2120
3 讨论
引起干眼的病因很多,环境因素、个人习惯等引起的轻度干眼症患者(如长时间使用电脑、长期处于空调环境等)仅出现较轻的症状,而无明显的眼表损害,这些影响因素的及时改善可使眼部不适感消失;但对于局部或全身有明确病因引起的干眼症(如眼表化学及热烧伤、Sjgren 综合征、过敏、睑缘炎等),其发病机制十分复杂[2]。眼是性激素作用的靶器官,性激素尤其是雄激素,可调节机体及局部的免疫功能,调控泪腺和睑板腺的形态、发育、分化及分泌功能。由绝经、衰老、自身免疫疾病、抗雄激素药物等引起雄激素缺乏的原因均可引起干眼症。Sullivan 等[3]研究发现女性Sjgren 综合征患者体内雄激素水平普遍降低。单纯的雄激素缺乏可能并不引起干眼症,但加速干眼症患者的病情恶化[4]。雄激素在干眼发病机制中具有较为肯定的作用,但是雄激素不是单独发挥作用的,多种性激素之间通过相互作用、相互影响、相互转化共同影响机体内分泌环境,维持雄激素的最佳生物水平对于泪液分泌功能十分重要[5]。
关于雄性激素治疗干眼的机制仍不清楚,有研究发现泪腺和睑板腺都是雄激素靶器官,雄激素通过对泪腺、睑板腺分泌功能的影响,在泪膜结构和功能发生改变的机制中起作用[6]。
现代医学认为,鬼针草含生物碱、鞣质、皂甙、黄酮甙。茎叶含挥发油、鞣质、苦味质、胆碱等,并含多种氨基酸、胡萝卜素和维生素等。用乙醇浸液在体外对革兰氏阳性细菌有抑菌作用,花、茎对金黄色葡萄球菌也有抑菌作用。鬼针草提取物中含有大量黄酮类物质,研究已证明某些黄酮类化合物具有拟雄激素作用[7]。
在本次实验过程中,模型组在造模后1 周基础泪液分泌量无显著性变化,其余时段泪流量明显减少,治疗组各时段泪流量明显增加,考虑为鬼针草拟胆碱作用,促进泪腺分泌增加所致。模型组在造模后3 周角膜FI 无显著性变化,其余时段角膜FI 显著增加,治疗组FI 在各时段无显著性变化。考虑为前期是第三眼睑的保护及角膜细胞凋亡作用尚未明显表现所致。模型组在造模后前2 周BUT 与造模前减少不明显,第3周后BUT 与造模前相比明显减少;治疗组造模后2 ~6周与模型组相比,BUT 明显延长。表明鬼针草具有拟性激素及胆碱作用,对泪腺细胞具有促进分泌,保护泪腺细胞凋亡作用。
因此,鬼针草提取物可显著抑制雄激素水平降低后兔干眼的发生。其作用机制可能与黄酮类物质化学结构与雄激素类似,可起到拟雄激素效应,同时其拟胆碱作用在增加泪液流量、延长BUT、改善FI 等方面都有一定的作用。鬼针草提取物可能成为治疗干眼的新途径。
[1] Koh S,Watanabe H,Hosohata J,et al. Diagnosing dry eye using a blue-free barrier filter[J]. Am J Ophthalmol,2003,136(3):513-519.
[2] Stern ME,Gao J,Siemasko KF,et al.The role of the lacrimal functional unit in the pathophysiology of dry eye[J]. Exp Eye Res,2004,78(3):409-416.
[3] Sullivan DA,Belanger A,Cermak JM,et al. Are women with Sjgrens syndrome androgen-deficient?[J]. J Rheumatol,2003,30(11):2413-2419.
[4] Sullivan DA,Krenzer KL,Sullivan BD,et al. Does androgen insufficiency cause lacrimal gland inflammation and aqueous tear deficiency?[J]. Invest Ophthalmol Vis Sci,1999,40(6):1261-1265.
[5] Oprea L,Tiberghien A,Creuzot-Garcher C,et al. Hormonal regulatory influence in tear film[J]. J Fr Ophtalmol,2004,27(8):933-941.
[6] Sullivan DA,Wickham LA,Rocha EM,et al. Androgens and dry eye in Sjogrens syndrome [J]. Ann N Y Acad Sci,1999,876:312-324.
[7] 黄秀兰,周亚伟,王伟.淫羊藿黄酮类化合物药理研究进展[J].中成药,2005,27(6):719-781.
