乙酰胆碱在大鼠海马CA1区痛觉调制中的作用
2013-07-28贾伟伟卢长柱王月飞徐满英
肖 宇,贾伟伟,李 雪,卢长柱,王月飞,霍 红,徐满英
(齐齐哈尔医学院1.生理学教研室、2.机能学教研室,黑龙江 齐齐哈尔 161006;3.黑龙江省医院循环内科,黑龙江哈尔滨 150036;4.哈尔滨医科大学生理学教研室,黑龙江哈尔滨 150081)
乙酰胆碱(acetylcholine,ACh)广泛的分布于哺乳动物的中枢和外周神经系统,作为一种重要的兴奋性神经递质,参与学习、记忆、睡眠、觉醒、体温等生理功能的调节[1]。近几年研究表明,ACh在伤害性信息的感觉和调控中起关键作用。在多种病理性疼痛的动物模型中发现,脑内某些部位(如边缘系统)M受体明显上调,这表明疼痛刺激可激活中枢的胆碱能系统。全身及椎管内应用胆碱酯酶抑制剂或不同亚型的胆碱能M受体激动剂可以提高痛阈,产生不同程度的镇痛作用[2]。
海马结构的发育成熟是学习记忆、痛反应、逃避行为等的基础,新生鼠的海马损伤能够改变伤害性信息的处理机制[3]。海马的皮质分为 CA1、CA2、CA3和CA4四个区,其中CA1区被大量的研究证实与痛觉调制密切相关。向海马CA1区内注射微量的NMDA受体拮抗剂MK-801、AP-5或5-羟色胺受体拮抗剂利坦色林可以减轻动物疼痛反应,表现出强烈镇痛效应,说明NMDA受体和5-TH受体系统参与了海马镇痛作用[4]。但海马内的胆碱能系统与疼痛的关系不是十分清楚[5]。本实验采用细胞外记录神经元放电的方法,观察侧脑室微量注射ACh及其M受体拮抗剂阿托品、受体激动剂毛果芸香碱对伤害性刺激引起的海马CA1区中痛兴奋神经元(pain-excitation neurons,PEN)和痛抑制神经元(pain-inhibition neurons,PIN)痛诱发电活动的影响,进而分析海马CA1区中ACh及其M受体在痛觉信息调制中的作用。
1 材料与方法
1.1 实验动物 选用成年、健康 Wistar大鼠,清洁级,♂♀不拘,体质量为200~280 g(哈尔滨医科大学附属第二医院动物中心提供,级别:Ⅱ,许可证号:黑20020002)。
1.2 实验方法 将70只大鼠随机分为4组:生理盐水组10只,ACh组20只,ACh+阿托品组20只,毛果芸香碱组20只。大鼠用氨基甲酸乙酯(200 g·L-1,5 ml·kg-1)腹腔注射麻醉,实施常规手术即气管插管、颅骨开窗、分离坐骨神经及按Pellegrino图谱B坐标系统[6],将外径0.8 mm 的“H”型不锈钢脑室套管插入侧脑室内(A:0.2 mm;L、R:1.5 mm;H:3.0 mm)供注药用。将大鼠的头固定在SN-2立体定位仪上。将内充3 mol·L-1氯化钾溶液、尖端直径0.5 ~1.0 μm,直流电阻为10 ~30 MΩ的玻璃微电极固定在SM-21型微电极操纵器上。用呼吸机维持呼吸,腹腔注射1 g·L-1氯化筒箭毒碱(1 ml·kg-1)用以制动,松弛肌肉,排除肌细胞电活动对本实验的影响。按Pellegrino图谱B座标系统,将微电极插入CA1区(A:-3.2~-4.0 mm;L/R:2.5~3.0 mm;H:2.5~3.1 mm)内,由微电极引导神经元放电,经前级放大器放大,显示于示波器上,并以(强度:5 mA,波宽:0.3 ms,间隔:5 ms,脉冲:5个)的串脉冲刺激坐骨神经作为伤害性刺激,引导痛反应神经元的放电。然后用ZCZ-50型自动抽注仪向侧脑室匀速注入ACh(20 g·L-1,10 μl),阿托品(5 g·L-1,10 μl)或毛果芸香碱(20 g·L-1,10 μl),所有药品均在 2 min内注完。观察注药前、后 PEN和 PIN电活动的变化,并用 STCH707X型双道磁带记录器记录。
1.3 数据处理和统计学分析 实验数据经数据处理仪Powerlab/8 s(ADInstruments)和Chart v5.3软件分析。所有数据均以±s表示,统计学处理使用SPSS 16.0软件进行分析。统计差异用重复测量方差分析和F检验。组间差异的显著性用LSD法。
2 结果
2.1 侧脑室微量注射ACh对大鼠海马CA1区中PEN电活动的影响 ACh组,记录到25个PEN。注入ACh后2 min PEN诱发放电净增值开始减少,放电潜伏期延长(Fig 1b)。在注药后4 min作用达到高峰,净增值由注药前(9.18±2.03)Hz减少至(2.95±1.03)Hz;PEN诱发放电潜伏期由注药前的(140±16.9)ms延长至(580±47.7)ms。注药后2~12 min,PEN 的净增值(F=3.675,P <0.05)和潜伏期(F=4.985,P<0.01)与生理盐水组同期数据相比差异有显著性(Fig 2)。注药后14 min PEN的净增值和潜伏期开始逐渐恢复。生理盐水组在注入生理盐水前、后PEN的放电活动无明显变化(Fig 1a,Fig 2)。
ACh+阿托品组,记录到23个 PEN。注入ACh后2 min,PEN诱发放电净增值减少,潜伏期延长(Fig 1c)。注入阿托品即刻,ACh对PEN电活动的抑制作用开始减弱。注入阿托品后2 min净增值增加到(7.31±1.28)Hz,潜伏期缩短为(220±26.3)ms,PEN放电活动基本恢复正常。注射阿托品后0 ~8 min,PEN的净增值(F=2.378,P<0.01)和潜伏期(F=4.257,P<0.05)与 ACh组同期相比差异有显著性(Fig 2)。
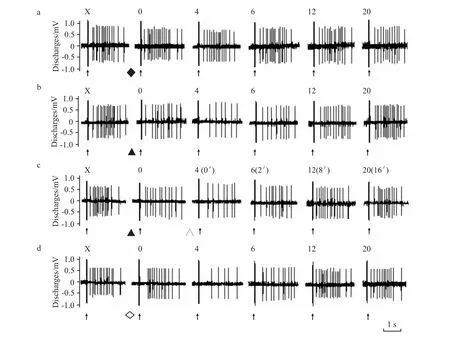
Fig 1 Effects of icv injection of saline(a),ACh(b),atropine(c),pilocarpine(d)on the evoked discharge of PEN in the hippocampal CA1 area
毛果芸香碱组,记录到22个PEN。注入毛果芸香碱后2 min PEN诱发放电频率净增值开始减小,潜伏期延长,注药后4 min作用最明显(Fig 1d)。注毛果芸香碱后 2~12 min,PEN的净增值(F=3.149,P <0.05)和潜伏期(F=2.583,P <0.05)与生理盐水组同期相比,差异有显著性(Fig 2)。
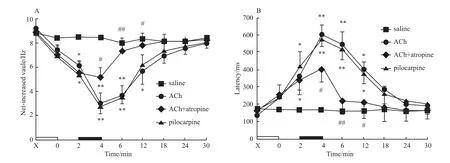
Fig 2 Effects of icv injection of different drugs on the NIV(A)and latency(B)of PENs in the CA1 area
2.2 侧脑室微量注射ACh对大鼠海马CA1区中PIN电活动的影响 ACh组,记录到20个PIN。注入ACh后2 min净增值开始增加,而完全抑制时程开始缩短(Fig 3b)。注药后4 min作用达到高峰,净增值由注药前的(-6.12±1.78)Hz增加至(-1.45±0.82)Hz,完全抑制时程由注药前的(440±37.8)ms缩短至(130±19.5)ms。注ACh后2~12 min,PIN 的净增值(F=5.184,P <0.01)和完全抑制时程(F=3.641,P<0.01),与生理盐水组同期相比差异有显著性(Fig 4)。注ACh后14 min,PIN诱发放电活动开始逐渐恢复。生理盐水组,注入生理盐水前、后PIN的电活动没有明显变化(Fig 3a,Fig 4)。
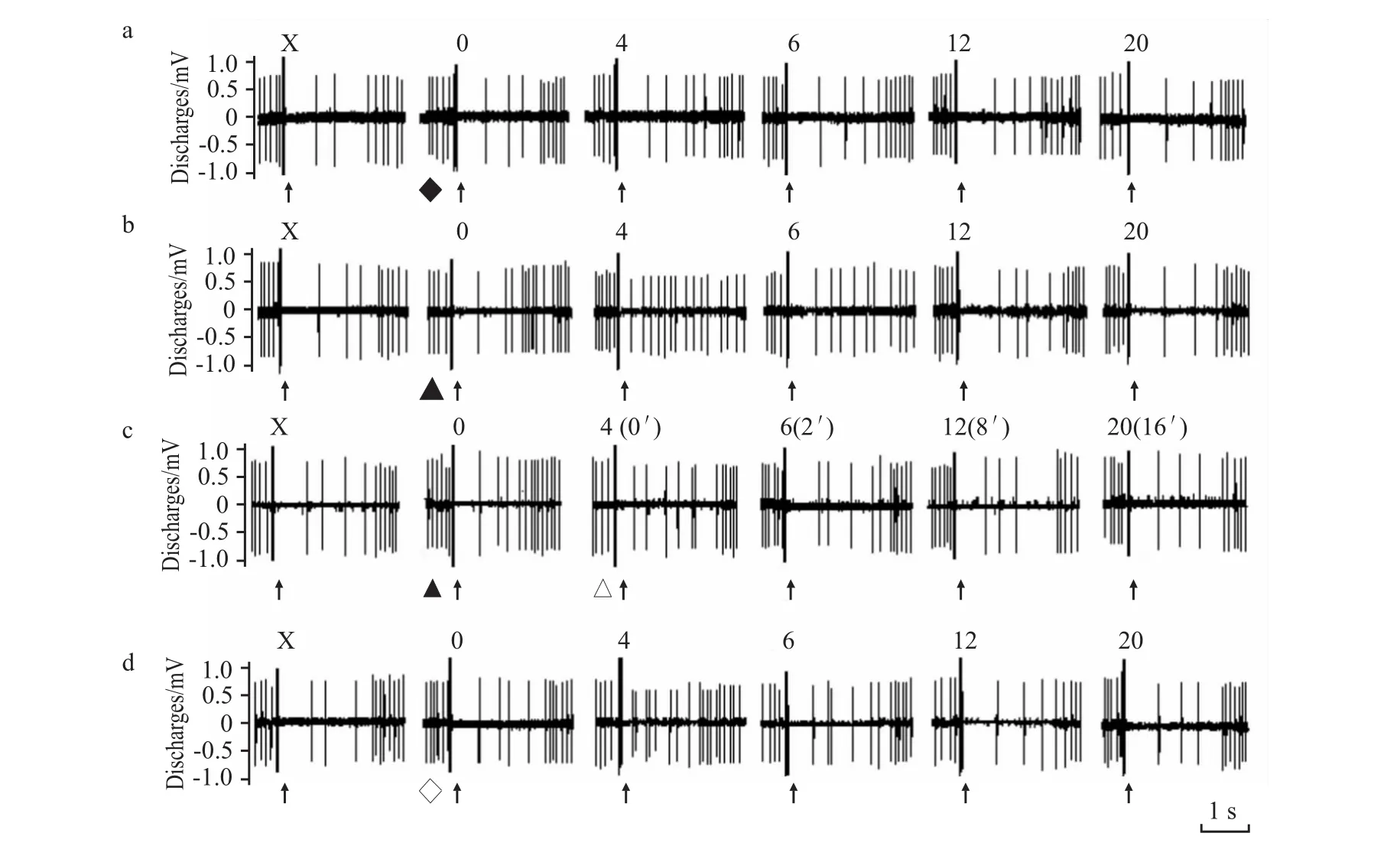
Fig 3 Effects of icv injection of saline(a),ACh(b),atropine(c),pilocarpine(d)on the evoked discharge of PIN in the hippocampal CA1 area
在ACh+阿托品组,记录到17个PIN。注入ACh后2 min,PIN诱发放电的净增值增加,完全抑制时程缩短。注入阿托品即刻,ACh对PIN电活动的作用开始减弱。注阿托品后2 min净增值减少到(-4.95±1.05)Hz,完全抑制时程延长到(350±29)ms,PIN放电活动明显恢复。注入阿托品后0~8 min,ACh+阿托品组PIN的净增值(F=3.963,P<0.01)和完全抑制时程(F=1.869,P<0.05)与ACh组同期相比差异有显著性(Fig 4)。
毛果芸香碱组,记录到19个PIN。注入毛果芸香碱后2 min,PIN的净增值开始增加,完全抑制时程缩短,注药后4 min作用最明显(Fig 3d)。注入毛果芸香碱后2~12 min,PIN的净增值(F=2.569,P<0.01)和完全抑制时程(F=5.762,P<0.05)与生理盐水组同期相比差异有显著性(Fig 4)。
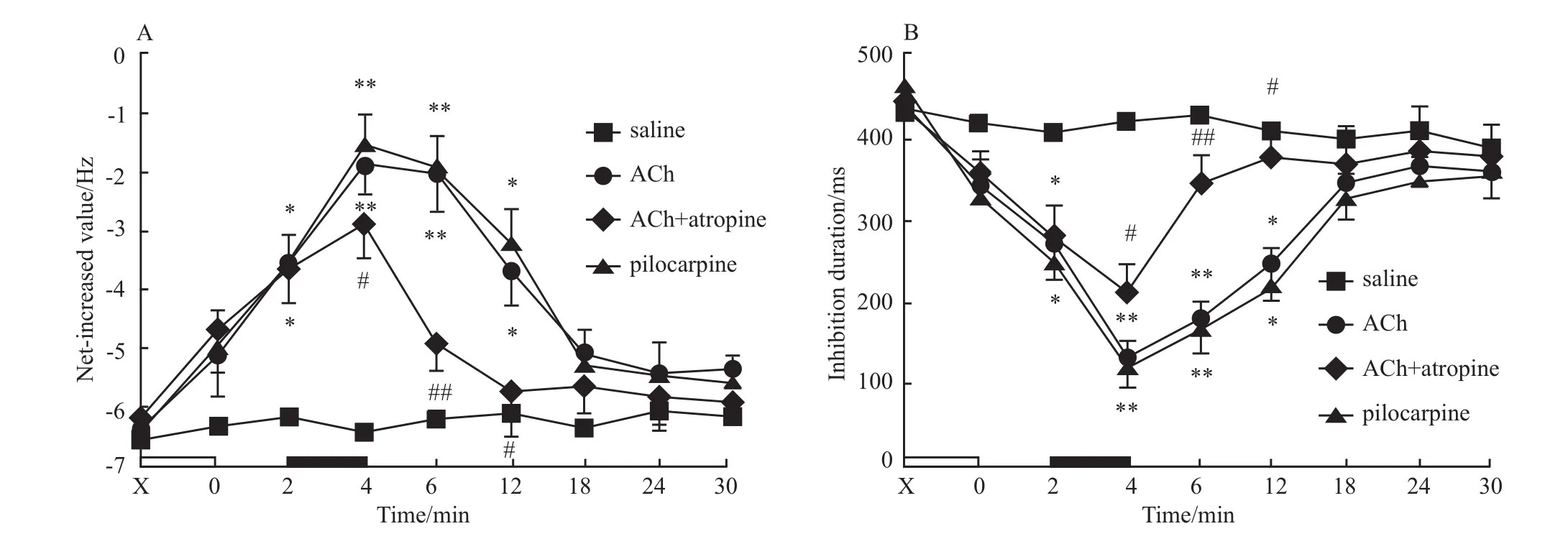
Fig 4 Effects of icv injection of different drugs on the NIV(A)and inhibition duration(B)of PINs in the CA1 area
3 讨论
海马结构参与了中枢神经系统许多重要功能的调节,并被认为是学习记忆的中枢。近年来,海马在痛觉感受和痛相关行为表现中的作用也得到广泛的研究和认可。认为海马可以接受痛觉传入,是伴有情绪活动的痛反应的较高级中枢。应用活体微量渗析技术和高效液相色谱分析技术研究发现疼痛可以激活海马内胆碱能神经元,导致CA1区锥体细胞ACh释放增加。文献报道激活胆碱能神经元的活动在多种动物(包括人类)中枢起抗伤害和镇痛作用[5,7]。Harte等发现的证据支持髓板内丘脑的 M受体参与了抗伤害性反应。药理实验表明向脑内的特定核团注射卡巴胆碱也起抗伤害性作用,并且这种作用可被M受体拮抗剂所逆转[8]。同时一些其它受体或药物的镇痛作用也可通过ACh来调节。Sumatriptan(5-HT受体激动剂)可通过加强胆碱能神经递质产生抗伤害性的作用[9]。本实验数据表明,侧脑室注入ACh使CA1区PEN诱发放电频率减少,潜伏期延长,抑制了PEN的痛诱发放电活动;使PIN痛诱发放电频率增多,完全抑制时程缩短,而增强了PIN的电活动。这些结果证明,外源性ACh可使大鼠海马CA1区内PEN对伤害性刺激的反应降低,同时PIN的电活动增强表现为镇痛效应。这与ACh在中枢神经系统的抗伤害性作用的观念是一致的。
海马结构中含有丰富的胆碱能纤维和胆碱能敏感细胞及受体,ACh在海马中作为一种重要的活性物质,参与海马生理功能的调节。中缝大核、束旁核、红核、缰核等部位注射胆碱能受体激动剂,可提高猫和大鼠的痛阈,并抑制内脏和躯体伤害性信息的传递[10-11]。在本实验中,侧脑室注入M受体激动剂毛果芸香碱产生与ACh相似的作用,抑制CA1区PEN的痛诱发放电活动,增强PIN痛诱发放电活动。而注入M受体抑制剂阿托品后,PEN的电活动迅速恢复到正常水平,说明阿托品可以翻转ACh的镇痛作用。提示,ACh的作用是通过M受体实现的。胆碱能受体的激动剂和拮抗剂在海马CA1区痛觉调制中的作用可能类似于ACh在脊髓水平的镇痛作用。Abelson等[12]揭示了脊髓ACh释放与痛阈的关系,ACh增加约30%可产生抗伤害性作用,若ACh减少30%则可产生痛觉过敏[12]。所以,给予外源性的ACh产生抗伤害性效应。此外,毛果芸香碱激活内源性的ACh产生相似的抗伤害性效应。而阿托品阻断了内源性的ACh产生致痛作用。也就是说在海马CA1区无论是内源性还是外源性的ACh都产生镇痛作用。
海马与隔核、尾核、中缝大核、前脑、纹状体等与痛觉的调制密切相关的核团有着广泛的纤维联系,而在这些部位均含有丰富的胆碱能纤维和胆碱能神经元分布。已有研究证实,隔核和前脑的胆碱能纤维投射至CA1区能够影响CA1区突触可塑性和CA1区锥体细胞的电活动[13]。所以,ACh也可能是作用于其它核团内的神经元,再间接地影响CA1区神经元活动。脑室注射比核团内注射牵涉范围广、影响因素多,可能影响到中枢的多个部位。为了减少这些因素的影响以及证明上述理论,在今后的实验中可以采用核团内注射药物的方法,观察其对大鼠CA1区痛反应神经元电活动的影响。因此,ACh对CA1区的作用路径及机制还有待于进一步的深入研究。
[1] 葛徐林,汪 海.非神经性乙酰胆碱系统的结构和功能特征[J].中国药理学通报,2009,25(6):712-5.
[1] Ge X L,Wang H.The structure and function of non-neuronal acetylcholine system[J].Chin Pharmacol Bull,2009,25(6):712-5.
[2] Pinardi G,Sierralta F,Miranda H F.Atropine reverses the antinociception of nonsteroidal anti-inflammatory drugs in the tail-flick test of mice[J].Pharmacol Biochem Behav,2003,74(3):603-8.
[3] Yamamotová A,Franek M,Vaculín S,et al.Different transfer of nociceptive sensitivity from rats with postnatal hippocampal lesions to control rats[J].Eur J Neurosc,2007,26(2):446-50.
[4] Soleimannejad E,Naghdi N,Semnanian S,et al.Antinociceptive effect of intra-hippocampal CA1 and dentate gyrus injection of MK801 and AP5 in the formalin test in adult male rats[J].Eur J Pharmacol,2007,562(1):39-46.
[5] Li G Z,Liang Q C,Jin Y H,et al.The effect of acetylcholine on pain-related electric activities in the hippocampal CA3 of rats[J].J Neural Transm,2011,118(4):555-61.
[6] Pellegrino L J,Pellegrino A S ,Cushman A J.A stereotaxic atlas of the rats brain[M].New York:Plenum Press,1979:81-5.
[7] Gordeev S A,Turbina L G,Zus'man A A,Posokhov S I.Study of nociceptive flexion reflex in healthy subjects and patients with chronic neuropathic pain syndrome [J].Bull Exp Biol Med,2012,154(2):189-91.
[8] Yaksh T L,Dirksen R,Harty G J.Antinociceptive effects of intrathecally injected cholinomimetic drugs in the rat and cat[J].Eur J Pharmacol,1985,117(1):81-8.
[9] Soleimannejad E,Naghdi N,Khatami S H,et al.Formalin pain increases the concentration of serotonin and its 5-hydroxyindoleacetic acid metabolite in the CA1 region of hippocampus[J].Daru,2010,18(1):29-34.
[10] Harte S E,Hoot M R,Borszcz G S.Involvement of the intralaminar parafascicular nucleus in muscarinic-induced antinociception in rats[J].Brain Res,2004,1019(1-2):152-61.
[11]黄 民,刘敏芝,李晓莹.红核的镇痛作用及其机制的初步探讨[J].针刺研究,1992,17(3):166-70.
[11] Huang M,Liu M Z,Li X Y.The analgesic effect of red nucleus and preliminary research on its mechanism [J].Zhenciyanjiu,1992,17(3):166-70.
[12] Abelson K S,Höglund A U.Intravenously administered oxotremorine and atropine,in doses known to affect pain threshold,affect the intraspinal release of acetylcholine in rats[J].Pharmacol Toxicol,2002,90(4):187-92.
[13] Remondes M,Schuman E M.Direct cortical input modulates plasticity and spiking in CA1 pyramidal neurons[J].Nature,2002,416(6882):736-40.
