RSD法优化紫葡萄皮花色苷超声辅助萃取工艺研究
2013-07-28肖功年李言郡林玲玲尤玉如
肖功年,李言郡,陈 波,林玲玲,尤玉如
(1.浙江科技学院 生物与化学工程学院,杭州310023;2.浙江省农产品化学与生物加工技术重点实验室,杭州310023;3.杭州娃哈哈集团有限公司,杭州310018)

图1 花色苷结构Fig.1 Structure of anthocyanidin
紫葡萄皮中含有大量糖苷,为花色苷配基花青素(anthocyanidin)[1-2],是苯丙吡喃(phenotyrilium)的衍生物,有黄酮的C6C3C6结构(图1)[3],具有阳离子的性质。葡萄中的花色苷主要为矢车菊素、飞燕草素、锦葵色素、甲基花青素及矮牵牛苷配基(petunidin)5种花色素诱导体[4-5]。据报道,花色苷具有降低肝脏及血清中脂肪含量、抗氧化、抗肿瘤、延缓血小板凝集等营养和药理作用,在食品、化妆品、医药领域有着巨大的应用潜力[6]。但花色苷通常不太稳定,在葡萄中主要以糖苷形式(即花色苷)存在。紫葡萄皮中糖苷提取较难,而超声波提取不改变有效成分的结构,并且缩短了提取时间,提高得率,为植物成分的提取提供了快速、高产的新方法[7-9]。影响超声波提取工艺的因素较多[10-11],本试验以紫葡萄皮为原料,采用响应面设计方法(response surface design,RSD),对超声功率、超声温度、超声时间、超声频率等因素进行优化,以提高超声辅助萃取紫葡萄皮花色苷产率,为紫葡萄皮及花色苷的综合利用和产品开发提供重要的实验和理论依据。
1 材料与方法
1.1 材 料
紫葡萄,购自杭州市农贸市场,无水甲醇、浓盐酸、氯化钾、无水乙酸钠均为分析纯试剂。
1.2 实验仪器
超声波药品处理机(JBT/C-YCL400T/3P(D)),离心机(KQ3200B),紫外可见分光光度计(UV-7504C),温度计,容量瓶,三口烧瓶,量筒,玻璃棒,药匙,铁架台,移液管,滴定管等。
1.3 RSD优化提取超声工艺设计
在前期研究基础上,确定超声波的功率(额定功率,154~286W)、温度(30~50℃)、频率(25~70kHz)和时间(25~45min)对紫葡萄皮花色苷的提取影响较大。以70%乙醇为萃取溶剂,应用Box-Behnken中心组合进行四因素三水平的实验设计(取α=2),见表1。以花色苷的吸光值为响应值,进行响应面分析,优化葡萄皮花色苷超声波提取条件。

表1 实验因素及水平Table 1 Experimental factors and levels
1.4 花色苷的测定
采用pH示差法测定花色苷总量[11]。确定两个对花色苷吸光度差别最大但使花色苷稳定的pH值,因葡萄皮花青素在pH1.0和pH4.5处的吸光值差是极大[12],故选定pH1.0和pH4.5两个pH值测定花色苷的吸光值。
将提取液分别用两组缓冲溶液稀释10倍,静置2h,测定其在520nm和700nm处的吸光值。
pH4.5的缓冲液V(1NNaAc)∶V(1NHC1)∶V(H2O)=100∶60∶90;
pH1.0的缓冲液V(0.2NKCl)∶V(0.2NHCl)=25∶67。
花色苷吸光值=(Aλ520pH1.0-Aλ700pH1.0)-(Aλ520pH4.5-Aλ700pH4.5)
根据 T.Fuleki[12]的研究,计算方法如下:

式中:ΔA= (A520-A700)pH1.0- (A520-A700)pH4.5;V— 花色苷溶液体积,mL;F— 稀释倍数;avE1%1cm—平均消光系数,98.2[13];m— 鲜葡萄皮质量,g。
2 结果与分析
在单因素实验的基础上对四因素进行二次回归设计试验和分析,吸光值为响应值,实验采用Box-Behnken中心组合设计,设计方案及结果见表2。
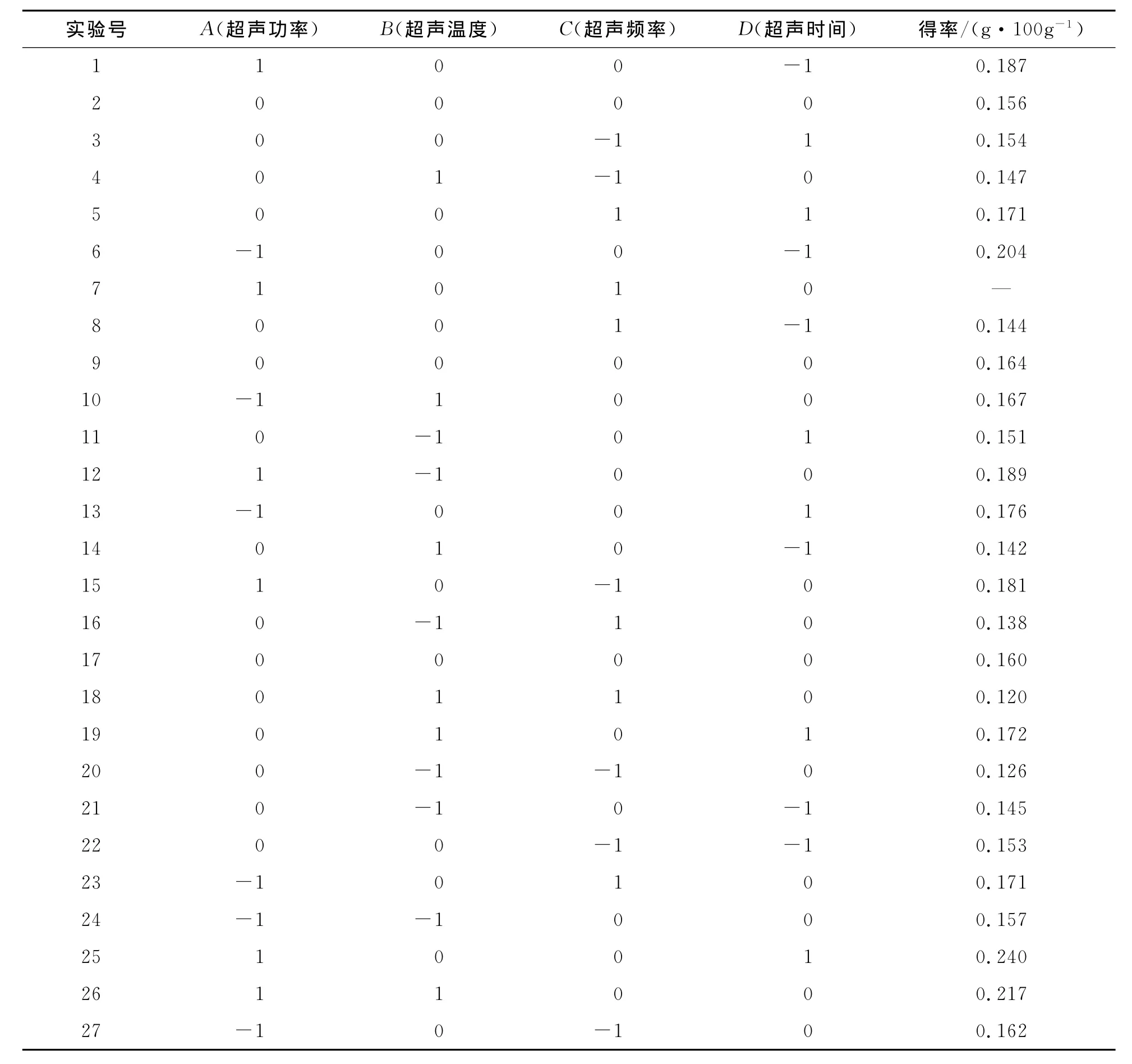
表2 响应面设计实验及结果Table 2 Response surface design and results of experiments
经Minitab软件回归拟合后,各实验因子响应值的影响可用上述四元三次回归方程表示。从表3中可以看出,用上述回归方程描述各因子与响应值的关系时,其应变量与全体自变量之间的线性、平方及交互作用关系都是显著的,R-Sq=96.23%,模型的响应值的变化有96.23%来自所选因子,即超声功率、超声温度、超声频率、超声时间4个因素可以很好地解释模型变化。
根据回归方程,可以利用Minitab软件绘出曲面图和等值线图,见图2至图7。每个响应面分别代表着两个独立变量之间的相互作用,此时其余变量保持在最佳水平。由响应面图可以看出所选因子对花色苷提取的相关性。从图中还可以看出,超声功率及其平方项,超声温度、超声频率的平方项及超声功率与超声时间的交互项对花色苷提取极显著,各单因素对花色苷提取的影响依次为超声功率>超声时间>超声温度>超声频率。
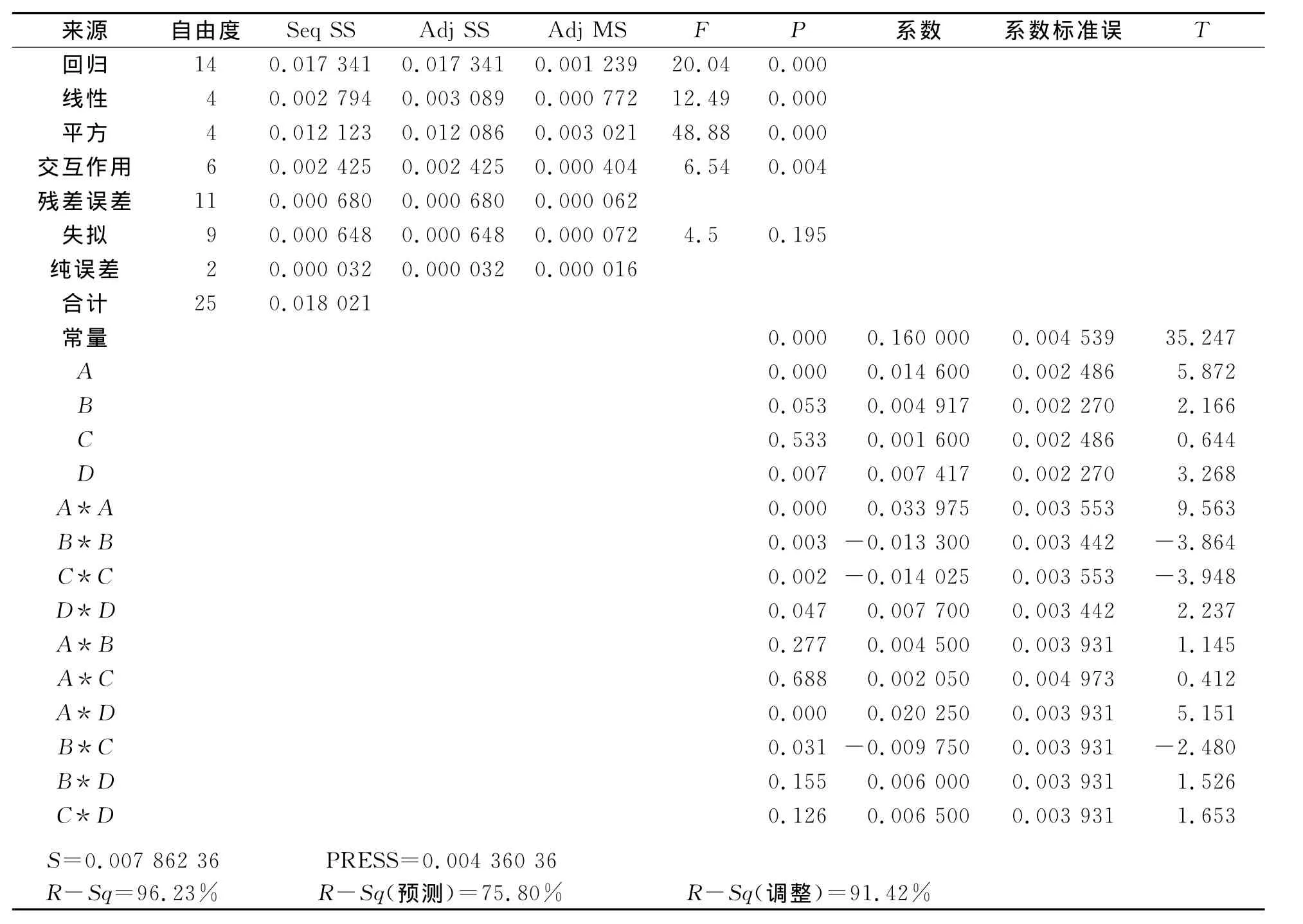
表3 回归分析Table 3 Analysis of regression

图2 Y=f(A,B)的响应曲面图及等值线图Fig.2 Response surface and contour results of Y=f(A,B)
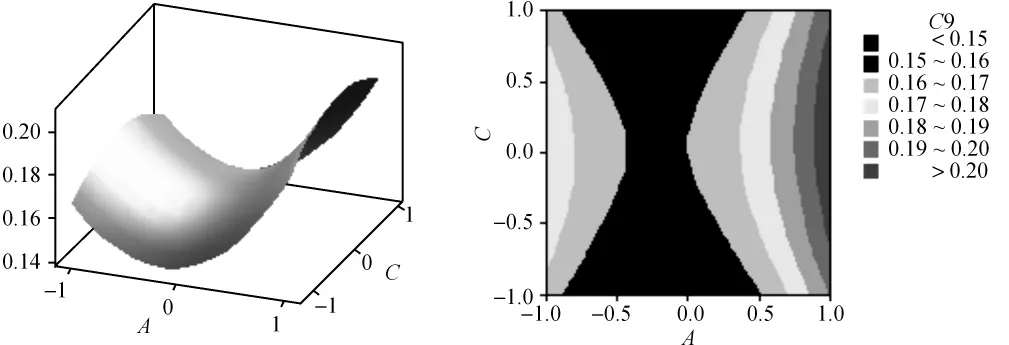
图3 Y=f(A,C)的响应曲面图及等值线图Fig.3 Response surface and contour results of Y=f(A,C)

图4 Y=f(A,D)的响应曲面图及等值线图Fig.4 Response surface and contour results of Y=f(A,D)
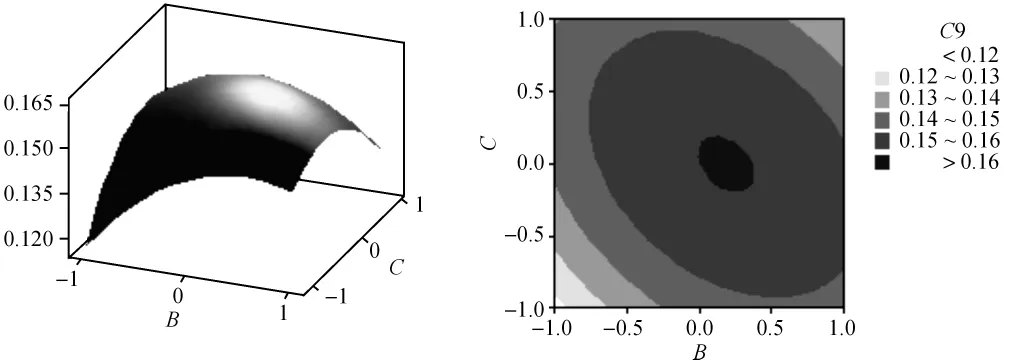
图5 Y=f(B,C)的响应曲面图及等值线图Fig.5 Response surface and contour results of Y=f(B,C)
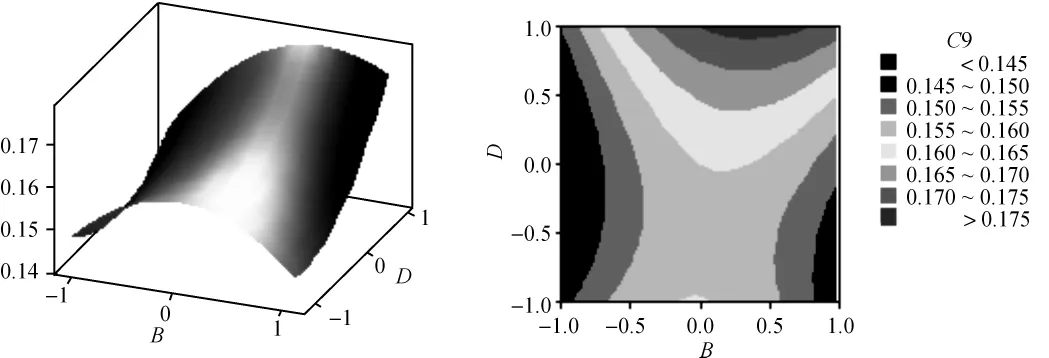
图6 Y=f(B,D)的响应曲面图及等值线图Fig.6 Response surface and contour results of Y=f(B,D)
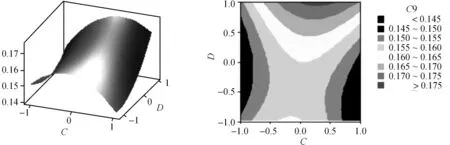
图7 Y=f(C,D)的响应曲面图及等值线图Fig.7 Response surface and contour results of Y=f(C,D)
根据Minitab的响应优化器分析可以得图8,由复合意合性可知设置能够为所有响应获得一个较好的结果,即评定总得分的最优工艺参数为超声功率286W,超声温度为45.2℃,超声频率为48.8kHz,超声时间为45min。理论花色苷的得率为0.248 8g/100g。

图8 最优水平分析Fig.8 Analysis of optimal level
实验中采用超声波功率286W,超声温度45℃,超声频率45kHz,超声时间为45min,萃取紫葡萄皮花色苷,得率为0.235g/100g。
3 结 语
利用响应面设计分析得出,紫葡萄最优提取工艺为超声功率286W,超声温度为45.2℃,超声频率为48.8kHz,超声时间为45min,花色苷得率为0.235g/100g。
[1]Bridle P,Timberlake C F.Anthocyanins as natural food colours:selected aspects[J].Food Chemistry,1997,58(1/2):103-109.
[2]Johanna B,Timberlake C F.The distribution of anthoeyanins in grape skin extracts of port wine cultivats as determined by high performance liquid chromaography[J].Journal of the Science of Food and Agriculture,1985,36(12):1315-1324.
[3]慕妮,吴海浩,顾颖娟,等.咖啡酸对紫玉米花色苷的辅色作用研究[J].食品科学,2010,31(5):58-62.
[4]朱振宝,吴园芳,易建华.紫甘蓝花色苷色素稳定性研究[J].粮食与油脂,2011,10:46-49.
[5]唐传核,彭志英.天然花色苷类色素的生理功能及应用前景[J].食品添加剂,2000(1):26-28.
[6]方忠祥,倪元颖.花青素生理功能研究进展[J].广州食品工业科技,2001,17(3):60-62.
[7]焦岩,王振宇,蓝靛果花色苷超声波辅助提取优化及其降血脂作用[J].中国食品学报,2010,10(2):54-59.
[8]吴素仪,丘泰球,范晓丹.超声波在中草药有效成分提取应用中的研究进展[J].江苏中医药,2008,40(7):93-94.
[9]盛桂华,周泉城.超声波辅助提取山豆根氧化苦参碱研究[J].农业工程学报,2008,24(3):291-294.
[10]徐怀德,闫宁环,陈伟,等.黑莓原花青素超声波辅助提取优化及抗氧化性研究[J].农业工程学报,2008,24(2):264-269.
[11]王萍,苗雨.酶法提取黑加仑果渣花色苷的研究[J].林产化学与工业,2008,28(1):113-118.
[12]Fuleki T,Ricardo da S J M.Catechin and procyanidin composition of seeds from grape cultivars grown in ontario[J].Journal of Agricultural Food Chemistry,1997,45(4):1156-1160.
[13]徐金瑞,张名位,刘兴华,等.黑大豆种子抗氧化能力及其与总酚和花色苷含量的关系[J].中国农业科学,2006,39(8):1545-1552.
