适应性无缝设计在临床试验中的应用及研究进展*
2013-07-27哈尔滨医科大学卫生统计教研室150081
哈尔滨医科大学卫生统计教研室(150081) 吴 莹 侯 艳 李 康
近年来,生命科学技术的革命性进展为许多疾病的治疗带来了新的希望,而相应的药物开发却因花费巨大面临风险,在很大程度上延缓了科学成果造福于人类的进度,美国FDA亦在2004年提出,药物开发亟须提高其效率与效益〔1〕。针对这一需求,具有Ⅱ/Ⅲ期无缝设计的适应性临床试验应运而生,这类设计可以有效缩短药品的开发时间〔2-4〕。本文针对临床试验的Ⅱ/Ⅲ期无缝设计及其研究进展进行介绍。
适应性Ⅱ/Ⅲ期无缝设计的概念
传统的药品开发过程包括Ⅰ至Ⅳ期的一系列独立临床试验,其中,Ⅱ期试验通常将几个不同处理组(如同种新药的不同剂量组)与对照组进行比较,考察研究药物疗效是否值得继续进行Ⅲ期试验,如果继续进行,需要选出进入Ⅲ期试验的处理组(如最佳剂量组),随后进行独立的确证性临床试验〔5〕。适应性的Ⅱ/Ⅲ期无缝设计是指将Ⅱ期的探索性试验与Ⅲ期的确证性试验融为一体的方法,即作为同一试验的两个不同阶段,在第1阶段完成后依据所得结果,决定是否进行第2阶段;同时可以选择最佳处理组,并对试验方案的不合理之处进行调整,从而降低研究成本,缩短研究周期〔6〕。图1为包含剂量筛选过程的传统Ⅱ、Ⅲ期临床试验与Ⅱ/Ⅲ期无缝设计临床试验的示意图,后者在第1阶段结束后需进行期中分析,目的是根据第1阶段的分析结果,判断试验是否可以继续。如果继续进行第2阶段,需要选择进入第2阶段的处理组,最常见的是最佳剂量组的选择,也可以是选择具有更好疗效的特定患者亚组等〔7〕。未被选中的处理组将中止继续纳入新的受试者,但已纳入的受试者可以继续随访至整个研究结束。此外,期中分析时还允许在一定范围内对试验进行适应性调整,如样本量,检验假设等方面,调整的内容只适用于后续的新受试者。第2阶段结束后,利用对照组与多个处理组两个阶段的所有数据进行分析,得出最终结论。
适应性Ⅱ/Ⅲ期无缝设计实际上属于适应性二阶段设计,与成组序贯设计(group sequential design,GSD)的不同之处在于以下几方面:
(1)GSD只有某一处理组在疗效上与对照组无显著差异时才被提前中止;而适应性二阶段设计中,期中分析决定是否中止某一处理组试验不仅基于疗效,也可以因为安全性问题而被排除。
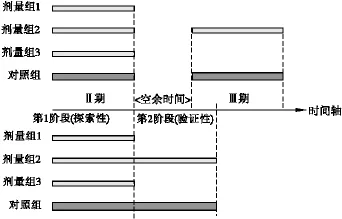
图1 包含剂量筛选过程的传统Ⅱ、Ⅲ期设计与适应性Ⅱ/Ⅲ期无缝设计示意图
(2)适应性设计在期中分析时可以使用所有关于疗效与安全性的数据,在允许范围内对下一阶段试验方案的不合理之处进行适当的调整。
(3)成组序贯设计各阶段的指标均相同,而适应性二阶段设计可以在第1阶段规定并分析能在短期内获得的中间结果指标,整个试验结束后再分析主要终点指标,避免造成两阶段间隔较大的问题。
适应性Ⅱ/Ⅲ期无缝设计的期中分析与最终分析均应采用合适的统计方法,需要考虑的统计学问题主要集中在多重比较、期中分析,以及两阶段数据的合并等方面,使试验同时满足适应性设计的原则及多重比较的封闭原则(closure principle,CP),下面对适应性设计原则及封闭原则进行简单的介绍。
适应性原则与方法
1.适应性设计原则
适应性Ⅱ/Ⅲ期无缝设计的第1阶段是探索阶段,除对照组外,一般有多个处理组,每个处理组都对应一个原假设,但这些原假设的适应性检验原则是相同的。为叙述简单,下面仅考虑其中一个处理组与一个对照组的情况,其他处理组与此同理。设H0为原假设,H1为备择假设,P1、P2分别代表第1阶段与第2阶段检验统计量对应的值,则适应性检验的实施步骤如下 :
(1)界定第1阶段,确定期中分析的中止法则,预先指定最终分析时P1与P2的合并函数C(P1,P2);
(2)实施试验至第1阶段结束,得到P1,根据P1决定是否提前中止试验;
(3)若期中分析同意继续进行试验,在开始进入第2阶段之前,可以利用第一阶段所得信息(也可以是试验外的信息)调整第2阶段的试验方案,如重新估计样本含量等;
需注意,利用第1阶段的信息对试验进行调整可能会引起I类错误概率增大,目前已有许多相关研究成果,如调整严格的拒绝域,降低第二阶段权重,以及保持条件I类错误与条件检验效能等方法,国内亦有学者对此做出了详尽介绍〔9〕;
(4)继续实施试验至第2阶段结束,得到P1,P2独立于P1;
(5)利用预先指定的合并函数,得到C=C(P1,P2),将C与其相应界值进行比较,决定是否拒绝H0,得出最终结论。
2.两阶段合并方法
适应性Ⅱ/Ⅲ期无缝设计在最终分析时,需将第1阶段与第2阶段的独立分析结果进行合并,对此目前已有多种方法〔10,11〕。其中,最常用的是 Fisher合并检验(Fisher's combination test)方法与加权逆正态方法(weighted inverse normal method)〔12-13〕。
Fisher合并检验的合并函数为C(P1,P2)=P1P2,最终分析如果

则拒绝H0,其中 χ2v,1-α表示自由度为 v 的 χ2分布的(1-α)分位点。若中止法则规定的提前中止界值为 α0与 α1,即 P1≤α1时可提前拒绝 H0,中止试验,得出有效结论。同理,若P1≥α0时亦可提前中止试验,得出无效结论。只有在α1<P1<α0情况下继续下一阶段的试验,Fisher合并检验流程如图2所示。对于给定的检验水平α,应满足

以保证将Ⅰ类错误概率控制在α水平下。
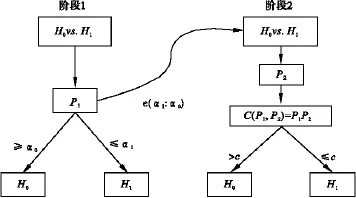
图2 适应性Ⅱ/Ⅲ期无缝设计中单个处理组检验流程示意图
加权逆正态方法的合并函数为

其中,Φ为标准正态分布函数,若C(P1,P2)<α,则拒绝H0;w1和w2为两个阶段各自的权重(0<wi<1,i=1,2),且应满足w21+w22=1。wi的确定方法有多种,如两阶段各自的样本量百分比或信息量百分比等〔11〕。
多重检验的封闭原则
实际中,适应性Ⅱ/Ⅲ期无缝设计在试验开始时通常有多个处理组,现假设有几个处理组,对应的原假设为Hi,i=1,…,n,此时需要对每一个处理组的原假设进行检验。由于涉及多重检验的问题,应保证FWER(familywise error rate),即至少拒绝了一个正确原假设的错误概率,被控制在预先确定的α水平上〔14-15〕。对此的常规做法是采用封闭原则〔16-17〕,即:
(2)为m个假设确定各自的检验方法及检验水平αl;
(3)对于任一Hi,若所有包含i∈I的Hl均在其al水平被拒绝,才能拒绝Hi,此时FWER被控制在预先确定的α水平上。
根据封闭原则,对所有新构建的假设进行检验,并用上述适应性原则对两阶段结果进行合并,得出最终结论,若某处理组在期中分析被中止,令其第2阶段的P2=1即可。封闭原则可以给试验带来较大灵活性,对于不同假设,具体的统计检验方法也可以不同。
适应性Ⅱ/Ⅲ期无缝设计需注意的问题
适应性Ⅱ/Ⅲ期无缝设计为试验带来了一定程度的灵活性,缩短了药品上市所需时间,但同时增加了研究的复杂性,需要注意以下几个问题。首先,适应性调整内容、试验的决策过程及有关人员须仔细计划并预先确定,防止过大的灵活性导致试验质量下降。第二,与受试者的纳入速度相比,期中分析占用的时间不能过长,否则可能会导致试验不得不暂停,等待期中分析结果。因此,如果主要终点指标不能较快获取,在期中分析时,应采用与主要终点指标相关的中间结果指标(如抗肿瘤新药研究中,用无进展生存率代替总生存率),尽快进行期中决策〔18〕。第三,试验的主要终点指标应定义明确且被广泛接受,如果Ⅱ期试验的目的还包括探索合适的终点指标,则不适宜采用适应性Ⅱ/Ⅲ期无缝设计。最后,如果试验中需要期中决策确定的问题较多,试验将变得十分复杂,这可能给研究带来额外成本,有时甚至大于适应性无缝设计节省的成本,因此,如果某项新药或新疗法的未知问题较多,则先进行独立的Ⅱ期试验更为合适[19]。
总结与展望
适应性Ⅱ/Ⅲ期无缝设计可以有效缩短药品开发时间,所面临的统计问题已有部分解决方案,但实施之前应特别注意妥善计划,并对其带来的收益与风险进行权衡。总结近二十年来有关适应性Ⅱ/Ⅲ期无缝设计的探讨与实际应用,可以看到这一新型临床试验设计的作用与地位在不断增强。除文中所述内容外,在期中分析时对最终检验的优效性与非劣效性的取舍,以及融合多臂多阶段设计等相关问题上亦有一些研究成果〔20-21〕。对这些问题的继续研究与完善将进一步开阔适应性无缝设计的应用前景,从而促进有效新药物或新疗法尽早地服务于人类。
1.Anonymous(2004).Innovation/Stagnation:Challenge and Opportunity on the Critical Path to New Medical Products.FDA report from March 2004.
2.Lurdes YTI,Peter FT,Donald AB.Seamlessly expanding a randomized phase II trial to phase III.Biometrics,2002,58:823-831.
3.Nigel S,Susan T.Sequential designs for phase III clinical trials incorporating treatment selection.Statistics in Medicine,2003,22:689-703.
4.Peter B,Meinhard k.Combining different phases in the development of medical treatments within a single trial.Statistics in Medicine,1999,18:1833-1848.
5.WHO及ICH相关文件中文译文.见:郑筱萸 编.《药品临床试验管理规范》培训教材.北京:中国医药科技出版社,2000,161.
6.Frank B,Heinz S,Franz K,Amy R,Willi M.Confirmatory seamless phase II/III clinical trials with hypotheses selection at interim:general concepts.Biometrical Journal,2006,48(4):623-634.
7.Heinz S,Frank B,Amy R,Willi M.Confirmatory seamless phase II/III clinical trials with hypotheses selection at interim:applications and prac-,2006,48(4):635-543.
8.Bauer PKhne K.Evaluation of experiments with adaptive interim analyses,1994,50.
9.颜虹,夏结来,于莉莉.临床试验中适应性设计研究进展.中华预防医学杂志,2008,42(z1):16-25.
10.Proschan MA,Hunsberger SA.Designed extension of studies based on conditional power.Biometrics,1995,51:1315-1324.
11.Cui L,HMJ H,Wang S.Modification of sample size in group sequential clinical trials.Biometrics,1999,55:321-324.
12.Lehmacher W,Wassmer G.Adaptive sample size calculations in group sequential trials.Biometrics,1999,55:1286-1290.
13.Bauser P,Kieser M.Combining different phases in the development of medical treatments within a single trial.Statistics in Medicine,1999,18:1833-1848.
14.Shaffer JP.Multiple hypothesis testing.Annual Review of Psychology,1995,46:561-584.
15.Benjamini Y,Hocheberg Y.Controlling the false discovery rate:a practical and powerful approach to multiple testing.Journal of the Royal Statistical Society.Series B(Methodological),1995,57(1):289-300.
16.Hommel G.Tests of individual hypotheses for experiments with interim analyses and adaptive choice of hypotheses.Paper given at the Biometric Colloquium of the German Region of the International Biometric Society,Munich,1997.
17.Hommer G.Adaptive modifications of hypotheses after an interim analysis.Biometrical Journal,2001,43:581-589.
18.Buyse M,Molenberghs G.Criteria for the validation of surrogate endpoints in randomized experiments.Biometrics,1998,54:1014-1029.
19.Bauer P,Einfalt J.Application of adaptive designs-a review.Biometrical Journal,2006,48:1-14.
20.Ohrn F,Jennison C.Optimal group-sequential designs for simultaneous testing of superiority and non-inferiority.Statistics in Medicine,2010,29:743-759.
21.Parmar M,Barthel F,Sydes M,et al.Speeding up the evaluation of new agents in cancer,2008,100:1204-1214.
