甘蔗黄叶病毒实时荧光RT-PCR检测体系研究
2013-07-26王洪星张雨良王健华刘志昕
王洪星,龚 殿,张雨良,王健华,刘志昕
(中国热带农业科学院热带生物技术研究所/农业部热带作物生物技术重点开放实验室,海南 海口571101)
甘蔗黄叶病(早期称甘蔗黄叶综合症)于20世纪80年代末首先报道在美国夏威夷发生,90年代初在巴西造成严重危害,目前几乎已扩散至世界各产蔗国。该病的症状常出现在植株生长的中后期,在干旱条件下症状表现早而明显,造成感病品种严重减产[1-3]。其病原ScYLV属于黄症病毒科(Luteroviridae)马铃薯卷叶病毒属(Polerovirus),病毒粒体球形,直径22~24 nm,在寄主体内含量很低,仅分布于韧皮部筛管伴胞细胞质中。Lockhart[4]首先利用电子显微镜在感病植株叶片韧皮部伴胞细胞质中观察到多面体ScYLV粒体;随后利用抗血清技术检测该病毒;Schenck[5]利用组织印迹杂交免疫法(TBIA)检测ScYLV;Comstock[6]采用双抗体夹心酶联免疫吸附测定方法(DAS-ELISA)进行病原检测。王伯辉等[7]在广西观察到甘蔗黄叶病并对其病原进行了初步的检测,许东林等[8]报道了发生在广东蔗区的ScYLV分子鉴定结果。与目前使用的生物学鉴定、血清学检测和逆转录-聚合酶链式反应RT-PCR等ScYLV检测技术相比,实时荧光PCR技术不但灵敏度高于传统PCR,而且能对病原体的数量进行精确定量。SYBR Green I染料法具有灵敏度高、信噪比高、适用范围广和低价等特点。在核酸的实时检测方面有很多优点,由于它与所有的双链DNA相结合,不必因为模板不同而特别定制,因此设计的程序通用性好,且价格相对较低,可提高ScYLV的检测效果。我们进行了ScYLV的实时荧光RT-PCR检测技术研究,以期建立一种快速、准确、灵敏和简便的检测ScYLV的方法。
1 材料与方法
1.1 材料
供试材料为经检测感染了甘蔗黄叶病毒和高粱花叶病毒的植株,甘蔗感病材料采自海南省红毛镇甘蔗种植基地。
主要试剂和仪器:Mx3005型荧光定量 PCR仪、TaKaRa公司SYBR Premix Ex Taq试剂盒、RT-PCR试剂盒PrimeScript TM One-Step Ver.2.0购自宝生物工程(大连)有限公司,Taq酶及其它生物试剂均购自北京全式金生物科技有限公司,其它药品为国产分析纯。
1.2 方法
1.2.1 总核酸的提取 从待检测甘蔗植株上取幼嫩组织,以TRIzol法[9]提取RNA样品。
1.2.2 引物设计与合成 选取在GenBank上 (登录号AF369923.1、AF369924.1、AF369925.1、AF369926.1、AF369927.1、AF369928.1、AF369929.1、AF141385.1、AF141385.1)登录的 9 个 ScYLV 分离物高度保守的衣壳蛋白基因序列中,运用Primer Premier 5.0、Oligo6.0和DNAMAN进行基因同源性分析和引物设计。引物由上海生工生物技术有限公司合成[10]。
1.2.3 RT-PCR 以所提取病样的总RNA为模板,以oligodT为反转录引物,进行RT-PCR反应。PCR反应体系为25μL,反应成分包括ScYLV CDNA2μL、10 pm/μL 上游引物 s-pf 1μL、10pm/μL 下游引物 s-pr1μL,10mM dNTP2 μL、Taq 酶 0.2μL、无菌水18.8μL。 PCR扩增程序为:94℃预变性 3 min,95℃变性30 s,53℃退火1 min,72℃延伸1 min,循环35次;最后72℃延伸10 min。取10μL PCR产物与lμL染料相混合,在室温下进行1.2%琼脂糖恒压凝胶电泳。PCR产物利用纯化试剂盒进行切胶纯化。

表1 用于实时定量PCR扩增的引物特征
1.2.4 重组质粒的构建、筛选、鉴定与稀释 按照PMD19-T-Vector试剂盒的操作说明将PCR产物与PMD19-T载体进行连接,重组质粒转化大肠杆菌Trans-CD201感受态细胞。从已转化的大肠杆菌细胞中提取重组质粒,操作按照Axygen公司的质粒小量抽提试剂盒进行,用菌液PCR法对重组质粒进行鉴定;将鉴定为阳性克隆的质粒进行测序分析。同时用紫外分光光度计测定其浓度为1.16 μg/μL,按照公式CN=M×N/L×D计算其拷贝数。CN为质粒拷贝数,M为检测到的核酸最小浓度,N为Avgadro's number(6.022×l023molecules/mol);L为核酸长度(质粒总长+插入目的片段长度,单位为kb),D为从1kb核酸转化到道尔顿转化因子(dsDNA=6.6×l05)。经计算,得质粒的拷贝数为6.0×109拷贝/μL。加入灭菌水以10倍为梯度将重组质粒依次稀释,放入-20℃冰箱备用。
1.2.5 引物浓度的优化和退火温度的优化 以200nM、400nM、600nM、800nM四个引物浓度梯度进行筛选;然后以优化的引物浓度,以6×109拷贝/μL到6×102拷贝/μL的重组质粒为模板,选取56℃到62℃的10个不同退火温度进行实时定量PCR反应,每个梯度设置两个重复,观察不同梯度引物浓度、不同退火温度对荧光信号的影响。同时在最优的反应体系和条件下反应,获得标准曲线。
1.2.6 特异性测试与重复性测试 选取感染高粱花叶病毒植株样品和健康植株样品的总核酸与ScYLV总核酸,在相同体系和条件下进行扩增,观察荧光信号的变化;同时通过批内和批间重复性测试,验证检测体系的稳定性。批内重复性测试是通过对不同浓度的标准品重复测定3次,批间重复性测试是连续3d对同一标准品进行检测,通过测得的标准差进而计算CV值。
1.2.7 线性范围测试 以100倍梯度稀释的6×108拷贝/μL到6×101拷贝/μL的重组质粒为模板,在上述优化的体系进行实时定量PCR反应,通过观察荧光信号的变化和r2值的大小,确定该体系的线性范围。
1.2.8 灵敏性测试的对比试验 分别对己知浓度的ScYLV标准品10倍梯度稀释,以此为模板分别进行实时定量PCR反应和普通PCR反应,验证所建立的检测方法的灵敏性。
1.2.9 田间样品检测 利用已建立的方法对来自田间的13份疑似样品进行实时定量PCR检测。
2 结果与分析
2.1 目的片段扩增
利用RT-PCR法扩增获得的ScYLV CP基因的插入用目的片段,特异性PCR产物片段长度与预计目的片段大小基本一致(图1)。

图1 RT-PCR法扩增ScYLVCP基因的插入用目的片段
2.2 ScYLV目的基因重组质粒PCR鉴定结果
鉴定结果如图2:获得目的片段与预期大小相符,经测序、blast分析,所插入目的片段正确,大小为189bp,说明重组质粒构建成功。

图2 PCR检测重组质粒
2.3 最佳引物浓度筛选结果
通过观察荧光信号的变化可看出各个不同的引物浓度对扩增曲线的影响不是很大,但是当引物浓度为600nM时,荧光扩增曲线最平滑,荧光值最高,呈典型“S”型形状,平行管测定其重复性较好,且其Ct值也比其他组要小,说明其扩增效率及检测灵敏度比其它组高,确定引物浓度为600nM时,反应较稳定,曲线平滑,只有单一的峰,无非特异性扩增,为该体系的最佳引物浓度(见图3)。

图3 引物浓度为600nM时的融解曲线图
2.4 退火温度的优化结果
通过观察不同退火温度下扩增曲线,看出该反应在62℃到52℃之间的温度变化不敏感,荧光信号均有增加,但是在58℃时PCR扩增效率最好,因此确定58℃为该体系的最佳退火温度(图4,图5)。
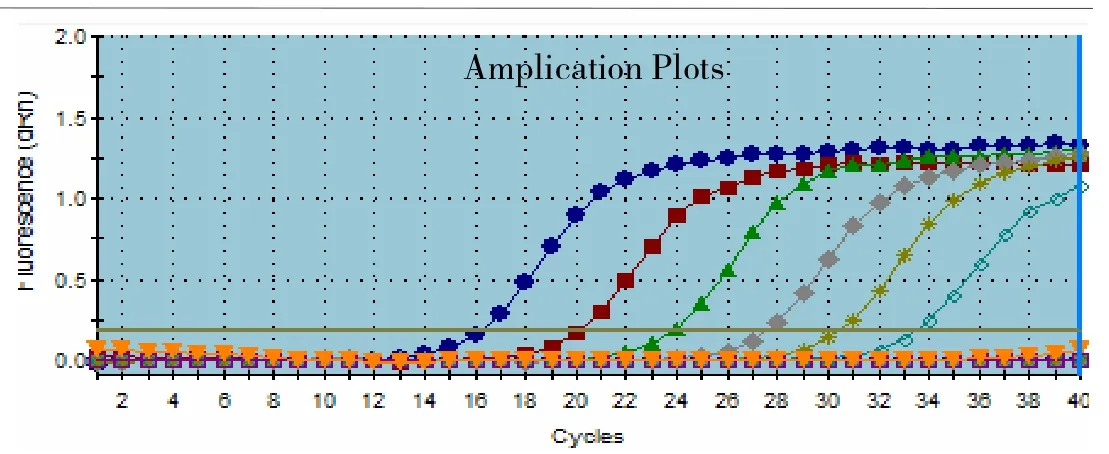
图4 58℃退火温度下的扩增曲线图

图5 58℃退火温度下的标准曲线图
2.5 特异性测试结果
图6显示:该体系只针对ScYLV样品进行了扩增,对测试的SrMV和健康甘蔗样品都没有荧光曲线的扩增,表明引物特异性好。
2.6 线性范围测试结果
通过对一系列100倍梯度稀释的ScYLV标准品重组质粒进行实时定量PCR反应,并观察荧光信号的变化,可以看出当标准品的浓度为 6×108拷贝/μL 到 6×101拷贝/μL 时,标准曲线有良好的相关性,可以检测的线性范围为6×l01~6×108拷贝(图7)。

图6 体系特异性检测结果

图7 标准曲线线性苑围

图8 实时定量PCR检测不同浓度的ScYLV重组质粒1~8:6×108,6×107,6×106,6×105,6×104,6×103,6×102,6×101拷贝/µL 9:负对照
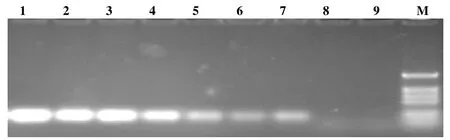
图9 普通PCR检测不同浓度的ScYLV重组质粒泳道 l~8:6×108,6×107,6×106,6×105,6×104,6×103,6×102,6×101拷贝/µL 9:负对照
2.7 灵敏性测试的对比试验
结果表明,实时定量PCR能够检测到6×100拷贝/μL重组质粒,而常规PCR只能检测到6×102拷贝/μL重组质粒,实时定量PCR检测的灵敏度比常规PCR提高了100倍(图8、9)。

图11 田间样品检测扩增曲线
2.8 重复性测试结果
对浓度高低不同的标准品重复测定3次和连续3d对同一标准品进行检测,通过计算获得该体系的批内CV值为1.6%,批间CV值为3.2%,小于5%,说明重复性较好(图10)。

表2 田间ScYLV分离株的实时荧光RT-qPCR检测结果
2.9 田间样品测试
适用性检测结果:由表2、图11可以看出,对来自田间受ScYLV不同致病力(强、弱和中等)感染的株系,该体系均可以进行稳定扩增和定量检测,因而可以作为一种适宜的定量和定性检测手段来研究甘蔗黄叶病毒。
3 结论与讨论
本研究建立了利用SYBR Green I染料法检测ScYLV的实时荧光RT-PCR体系。该体系相关性好 (r2=0.993),特异性强,线性范围宽、灵敏度高、重复性好且具有操作简便、快速等优点。检测结果真实可靠,可以定量检测田间受ScYLV不同致病力(强、弱和中等)感染的株系,其Ct值的高低直接反应了各株系中ScYLV含量的高低。同时灵敏度比常规RT-PCR高出100倍,这不仅减少了假阳性和假阴性问题的出现,更适于对那些亚感病或无症状感染植株的诊断。大大提高了该病毒的检出率,克服了常规PCR因灵敏度不够而导致样品检测出现假阴性的不足。
因此,本研究建立的实时荧光RT-PCR体系非常适合于检测ScYLV这样在寄主中含量较低的病毒,并且具有成本相对低廉、检测速度快、无需PCR后处理等诸多优点。J.Korimbocus等[11]应用Taqman-MGB探针法检测ScYLV,本文所建立方法与此相比,具有检测成本低,检测方便等特点,检测时只需要在反应体系中加入模板,检测的特异性只取决于引物的特异性,适宜大规模快速检测。该方法的建立为ScYLV的检测、防治以及无病毒苗木的生产提供了强有力的技术支持,也可以应用于ScYLV的YLS效果评价和深入研究中。
[1]Schenk S.Sugarcane yellow leaf syndrome:history and current concepts[A].In:Rao G P,Ford R E,Tosic M,et al,Sugarcane Pathology[C].Vol.Ⅱ.Enfield,USA,Science Publisher Inc,2001:23-25.
[2]Rassaby L,Girard J C,Lemaire D,Costet L,Irey M S,Kodja H,Lockhart B E L,Rott P.Spread of sugarcane yellow leaf virus in sugarcane plants and fields on the island of Reunion[J].Plant Pathology,2004,53(1):117-125.
[3]Izaguirre-Mayoral M L,Carballo D,Alceste C,Romano M,Nass H A.Physiological performance of asymptomatic and yeiiow leaf syndrome-affected sugarcane in Venezuela[J].Journal of Phytopathology,2002,150:13-19.
[4]Lockkhart B E L,Irey M J,Comstock J C.Sugarcane baccitliform virus,sugarcane mild mosaic virus and sugarcane yellow leaf syndrome[A].In:Sugarcane Germp-lasm Conservation and Exchage B J,Croft C M,PigginE S,Wallis and D M Hogarth(eds),ACIAR Procee-dings[C].1996,67:113-115.
[5]Schenck S,J S Hu.Uses of tissue blot immunoassay to determine the distribution of sugarcane yellow leaf virus in Hawaii[J].Sugarcane,1997,4:5-8.
[6]Comstock J C,Irey M S,Lockhart B E L,et a1.Incidence of yellow leaf syndrome in CP cultivars based on polymerase chain reaction and serological techniques[J].Sugarcane,1998,4:21-24.
[7]王伯辉,朱秋珍,莫磊兴,等.甘蔗黄叶综合症的RT-PCR检测初报[J].甘蔗,2003,10(4):13-14.
[8]许东林,周国辉,任小平,等.广东甘蔗引种基地甘蔗黄叶病毒分子鉴定[J].植物病理学报,2005,35(5):466-468.
[9]王洪星,张雨良,罗志文,等.应用多重RT-PCR检测甘蔗黄叶病毒和高粱花叶病毒[J].广东农业科学,2011,38(10):128-131.
[10]王洪星,张雨良,罗志文,等.ScYLV和SrMV的PCR引物优化设计[J].中国糖料,2012(1):16-20.
[11]J.Korimbocus,D.Coates,I.Barker,and N.Boonham.Improved detection of Sugarcane yellow leaf virus using a real-time fluorescent(TaqMan)RT-PCR assay[J].Journal of Virological Methods,2002,103:109-120.
