湖北地区暴发病池塘中嗜水气单胞菌的遗传多样性和毒力特征研究
2013-07-24张旭杰杨五名李彤彤李爱华
张旭杰 杨五名 李彤彤 李爱华
(1.中国科学院水生生物研究所, 淡水生态与生物技术国家重点实验室, 武汉 430072;2.中国科学院大学, 北京 100049)
嗜水气单胞菌(Aeromonas hydrophila)隶属于气单胞菌科(Aeromonadaceae)气单胞菌属(Aeromonas),广泛分布于自然界的各种水体, 是多种水产养殖动物多种不同疾病的致病菌, 包括肠炎、烂尾病、腹水病、竖鳞病、疥疮病等[1]。特别是, 自20世纪80年代末至今, 常引起我国养殖鱼类暴发性的出血性败血症, 俗称暴发病, 又称运动型气单胞菌败血症(MotileAeromonasSepticemia, MAS), 导致严重的经济损失[2—4]。
大量的研究表明嗜水气单胞菌具有高度的表型、血清型和遗传多样性[5—7]。有研究者通过DNA指纹图谱等技术手段, 对人类腹泻和环境分离株进行了分型分析, 结果表明此菌具有高度种内多样性,未曾发现优势克隆[8,9]。嗜水气单胞菌作为鱼类和贝类疾病的病原, 虽被广泛分离鉴定, 但对引起鱼类MAS的嗜水气单胞菌的种群结构和遗传多样性缺乏系统研究, 因此对此病原菌在养殖区域中的流行规律仍不清楚, 增加了防御的难度, 只能依赖抗菌药物进行防治。
嗜水气单胞菌作为运动型气单胞菌败血症(MAS)最常见的病原, 其在致病过程中, 多种毒力因子发挥了重要作用, 包括气溶素、溶血素、肠毒素、蛋白酶、脂酶、S-层和鞭毛等[10—15]。嗜水气单胞菌有致病性和非致病性菌株之分, 毒力基因常被用作标记基因, 用来区分嗜水气单胞菌的有毒株和无毒株[16]。朱大玲等.检测了 9株鱼源嗜水气单胞菌的毒力与毒力基因谱(Virulence gene profile)的相关性[17]。Li,et al.检测了毒力基因alt,ahp和aerA在不同来源嗜水气单胞菌中的分布以及不同基因型与毒力的相关性[18]。遗憾的是, 这些研究所用的嗜水气单胞菌菌株地域来源分散, 分离年代相差甚远,且不完全来自 MAS病鱼, 有些可能分离自肠炎等其他类型的疾病, 所以对引起鱼类 MAS的致病性嗜水气单胞菌的毒力特性依然不清楚。
本研究在湖北省内三个不同地区, 从发生MAS池塘的病鱼血液、肝脏、肾脏或腹水中以及同一池塘的池水和底泥中, 分离嗜水气单胞菌, 然后对这些嗜水气单胞菌克隆进行系统研究, 包括构建基于gyrB基因序列的系统发育树, 分析肠道细菌基因间重复序列 (Enterobacterial repetitive intergenic consensus, ERIC)图谱, 测定其毒力基因谱以及对斑马鱼的致病性, 来了解这些来源于 MAS病鱼和池塘的菌株的遗传多样性, 以阐明运动型气单胞菌败血症(MAS)的流行病学规律, 揭示其发病机理。此外,通过阐明这些菌株的遗传特征, 为建立相应的快速检测技术, 制备地区特异性疫苗提供理论基础。
1 材料与方法
1.1 实验材料
病鱼和水样采集自位于湖北省的武汉、汉川和荆门三个地区的6个暴发病鱼塘, 采样时间为2006年8月至2009年7月(表2)。其中4个鱼塘为单养鱼塘: 塘1主养团头鲂, 塘2主养鲢, 塘5和塘6主养鲫; 塘3和塘4为混养鱼塘, 养殖品种包括鲫、草鱼、鲢、团头鲂和鳙。发病鱼的主要症状为: 鳃盖、尾鳍基部出血, 肝脏、肠壁和肛门充血, 腹腔内有积水。
AB近交系斑马鱼取自中国科学院水生生物研究所, 体长为(3.7±0.4) cm, 体重为(0.76±0.1) g, 暂养于本实验室。
TSA和TSB培养基购自美国BD公司, DL2000 marker、dNTP、pMD18-T载体和 ExTaq均购自TaKaRa公司, DL5000 marker购自上海莱枫生物科技有限公司。
1.2 实验方法
菌株分离 病鱼的血液、肝脏、肾脏或腹水无菌接种于TSA平板; 塘2的水样和塘3病鱼的肠道内容物通过灭菌管带回实验室, 于 4h内处理完毕。病鱼编号及样品信息(表2)。
水样直接用 PBS (pH 7.0)梯度稀释, 肠道内容物匀浆后用PBS梯度稀释, 均涂布于气单胞菌选择培养基平板[19], 于28℃培养24h后,每平板随机挑取2—3个菌落接种至 TSB 液体培养基中,振摇, 28℃培养10h后将培养物浓缩, 并用15%甘油+新鲜TSB保存于−80℃, 待进一步鉴定。
基因组的提取 细菌基因组的提取采用细菌基因组提取试剂盒(天根, 中国)。
常规生理生化鉴定 以嗜水气单胞菌XS91-4-1[20]作为参照菌株。保种菌及参照菌株进行氧化酶、触酶、O/F(葡萄糖氧化发酵)、运动性及弧菌抑制剂(O/129)敏感性试验[21]。
分子生物学鉴定、系统发育树构建 用引物16SF (5′-AGAGTTTGATCATGGCTCAG-3′)和 16SR(5′-GGTTACCTTGTTACGACTT-3′)扩 增 保 种 菌 的16S rRNA基因。回收目的片段, 用内切酶AluI 和MboI 双酶切, 取酶切产物跑 PAGE电泳。通过比较标准菌株酶切图谱, 初步判定菌株种类[22]。
以 gyrB3F (5′-TCCGGCGGTCTGCACGGCGT-3′) gyrB14R(5′-TTGTCCGGGTTGTACTCGTC-3′)[23]为引物扩增初步鉴定菌株的gyrB基因。反应体系为:10×ExTaqBuffer, 5 μL; dNTP Mixture (各 2.5 mmol/L), 3 μL; 引物(10 μmol/mL)1 μL; 模板 DNA, 1 μL;Takara ExTaq(5 U/μL), 0.25 μL; 补灭菌蒸馏水至50 μL。扩增条件为: 94℃ 5min, 接着 30个循环:94℃ 30s, 59℃ 30s, 72℃ 90s, 最后72℃延伸10min。将PCR产物连接到pMD18-T载体(Takara)上进行克隆测序。
用 ClustalX (1.81)软件进行序列比对, 再用Mega4.1软件构建NJ系统发育树, 并进行1000次Bootstraps 重复检验。
ERIC-PCR 根据Aguilera-Arreola等的程序和反应体系[24], 用引物 ERIC1R (5′-ATGTAAGCTC CTGGGGATTCAC-3′) 和 ERIC2 (5′-AAGTAAGTG ACTGGGGTGAGCG-3′)扩增基因组 DNA, 取 PCR产物电泳拍照, 并分析图谱类型[25]。
毒力基因检测 我们共检测了7个毒力基因在病原菌中的分布, 包括气溶素、溶血素、热不稳定性细胞兴奋性肠毒素、热稳定性细胞兴奋性肠毒素、弹性蛋白酶、脂酶和鞭毛基因。引物及参考文献信息(表 1)[16,26,27]。
PCR反应采用前述扩增gyrB基因体系。PCR扩增程序为: 94℃预变性 5min; 94℃ 30s, 59℃(aerA) 或 62℃ (hlyA) 或 59℃ (alt) 或 55℃ (ast)或 57℃ (ahpB) 或57℃ (lip) 或 55℃ (fla) 30s, 72℃1min, 32个循环; 72℃ 延伸10min。

表1 毒力基因扩增引物信息Tab.1 Details of the primers used for amplification of virulence genes
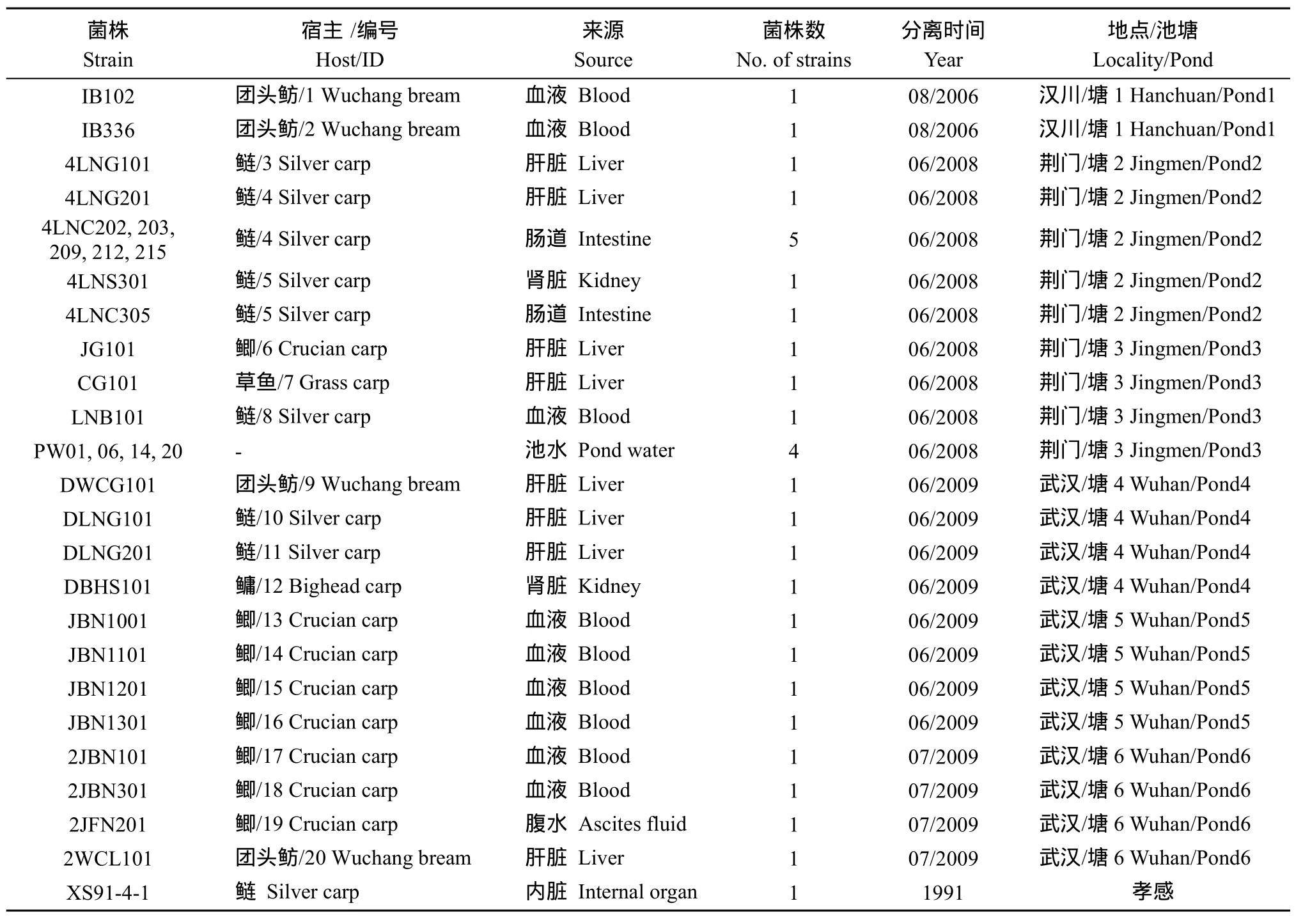
表2 从败血症暴发池塘分离的嗜水气单胞菌Tab.2 A.hydrophila strains isolated from fishponds with outbreaks of septiceamia
为了验证PCR产物是否为特异性扩增, 每基因随机挑取2—4个克隆测序, 并将序列上传到Genbank数据库。
毒力的测定 根据 ERIC图谱和毒力基因分布模式的不同, 选取分离自6个塘的15株代表菌株,在斑马鱼中进行攻毒试验。无菌接种攻毒菌株于TSA平板, 28℃培养18h, 挑单菌落接种于TSB培养液, 28℃震荡培养(150 r/min),于 4℃(1500 g, 5min)离心收集处于对数生长期的菌体, PBS洗涤一次, 重新悬浮菌体于 PBS, 用分光光度计调整菌液浓度为106—108CFU/mL[28]。对每株攻毒试验病原菌, 40尾斑马鱼被随机分为四组, 每组10尾, 实验组腹腔注射 50 μL 浓度为 106、107、108CFU/mL 的菌液, 对照组注射50 μL PBS, 观察两个星期并记录死亡率。半致死浓度(LD50)由软件SPSS 13.0通过几率单位加权回归法(Bliss)计算。
2 结果
2.1 菌株鉴定结果
共分离到30株嗜水气单胞菌, 包括20株临床株(分离自血液、肝脏、肾脏或腹水), 6株肠道株和4株池水株(表 2)。所有菌株均为氧化酶、触酶阳性,葡萄糖氧化型, 具有运动性, 对弧菌抑制剂不敏感。
用gyrB序列构建的系统发育树(图 1)。所有的分离株在系统发育树上都与A.hydrophilasubsp.hydrophilaATCC 7966T聚在一起, 形成一大枝。20株临床株均为嗜水气单胞菌, 且极有可能为嗜水亚种, 其gyrB序列相似性为100%。6个鱼塘皆为单一种病原菌引起的发病。
与临床株相比, 5株肠道株(4LNC203、4LNC209、4LNC212、4LNC215 和 4LNC305)和 1株池水株(PW01)的gyrB序列相似性较低。
2.2 ERIC指纹图谱分析
所有的菌株均独立扩增了两次, 获得了可重复的谱带。标准菌株ATCC7965为参照菌株。图 2为代表菌株的ERIC电泳图谱。
分离自 6个塘的 20株临床株, 1株肠道株(4LNC202) 和 3株池水株(PW06, PW14和 PW20)具有相同的ERIC图谱, 均由6条带组成。
2.1中6株与临床株gyrB序列相似性较低的肠道和池水株, 具有与临床株不同的ERIC图谱。6株菌共有 5种不同的图谱类型, 体现出高度的遗传多样性。
来自塘2的临床株, 其ERIC带型虽与其他塘的临床株相同, 但是最小条带(−600 bp)的拷贝数明显高于其他塘临床株, 因此与其他塘菌株应属于不同的克隆。
2.3 毒力基因分布模式
30株嗜水气单胞菌的基因组DNA经PCR扩增之后, 7种毒力基因扩增片段都与预期的片段大小相吻合。为了确认所有产物均为特异性扩增, 对于每个基因, 我们随机测序了 2—4株菌的扩增产物,序列均上传到了 Genbank数据库, 菌株编号及Genbank 登录号(表 1)。经Blast序列比对, 所有毒力基因均为特异性扩增。
30株菌的毒力基因分布模式(表 3)。共有3种不同的毒力基因型。所有的临床株都含有所检测的7种毒力基因, 其毒力基因型为:aerA+hlyA+alt+ast+ahpB+lip+fla+。6株肠道株分属于 3种毒力基因型,显示出最高的多样性。4株池水株与临床株毒力基因型相同。
2.4 毒力测定
攻毒试验菌株的信息及半致死浓度(表 4)。15株攻毒菌株分别分离自鲢的肝脏、草鱼的肝脏、团头鲂的血液和肝脏、鲫的血液和腹水、池水及鲢的肠道。来自 6个塘的临床株都为强毒株, 攻毒斑马鱼绝大部分死亡发生在16h以内, 24h后几乎不再死亡, 表现出急性毒性, 其半致死浓度(LD50)均小于105CFU/尾。分离自池水和肠道的菌株, 其中与临床株具有相同 ERIC图谱, 且毒力基因型相同的菌株,亦属于强毒株, 其余菌株均属于弱毒株(LD50>106cfu/尾) (表 3)。部分菌株, 其3个浓度组的攻毒斑马鱼均死亡,LD50定义为小于可计算的最低浓度(<9×103)。
池水株 PW01含有7种毒力基因, 其毒力基因型与临床株相同, 但具有不同的ERIC图谱, 属于弱毒株。
3 讨论
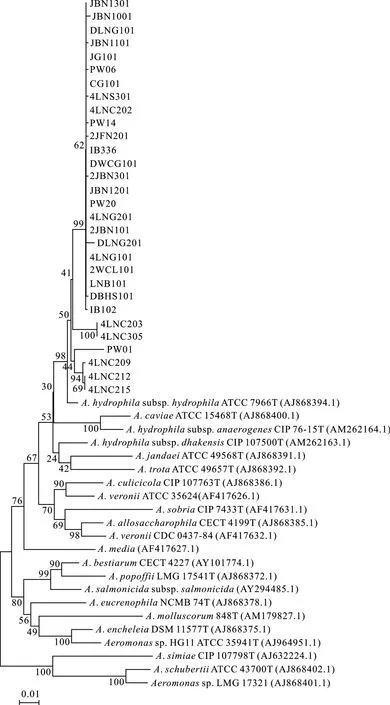
图1 基于气单胞菌属的gyrB序列构建的系统发育树Fig.1 Phylogenetic tree based on gyrB sequences of bacteria from genera of Aeromonas
嗜水气单胞菌是我国养殖鱼类最重要的病原菌之一, 常引起池塘养殖鱼类出血性败血症、肠炎, 竖鳞病, 烂尾烂鳍等多种疾病的流行, 不同的疾病有不同的症状表现。其发病机理、病原菌的流行规律及毒力特征至今仍不明确。 虽然嗜水气单胞菌从20世纪80年代末期流行至今已有20余年, 笔者未检索到对发病池塘中此病原菌遗传多样性和毒力特征的系统调查。
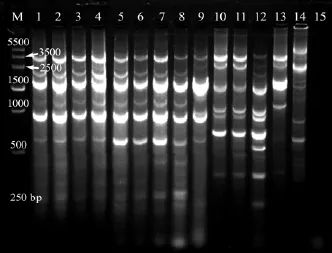
图2 嗜水气单胞菌代表菌株的ERIC图谱Fig.2 ERIC profiles of representative Aeromonas hydrophila strains
2006—2010年, 我们从湖北省3个地区6个由嗜水气单胞菌引发的暴发病发病鱼塘中共分离了30株菌, 通过 ERIC-PCR和毒力基因检测, 比较分析了鱼类 MAS暴发池塘中此菌的遗传多样性和毒力特征。
嗜水气单胞菌作为自然界的正常菌群, 具有高度的遗传多样性。ERIC是一类广泛存在于细菌基因组上的基因外非编码倒转重复序列, 被大量用于分析嗜水气单胞菌的遗传多样性和种群结构[24,29], 具有良好的区分度。通过ERIC-PCR, 我们发现所有6个塘的临床株都具有相同的带型, 虽然塘 2的临床株其最小条带(−600 bp)的拷贝数明显高于其他塘临床株, 不属于同一克隆, 但具有很近的亲缘关系,属于同一克隆系。肖丹等采用ERIC-PCR 方法对49株分别采集于中国浙江、江苏、江西、广东、湖北、上海等主要淡水养殖区的致病性嗜水气单胞菌进行了基因分型[30], 发现49株菌共分为12个基因型。除菌株GD08、GD04 以外的广东分离株的基因型均为Ⅷ型, 除菌株 JX04以外的江西分离株均属Ⅵ型,而上海、浙江等地分离株的基因型均呈现多态性;而且不同基因型菌株的分布特点也有差异。例如,Ⅶ型菌株在广东、江苏、上海、浙江均有出现, 而Ⅳ型、Ⅴ型、Ⅹ型菌株仅在上海出现。不同基因型菌株的分布呈现了一定的区域性。其中有5株分离自湖北洪湖和丹江口的病鱼, 除分离自洪湖的菌株HB01为基因型Ⅱ型外, 其余4株均为同一亚型。由于文中未涉及发病鱼的种类、症状和这5株菌的图谱, 因此无法与本文中的分离株进行直接比较。

表3 嗜水气单胞菌的毒力基因分布模式Tab.3 Distribution patterns of virulence-gene in Aeromonas hydrophila
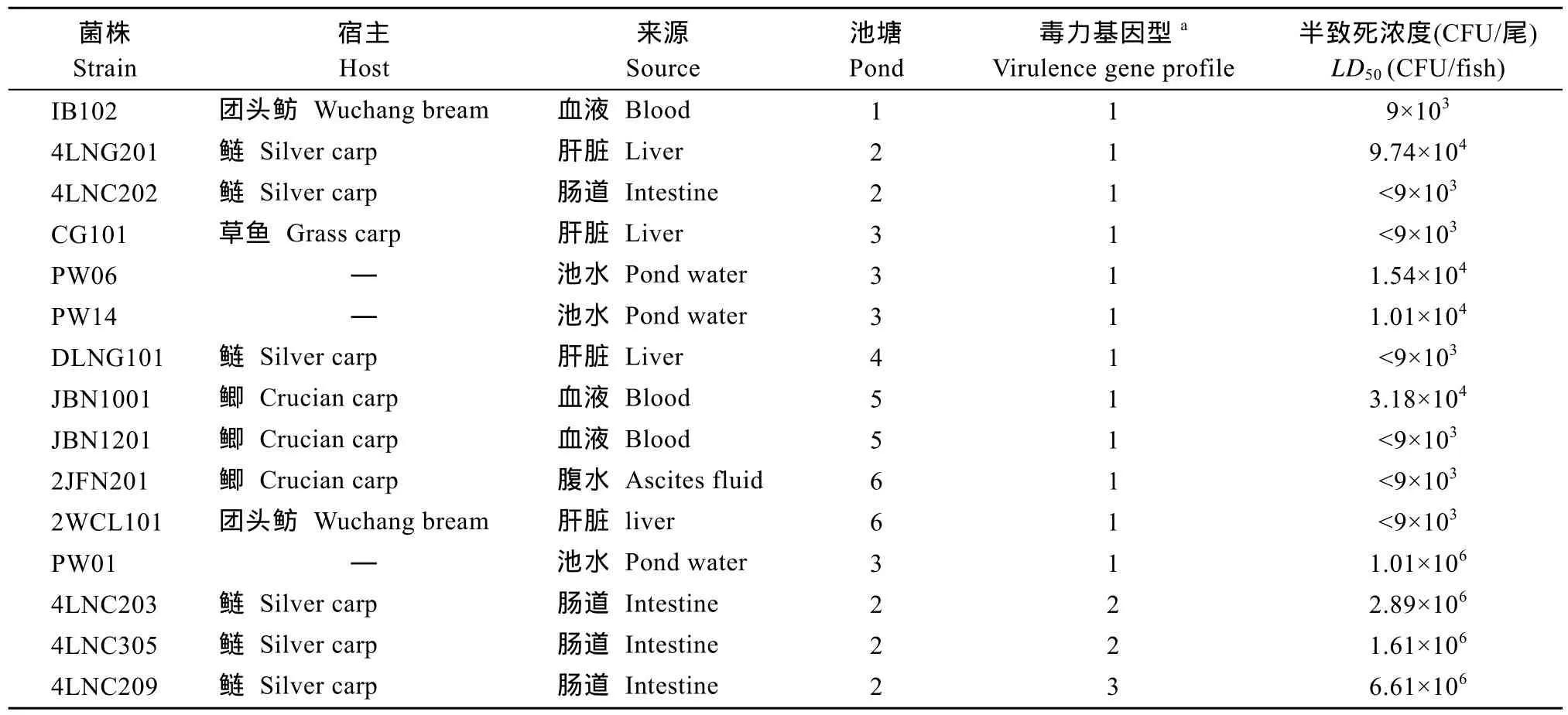
表4 代表菌株在斑马鱼中的攻毒结果Tab.4 Results of pathogenicity assays to zebrafish with representative strains
嗜水气单胞菌有致病性菌株和非致病性菌株之分。随着致病性嗜水气单胞菌潜在毒力因子的不断阐明, 越来越多的学者使用毒力基因作为标记基因,研究嗜水气单胞菌的潜在毒力及致病性[15—17]。通过遗传操作, 该菌的气溶素(aerA)、溶血素(hlyA)、热不稳定性细胞兴奋性肠毒素(alt)、热稳定性细胞兴奋性肠毒素(ast)、弹性蛋白酶(ahpB)、脂酶(lip)和鞭毛基因(fla)已经被证明在侵染过程中发挥重要作用[10—12,14,26]。本实验检测了这7个毒力基因在MAS暴发池塘中的流行情况, 发现这些基因在临床株中的流行率皆为100%, 为多毒力基因的联合流行。如此显著的结果让我们加深了对嗜水气单胞菌暴发株的认识, 并且为池塘 MAS致病机理的解析提供了理论依据。83.3%的肠道株虽然有部分毒力基因缺失,对斑马鱼只有弱毒性, 但仍然具有多种毒力基因,这是否说明在暴发病发病池塘中, 存在致病性菌株与非致病性菌株之间的毒力基因交流?这个问题值得进一步研究。
斑马鱼作为模式动物, 已经被证明是良好的嗜水气单胞菌感染对象[18]。我们随机选取了分离自不同时间、不同池塘、不同发病鱼类、不同组织和不同来源的嗜水气单胞菌, 用斑马鱼进行攻毒试验,测定了其毒力水平。依据Li,et al.的毒力划分标准[18],所有的临床株皆为强毒株, 其LD50<105CFU/尾。在池水和肠道株中, 与临床株 ERIC图谱和毒力基因型相同的菌株, 亦属于强毒株。其他肠道和池水株皆属于弱毒株, 其LD50>106CFU/尾。
值得一提的是, 池水株 PW01虽与临床株毒力基因分布模式相同, 但其gyrB序列与临床株相似度较低, 且具有不同的ERIC图谱类型, 属于弱毒株。一方面这可能是由于它缺失我们未检测的毒力基因或者未阐明的毒力基因, 另一方面也表明嗜水气单胞菌的致病性是多因子共同作用的结果, 单纯检测毒力基因, 无法将所有的有毒株和无毒株区分开,而 ERIC-PCR结合毒力基因检测的方法, 在此病原菌流行病学的研究中具有更可靠的应用前景。
从表 3和表4我们可以发现, 嗜水气单胞菌的毒力大体与菌株含有的毒力基因数量呈正相关。代表菌株的毒力测定显示, 除池水株PW01外, 含有7个毒力基因的临床株、肠道株和池水株均为强毒株(LD50<105CFU/尾), 缺失气溶素的菌株(4LNC203,4LNC305)为弱毒株(LD50≥1.61×106), 同时缺失气溶素与溶血素的菌株(4LNC209)毒力最弱(LD50=6.61×106)。这表明毒力基因作为标记基因, 在此病原菌的检测中具有良好的应用前景。从表 3我们还发现,aerA、hlyA和alt三个基因或许可以作为基因标记,用来区分嗜水气单胞菌的强毒株和弱毒株。
综上所述, 本文第一次系统性的研究了 MAS暴发鱼塘中嗜水气单胞菌的遗传多样性和毒力特征。20株临床株分别分离自3个城市、6个不同的池塘、3个不同的年份、4个不同的时间点和5种不同的鱼类, 其gyrB序列、ERIC带型、毒力基因型和致病性, 均表明此疫区中的病原嗜水气单胞菌属于同一克隆系。同一池塘中的其他非同源的池水和肠道株致病性弱, 表现出了遗传多样性。在一定区域内 MAS暴发病的病原具有相似遗传特征这一研究发现, 提示可望借助地区特异性疫苗防御此疾病。此外, 7种重要毒力基因的广泛流行, 为致病机理的解析提供了线索。
[1] Cipriano R C.Aeromonas hydrophilaand Motile Aeromonad Septicemias of Fish [M].Fish Disease Leaflet, 2001, 68
[2] Lu C P.PathogenicAeromonas hydrophilaand the fish diseases caused by it [J].Journal of Fisheries of China, 1992,16(3): 282—288 [陆承平.致病性嗜水气单胞菌及其所致鱼病综述.水产学报, 1992, 16(3): 282—288]
[3] Ge H Y, Wang L M, Zheng Y H,et al.Effects of raffinose on growth performance, immunity, stress response and survival of Japanese Seabass (Lateolabrax japonicus) challenged withAeromonas hydrophila[J].Acta Hydrobiologica Sinica, 2011,35(2): 283—290 [葛红云, 王兰梅, 郑银桦, 等.棉子糖对花鲈生长、免疫抗应激及抵御嗜水气单胞菌攻毒的影响.水生生物学报, 2011, 35(2): 283—290]
[4] Ai X H, Ding Y M, Wang K Y,et al.Study on pharmacokinetics/pharmacodynamics model of doxycycline againstAeromonas hydrophilain serum of channel catfishex vivo[J].Acta Hydrobiologica Sinica, 2011, 35(6): 893—899 [艾晓辉,丁运敏, 汪开毓, 等.在斑点叉尾血清中强力霉素对嗜水气单胞菌药动-药效模型研究.水生生物学报, 2011,35(6): 893—899]
[5] Abbott S L, Cheung W K W, Janda J M.The genusAeromonas: Biochemical characteristics, atypical reactions,and phenotypic identification schemes [J].Journal of Clinical Microbiology, 2003, 41(6): 2348—2357
[6] Thomas L V, Gross R J, Cheasty T,et al.Extended serogrouping scheme for motile, mesophilicAeromonasspecies[J].Journal of Clinical Microbiology, 1990, 28(5): 980—984
[7] Szczuka E, Kaznowski A.Typing of clinical and environmentalAeromonassp strains by random amplified polymorphic DNA PCR, repetitive extragenic palindromic PCR, and enterobacterial repetitive intergenic consensus sequence PCR[J].Journal of Clinical Microbiology, 2004, 42(1): 220—228
[8] Borchardt M A, Stemper M E, Standridge J H.Aeromonasisolates from human diarrheic stool and groundwater compared by pulsed-field gel electrophoresis [J].Emerging Infectious Diseases, 2003, 9(2): 224—228
[9] Aguilera-Arreola M G, Hernandez-Rodriguez C, Zuniga G,et al.Virulence potential and genetic diversity ofAeromonas caviae,Aeromonas veroniiandAeromonas hydrophilaclinical isolates from Mexico and Spain: a comparative study[J].Canadian Journal of Microbiology, 2007, 53(7): 877—887
[10] Howard S P, Garland W J, Green M J,et al.Nucleotide sequence of the gene for the hole forming toxin arolysin ofAeromonas hydrophila[J].Journal of Bacteriology, 1987,169(6): 2869—2871
[11] Hirono I, Aoki T.Nucleotide sequence and expression of an extracellular hemolysin gene ofAeromonas hydrophila[J].Microbial Pathogenesis, 1991, 11(3): 189—197
[12] Sha J, Kozlova E V, Chopra A K.Role of various enterotoxins inAeromonas hydrophila-induced gastroenteritis: Generation of enterotoxin gene-deficient mutants and evaluation of their enterotoxic activity[J].Infection and Immunity,2002, 70(4): 1924—1935
[13] Cascon A, Yugueros J, Temprano A,et al.A major secreted elastase is essential for pathogenicity ofAeromonas hydrophila[J].Infection and Immunity,2000, 68(6): 3233—3241
[14] Merino S, Aguilar A, Nogueras M M,et al.Cloning,sequencing, and role in virulence of two phospholipases (A1 and C) from mesophilicAeromonassp.serogroup O : 34[J].Infection and Immunity, 1999, 67(8): 4008—4013
[15] Rabaan A A, Gryllos I, Tomas J M,et al.Motility and the polar flagellum are required forAeromonas caviaeadherence to HEp-2 cells [J].Infection and Immunity,2001, 69(7):4257—4267
[16] Heuzenroeder M W, Wong C Y, Flower R L.Distribution of two hemolytic toxin genes in clinical and environmental isolates ofAeromonasspp.: correlation with virulence in a suckling mouse model [J].FEMS Microbiology Letters, 1999,174(1): 131—136
[17] Zhu D L, Li A H, Wang J G,et al.The Correlation between the distribution pattern of virulence genes and the virulence ofAeromonas hydrophilastrains [J].Acta Scientiarum Naturalium Universitatis Sunyatseni, 2006, 45(1): 82—85[朱大玲, 李爱华, 汪建国, 等.嗜水气单胞菌毒力与毒力基因分布的相关性.中山大学学报(自然科学版), 2006,45(1): 82—85]
[18] Li J, Ni X D, Liu Y J,et al.Detection of three virulence genesalt,ahpandaerAinAeromonas hydrophilaand their relationship with actual virulence to zebrafish [J].Journal of Applied Microbiology,2011, 110(3): 823—830
[19] Farmer J J, Arduino M J, Hickman-Brenner F W.The GeneraAeromonasandPlesiomonas[M].In: Balows A,Triiper H G, Dworkin M,et al(Eds.), The Prokaryotes.NewYork, USA.1992, 3012—3043
[20] Xu B H, Yin Z, Wu Y S,et al.Studies on the taxonomy of pathogenic bacterial of the bacterial hemorrhagic septicemia in cultured fishes in freshwater [J].Acta Hydrobiologica Sinica, 1993, 17(3): 259—266 [徐伯亥, 殷战, 吴玉深, 等.淡水养殖鱼类暴发性传染病致病细菌的研究.水生生物学报,1993, 17(3): 259—266]
[21] Dong X Z, Cai M Y.Manual of Systematic Determination of Familiar Bacteria [M].Beijing: Science Press.2001, 162—171, 353—386 [东秀珠, 蔡妙英.常见细菌系统鉴定手册.北京: 科学出版社.2001, 162—171, 353—386]
[22] Borrell N, Acinas S G, Figueras M J,et al.Identification ofAeromonasclinical isolates by restriction fragment length polymorphism of PCR-amplified 16S rRNA genes [J].Journal of Clinical Microbiology, 1997, 35(7): 1671–1674
[23] Yanez M A, Catalan V, Apraiz D,et al.Phylogenetic analysis of members of the genusAeromonasbased on gyrB gene sequences [J].International Journal of Systematic and Evolutionary Microbiology, 2003, 53(3): 875—883
[24] Aguilera-Arreola M G, Hernandez-Rodriguez C, Zuniga G,et al.Aeromonas hydrophilaclinical and environmental ecotypes as revealed by genetic diversity and virulence genes[J].FEMS Microbiology Letters, 2005, 242(2): 231—240
[25] Millemann Y, LesageDescauses M C, Lafont J P,et al.Comparison of random amplified polymorphic DNA analysis and enterobacterial repetitive intergenic consensus-PCR for epidemiological studies ofSalmonella[J].FEMS Immunology and Medical Microbiology, 1996, 14(2—3): 129—134
[26] Wong C Y F, Heuzenroeder M W, Flower R L P.Inactivation of two haemolytic toxin genes inAeromonas hydrophilaattenuates virulence in a suckling mouse model[J].Microbiology, 1998, 144(2): 291—298
[27] Sen K, Rodgers M.Distribution of six virulence factors inAeromonasspecies isolated from US drinking water utilities:a PCR identification[J].Journal of Applied Microbiology,2004, 97(5): 1077—1086
[28] Li A H.The study of the drug resistance, resistance plasmid of fish pathogenic bacteria, and the antibacterial action of several drug in China [D].Wuhan.Chinese Academy of Sciences, Institute of Hydrobiology, PhD thesis.1998 [李爱华.我国鱼类病原菌耐药性、耐药质粒及几种药物抗菌作用的研究.武汉.中国科学院水生生物研究所博士学位论文.1998]
[29] Maiti B, Raghunath P, Karunasagar I,et al.Typing of clinical and environmental strains ofAeromonasspp.using two PCR based methods and whole cell protein analysis[J].Journal of Microbiological Methods, 2009, 78(3): 312—318
[30] Xiao D, Cao H P, Hu K,et al.ERIC-PCR genotyping and drug resistant analysis of pathogenicAeromonas hydrophilafrom freshwater animals [J].Journal of Fishery Sciences of China, 2011, 18(5): 1092—1099 [肖丹, 曹海鹏, 胡鲲, 等.淡水养殖动物致病性嗜水气单胞菌 ERIC-PCR 分型与耐药性.中国水产科学, 2011, 18(5): 1092—1099]
[31] Wang N, Zhang X J, Liu Y J,et al.Research Progress of Type III Secretion System inAeromonas hydrophila[J].Journal of Hebei Normal University of Science &Technology, 2011, 25(1): 21—24 [王娜, 张小军, 刘永杰,等.嗜水气单胞菌III型分泌系统研究进展.河北科技师范学院学报, 2011, 25(1): 21—24]
[32] Silver A C, Graf J.Prevalence of genes encoding the type three secretion system and the effectors AexT and AexU in theAeromonas veroniiGroup [J].DNA and Cell Biology,2009, 28(8): 383—388
[33] Carvalho-Castro G A, Lopes C O, Leal C A G,et al.Detection of type III secretion system genes inAeromonas hydrophilaand their relationship with virulence in Nile tilapia [J].Veterinary Microbiology, 2010, 144(3—4): 371—376
[34] Martino M E, Fasolato L, Montemurro F,et al.Determination of microbial diversity ofAeromonasstrains on the basis of multilocus sequence typing, phenotype, and presence of putative virulence genes [J].Applied and Environment Microbiology, 2011, 77(14): 4986—5000
