海洋红藻龙须菜对2种逆境温度胁迫的应激生理响应
2013-07-24蔡西栗徐年军
孙 雪 蔡西栗 徐年军
(宁波大学海洋学院, 浙江省海洋生物工程重点实验室, 教育部应用海洋生物技术重点实验室, 宁波 315211)
龙须菜(Gracilaria lemaneiformis)是红藻门、江蓠属海藻, 主要用于生产琼胶和饲喂鲍鱼, 能有效改善海洋生态环境, 具有一定的社会效益[1]。随着海藻胶工业的发展, 对琼胶生产原料藻的需求也日益增加。目前, 龙须菜在我国已经成为继海带(Laminaria)、紫菜(Porphyra)、裙带菜(Undaria)之后的第4大栽培海藻[2]。野生龙须菜主要生长在北方, 经过改良的龙须菜 981品系在 12—26℃生长较好, 目前已经在我国广东、福建、浙江、山东、辽宁等沿海地区大面积养殖, 其生长快, 养殖技术成熟, 带动了一个大型海藻的新兴产业链。
温度是影响海藻生长的主要生态因子, 是造成海藻色素、蛋白质和糖类等生化组分变化的主要因素[3]。龙须菜最适生长季节是春季和秋季, 在夏季气温较高时生长缓慢, 持续高温可使藻体严重损伤, 生长期缩短, 造成产量和品质下降。而在冬季海水温度过低, 龙须菜生长速度非常缓慢。因此对龙须菜高温和低温逆境下的生理研究具有重要意义。本文探讨了这两种温度胁迫下龙须菜生长、细胞超微结构、抗氧化酶、过氧化产物、光合色素、渗透调节物质及植物激素的短期应激响应规律, 为系统研究龙须菜在温度胁迫下的应激调控机制提供了理论基础。
1 材料与方法
1.1 实验材料
龙须菜(G.lemaneiformis)981于2010年9月采于福建宁德海藻养殖场(26º36′N, 119º42′E), 在实验室保种培养1个月左右。实验前于25℃预培养1周。实验在光照培养箱中进行, Provasoli培养基[4], 光照强度60 μmol/(m2·s),光周期 L∶D(12h∶12h), 盐度 25‰。分别设置低温胁迫组(15℃)、高温胁迫组(33℃)和对照组(25℃), 每组3个平行。分别于培养0、1、3、6、10、24、48、72h取样, 蒸馏水快速冲洗后吸干水分, 液氮快速处理后于−20℃保存,冷冻干燥备用。
吲哚乙酸(IAA)、茉莉酸(JA)、水杨酸(SA)、肉桂酸(RA)、脯氨酸、甜菜碱标准品和三甲基硅烷基重氮甲烷正己烷溶液均购自Sigma公司; 脱落酸(ABA)、二氢茉莉酸(dhJA)购自东京化成工业株式会社; 甲醇、正己烷为色谱纯; 其余试剂为分析纯。
1.2 实验方法
相对生长速率的测定 通过测定龙须菜实验前后藻体鲜质量的变化, 计算相对生长速率(RGR)[5].
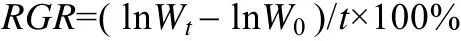
式中:W0为实验开始时藻的鲜质量(g);Wt为实验结束时藻的鲜质量(g);t为实验天数。
细胞超微结构的观察 龙须菜藻体用 3%戊二醛固定, 0.1 mol/L PBS缓冲液冲洗后用1%锇酸固定, 再用PBS缓冲液冲洗, 经系列丙酮脱水、渗透、包埋、超薄切片, 最后用醋酸铀-柠檬酸铅双重染色, 在日立H-7650型透射电镜(TEM)观察。
SOD、POD和MDA检测 准确称取样品0.1 g, 液氮研磨后加0.1 mol/L PBS 缓冲液(pH 7.8)10 mL, 7000 r/min离心10min, 取上清液。SOD活力测定采用氮蓝四唑(NBT)法, POD活力测定采用愈创木酚法, MDA含量测定采用硫代巴比妥酸法[6]。
光合色素的含量检测 藻红蛋白(R-PE)、藻蓝蛋白(R-PC)和叶绿素a含量测定参考朱招波等的方法[7]: 藻红蛋白和藻蓝蛋白测定取龙须菜0.1 g, 液氮研磨后PBS缓冲液提取, 分光光度计测定。叶绿素a含量测定另取龙须菜0.1 g液氮研磨后, 80%丙酮提取, 分光光度法测定其含量。
渗透调节物的含量测定 脯氨酸和甘露醇含量测定参照朱招波等的方法[7]: 游离脯氨酸采用磺基水杨酸反应后酸性茚三酮显色法测定。甘露醇含量采用硫酸铜比色法测定。
植物激素的含量测定 5种植物激素含量测定参照蔡西栗等的方法[8]。0.2 g龙须菜液氮研磨后加入含BHT 100 mg/L的正丙醇∶水∶HCl(2∶1∶0.002)提取, 提取物固相萃取柱纯化, 甲醇洗脱, 三甲基硅烷化重氮甲烷正己烷溶液衍生化, 水浴反应后氮气吹干, GC-MS分析。
植物激素含量计算采用公式: 植物激素含量(ng/g)=(A激素/A内标/a×M)/W。其中A为峰面积,a为标准曲线的斜率,M为内标加入量,W为样品重。
1.3 数据分析方法
采用Excel 2003、Origin 8.0统计软件进行数据处理及统计分析。
2 结果
2.1 逆境温度对龙须菜相对生长速率的影响
图1可见, 龙须菜在低温和高温下生长均受到抑制,高温对生长的影响更明显。低温胁迫龙须菜的相对生长速率是4.58%/d, 为对照组的72.93%; 在高温胁迫下龙须菜的相对生长速率是2.43%/d, 为对照组的38.69%。龙须菜在高温和低温胁迫下, 藻体均表现出分枝减少, 颜色变浅等症状, 在高温胁迫下龙须菜还出现了根尖变白、易碎等症状, 部分藻体死亡。
2.2 逆境温度对龙须菜细胞超微结构的影响
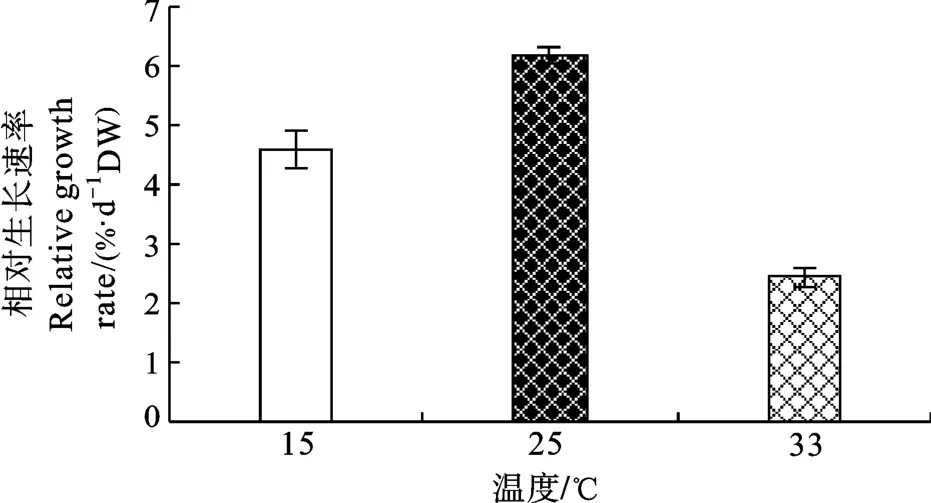
图1 逆境温度对龙须菜相对生长速率的影响Fig.1 Effects of adverse temperature on the relative growth rate(RGR) of G.lemaneiformis
由图 2可见, 对照组龙须菜的细胞壁结构完整, 层次分明(图2b); 色素体板层状结构清晰, 层次分明(图2e);细胞内红藻淀粉颗粒较少, 细胞间孔状联系结构清晰、完整(图 2h)。低温胁迫组龙须菜的细胞壁结构发生了褶皱,层次模糊, 且周围有少量红藻淀粉颗粒附着(图2a); 细胞内出现较多的红藻淀粉颗粒, 色素体板层结构较为模糊,有明显的肿胀现象(图2d); 但细胞间孔状联系仍清晰、完整(图2g)。高温胁迫组龙须菜细胞壁结构较为完整, 但层次模糊难辨(图2c), 细胞内出现大量的红藻淀粉颗粒, 色素体板层状结构较为完整(图2f), 细胞间孔状联系扭曲变形(图 2i)。
2.3 逆境温度对龙须菜SOD、POD、MDA的影响
由图3可见, 对照组龙须菜SOD、POD活性和MDA含量均较稳定。SOD活性维持在529.27—608.73 U/g, POD活性维持在337.52—377.56 U/g。在低温胁迫下龙须菜的SOD活性比对照组略低, 72h时最终活性为对照组的81.74%。POD活性先下降后上升, 最终活性与对照组无显著差异。MDA含量前期略有升高, 6h之后恢复到正常水平。在高温胁迫下龙须菜SOD活性比对照组显著降低,72h时下降到了 342.26 U/g, 为对照组的 56.23%。POD活性有所上升, 72h时达到705.42 U/g, 比对照组高出95.8%。MDA含量有较明显的升高, 72h时达到124.41 µmol/g, 比对照组高89.0%。
2.4 逆境温度对龙须菜光合色素的影响
由图 4可见, 对照组龙须菜藻红蛋白、藻蓝蛋白和叶绿素a含量在培养前48h均较为稳定, 48h后均略有下降, 这可能是培养基中的营养盐含量减少所致。红藻光合色素含量与介质氮浓度密切相关, 氮浓度高时, 藻体内光合色素含量也高; 缺氮时光合色素含量降低[9]。在低温和高温胁迫下龙须菜光合色素均有一定程度的下降, 在低温胁迫下藻红蛋白、藻蓝蛋白和叶绿素a含量开始迅速下降, 最终含量为对照组的74.79%、74.88%和73.86%。在高温胁迫下龙须菜3种光合色素在48h与低温胁迫组基本相同, 但72h时进一步下降到对照组的45.33%、59.02%和50.12%。可见高温对龙须菜色素的破坏作用比较强。
2.5 逆境温度对龙须菜渗透调节物质的影响
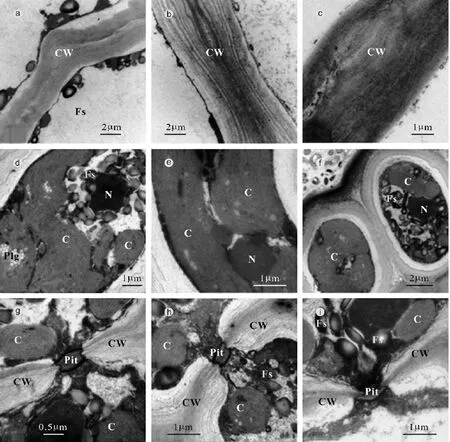
图2 逆境温度对龙须菜细胞超微结构的影响Fig.2 Effects of adverse temperature on the ultrastructure of G.lemaneiformis cells by TEM
由图 5可见, 对照组龙须菜体内脯氨酸和甘露醇含量相对较稳定。在低温胁迫下龙须菜的脯氨酸含量随着胁迫时间的延长缓慢增加, 72h时比对照组增加了44.99%。在高温胁迫下龙须菜脯氨酸含量增加更快, 72h比对照组高出了 69.78%。在低温胁迫下甘露醇含量与对照组差异不显著(P>0.05)。在高温胁迫下甘露醇含量在72 h时达到108.23 mg/g, 比对照组高34.47%。
2.6 逆境温度对龙须菜植物激素的影响
由图6可见, 对照组龙须菜中IAA含量变化不显著,其他 4种植物激素在实验过程中均有所上升, 这可能是龙须菜在生长过程中受到营养等条件变化所致。在两种温度胁迫下龙须菜 IAA都有所降低, 但高温胁迫对龙须菜IAA影响较大, 72h时比对照组下降了39.75%, 而低温胁迫下龙须菜IAA含量降低不明显。其他4种植物激素在这 2种温度胁迫下均有所升高, 并且呈先上升后下降的在10h和6h达到最大值, 在高温下SA含量的变化更快。在低温和高温胁迫下RA含量比对照组高, 到10h达到最大值, 随后又缓慢下降。
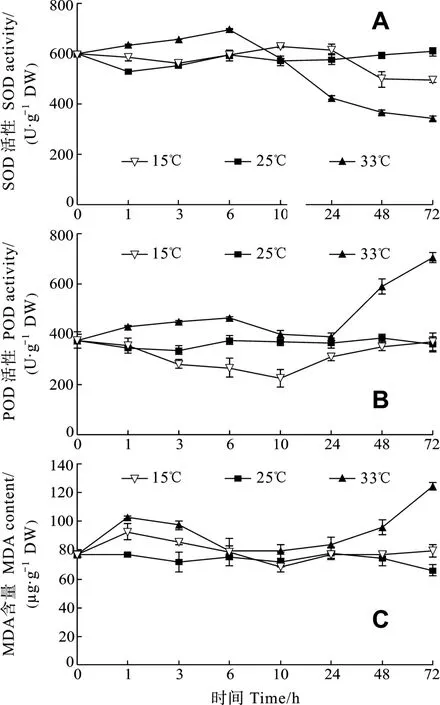
图3 逆境温度对龙须菜SOD、POD活性和MDA含量的影响Fig.3 Effects of adverse temperature on the SOD, POD activities and MDA content of G.lemaneiformis
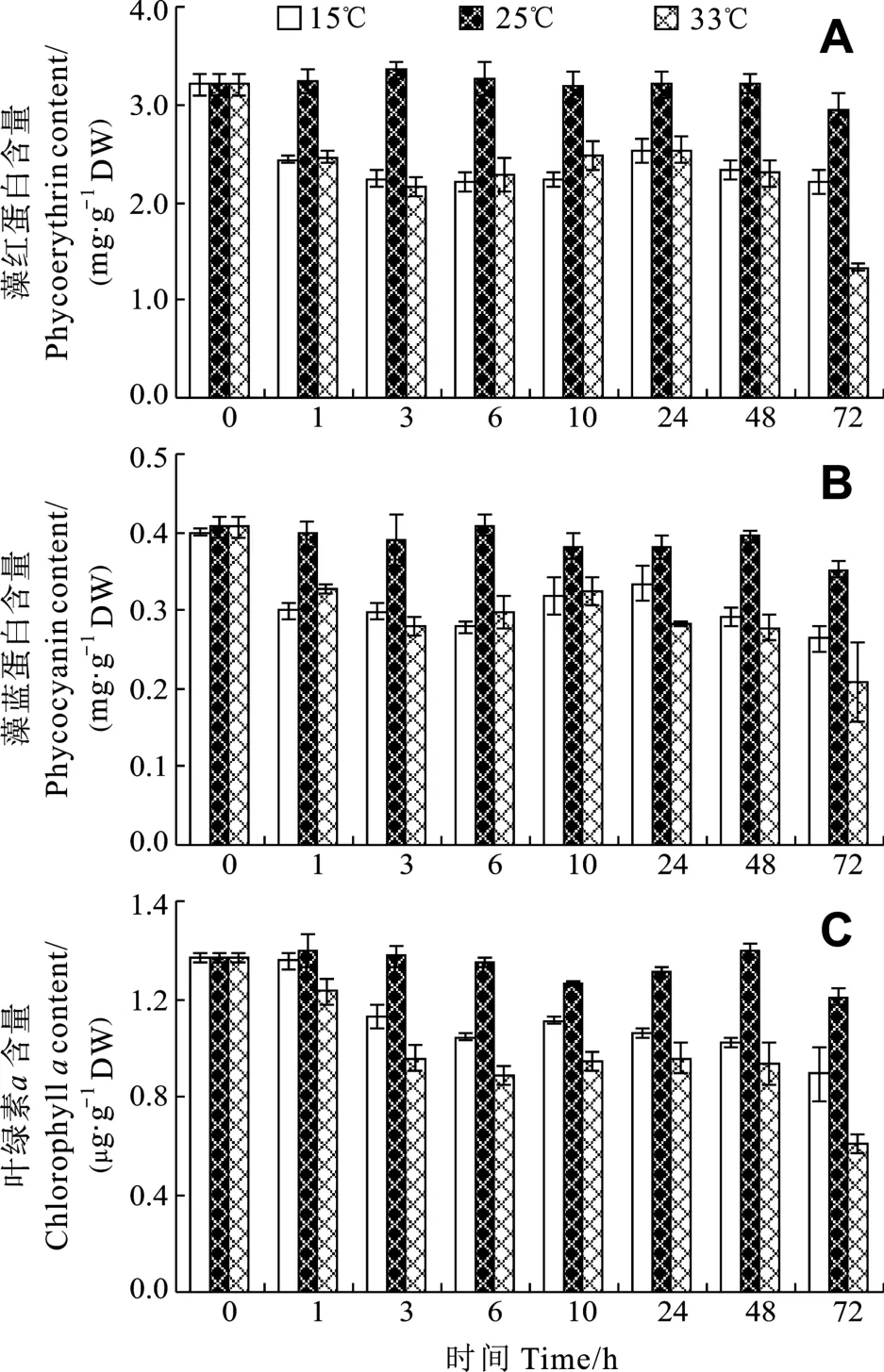
图4 逆境温度对龙须菜藻红蛋白、藻蓝蛋白和叶绿素a含量的影响Fig.4 Effects of adverse temperature on the contents of phycoerythrin, phycocyanin and chlorophyll a of G.lemaneiformis
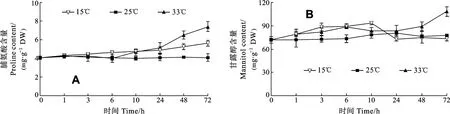
图5 逆境温度对龙须菜渗透调节物质脯氨酸和甘露醇含量的影响Fig.5 Effects of adverse temperature on the proline and mannitol content of G.lemaneiformis
3 讨论
3.1 温度胁迫对龙须菜生长速率、超微结构和抗氧化系统的影响
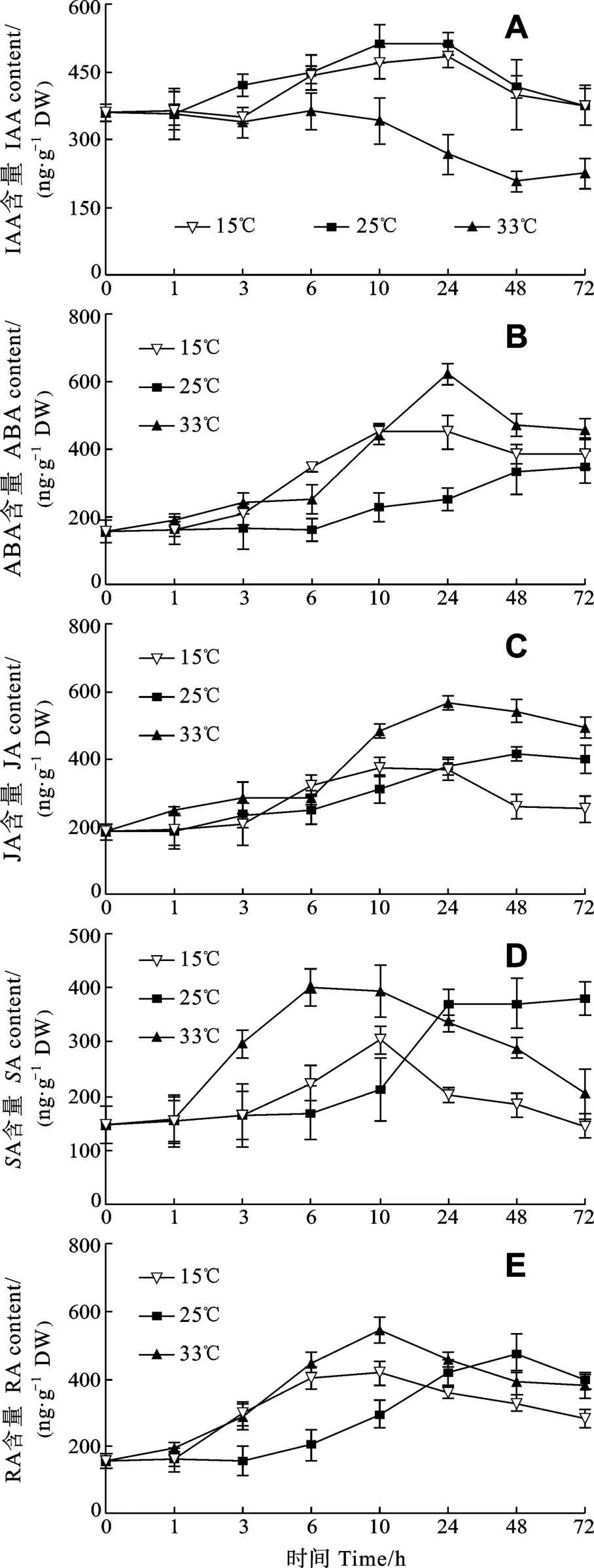
图6 逆境温度对龙须菜植物激素(吲哚乙酸、脱落酸、茉莉酸、水杨酸、肉桂酸)含量的影响Fig.6 Effects of adverse temperature on the phytohormone (IAA,ABA, JA, SA, RA) content of G.lemaneiformis
植物的生长受温度、光照、营养等多种环境因子的影响, 其中温度主要影响代谢酶的活性和代谢速度。在低温胁迫下龙须菜的酶活受到一定影响, 但在 15℃条件下龙须菜仍然能够适应。在高温胁迫下龙须菜抗氧化酶活性受到抑制, 破坏了细胞结构, 所以其生长受抑制程度要高于低温组。余江[10]研究发现龙须菜(G.lemaneiformis)在30℃、盐度22‰、光照5000 1x时藻体细胞出现明显的质壁分离、类囊体膨胀变形、嗜锇颗粒沉积、线粒体部分溶解等特征, 生长受到明显抑制。本实验发现在温度胁迫下龙须菜细胞壁和色素体结构受到不同程度的损伤,细胞内红藻淀粉颗粒大量积累, 这可能是细胞自我保护的一种机制。
植物体内SOD可以消除超氧化物自由基并将其转变成H2O2, 而POD可以将H2O2转变成H2O和O2, 从而彻底消除超氧化物自由基, 它们的活性对环境变化非常敏感。在本实验中低温胁迫下龙须菜SOD、POD、MDA与对照组相比差别不大, 在高温胁迫下龙须菜 SOD活性在前期有所提高, 后期显著下降; POD活性和MDA含量在胁迫后期显著上升。这一结果与柯德森等的结果相似[11],他们报道当温度低于25℃时龙须菜POD活性随培养时间变化并不明显, 但在30℃或35℃条件下12d内POD活性上升了近5倍。
3.2 温度胁迫对龙须菜光合色素和渗透调节物质的影响
龙须菜的光合色素主要有藻红蛋白(R-PE)、藻蓝蛋白(R-PC)、别藻蓝蛋白(APC)和叶绿素, 其含量容易受环境因素的影响[12]。在高温胁迫下江蓠(Gracilariasp.)中藻红蛋白、藻蓝蛋白、别藻蓝蛋白和叶绿素比例发生了变化,藻体的颜色就会发生相应的变化。在本实验中龙须菜在低温和高温胁迫下颜色变浅, 可能是由于藻红蛋白、藻蓝蛋白和叶绿素a含量下降所引起的, 对这3种光合色素的含量检测结果验证了这一点。
植物体内脯氨酸、甘露醇不仅对细胞渗透压起调节作用, 还对活性氧特别是 O2-和·OH 的产生有抑制作用,对·OH有清除作用, 表明渗透调节物质的积累对植物抗逆性有双重作用。Chang,et al.[13]研究发现细基江蓠繁枝变种(G.tenuistipitatavar.liui)在35℃条件下脯氨酸含量第2天开始逐渐增加, 第7天后由于藻体的部分死亡含量开始下降。在本实验中低温胁迫下龙须菜脯氨酸含量升高,而甘露醇含量没有显著变化。在高温胁迫下脯氨酸和甘露醇都有一定程度的升高, 表明温度胁迫造成了龙须菜渗透压的改变, 其中脯氨酸在渗透调节中作用较大。
3.3 温度胁迫对龙须菜内源植物激素的影响
植物受到逆境胁迫时, 体内的植物激素会发生应激性变化, 从而激活体内的信息传递系统, 产生抵御逆境胁迫的生理活性物质。如逆境胁迫条件下植物启动脱落酸(ABA)合成系统, 合成更多的 ABA, 调节体内的水分代谢, 控制呼吸作用, 增强植株抵抗能力[14]。在植物体内的水杨酸信号通路中, SA主要通过诱导脂质过氧化使逆境蛋白表达从而获得抗性, JA也作为内源信号分子参与生物因子和非生物因子逆境胁迫的信号传递。樊扬等[15]发现龙须菜愈伤组织分化过程中内源激素 iPAs、GA、IAA和ABA含量发生改变, 尤其是ABA的积累与高等植物在逆境胁迫中表现相同。本实验结果显示低温对龙须菜IAA影响不显著, 而高温胁迫下 IAA一直处于较低水平, 表明高温胁迫可能抑制了 IAA的产生, 因而对龙须菜的生长影响较大。在2种温度胁迫下ABA含量均有所升高, 在高温胁迫下ABA变化更大, 表明高温更能刺激龙须菜在短时间内对胁迫做出应激反应, 以减少逆境对藻体的伤害。低温胁迫下龙须菜JA含量变化不大, 高温胁迫下JA含量一直处于较高水平, 表明高温胁迫导致的伤害更大。SA和RA的变化趋势一致, 可能是因为SA合成的途径之一就是由反式肉桂酸的侧链 β氧化生成, 在两种胁迫前期SA和RA含量高于对照组, 后期呈现下降趋势。
龙须菜对温度胁迫比较敏感, 特别是高温对龙须菜的生理影响更大。温度胁迫导致光合色素蛋白变性, 细胞内抗氧化酶等酶活受到影响, 从而影响细胞渗透调节系统, 最终造成细胞结构破坏, 生长减慢甚至逐渐死亡。同时还可以通过内源性植物激素的快速响应调节缓解藻体的抗逆生理。
[1] Yang Y F, Fei X G, Song J M,et al.Growth ofGracilaria lemaneiformisunder different cultivation conditions and its effects on nutrient removal in Chinese coastal waters[J].Aquaculture, 2006, 254: 248—255
[2] Zhang X C, Fei X G, Wang G C,et al.Genetic studies and large scale cultivation ofGracilaria lemaneiformis[J].Periodical of Ocean University of China, 2009, 39(5):947— 954 [张学成, 费修绠, 王广策, 等.江蓠属海藻龙须菜的基础研究与大规模栽培.中国海洋大学学报,2009, 39(5): 947—954]
[3] Zhu D T, Qiao N N, Li M H,et al.Effect of light intensity,temperature, total nitrogen concentration and their interaction onHydrilla verticillata[J].Acta Hydrobiologica Sinica,2011, 35(1): 88-97 [朱丹婷, 乔宁宁, 李铭红, 等.光强、温度、总氮浓度对黑藻生长的影响.水生生物学报, 2011,35(1): 88-97]
[4] Provasoli L.Media and prospects for the cultivation of marine algae [c].In: Watanabe A, Hattori R (Eds.), Culture and collections of algae [A].Proceedings of the US/Japan Conference, Hakone, The Japanese Society of Plant Physiologists, 1968, 63—75
[5] Abreu M H, Varela D A, Henriquez L,et al.Traditional vs.integrated multi-trophic aquaculture ofGracilaria chilensisC.J.Bird, J.McLachlan & E.C.Oliveira: productivity and physiological performance [J].Aquaculture,2009, 293: 211—220
[6] Wayne F, Beyer J R, Fridovich I.Assaying for superoxide dismutase activity: some large consequences of minor changes in conditions [J].Analytical Biochemistry, 1987,161(2): 559—566
[7] Zhu Z B, Sun X, Xu N J,et al.Effects of salicylic acid on the resistance ofGracilaria/Gracilariopsis lemaneiformisto high temperature [J].Journal of Fisheries of China,2012, 36(8): 1304—1312 [朱招波, 孙雪, 徐年军, 等.水杨酸对龙须菜抗高温生理的影响.水产学报, 2012,36(8): 1304—1312]
[8] Cai X L, Shao M W, Sun X,et al.Detection of multitple phytohormones by GC-MS technique inGracilaria lemaneiformisand the response to nitrogen stresses [J].Oceanologia et Limnologia Sinica, 2011, 42(6): 753—758 [蔡西栗, 旻邵玮, 孙雪, 等.龙须菜(Gracilaria lemaneiformis)中多种植物激素的GC-MS检测及对氮胁迫的响应.海洋与湖沼, 2011, 42(6): 753—758]
[9] Li F, Zou D H, Liu Z P.Effects of nitrogen and phosphorous levels on growth and photosynthetic traits ofGracilaria lemaneiformis(Rhodophyta) [J].Chinese Journal of Plant Ecology, 2009, 33(6): 1140—1147 [李枫, 邹定辉, 刘兆普.氮磷水平对龙须菜生长和光合特性的影响.植物生态学报, 2009, 33(6): 1140—1147]
[10] Yu J.The responses of macroalgaeGracilaria lemaneiformisto environmental stress and its preliminary application in medicine.Ph.D Thesis [D].Jinan University,Guangzhou, 2008 [余江.大型海藻龙须菜对环境胁迫的响应及其在医学上的应用初探.博士学位论文, 暨南大学, 广州, 2008]
[11] Ke D S, Shi Y D, Wang Z X.Effects of environmental factors on the activity of peroxidase inGracilaria lemaneiformis[J].Journal of Guangzhou University(Natural Science Edition).2007, 6(4): 26—29 [柯德森,史椰灯, 王正询.环境因素对龙须菜过氧化物酶活性的影响.广州大学学报, 2007, 6(4): 26—29]
[12] Shen D L, Wu M.Chromosomal and mutagenic study of the marine macroalga,Gracilaria tenuistipitata[J].Journal of Applied Phycology, 1995, 7(1): 25—31
[13] Chang Y C, Lee T M.High temperature-induced free proline accumulation inGracilariatenuistipitata(Rhodophyta) [J].Botanical Bulletin of Academia Sinica,1999, 40(4): 289—294
[14] Wang X J.Drying rate and dehydrin synthesis associated with abscisic acid-induced dehydration tolerance inSpathoglottis plicataorchidaceae protocorms [J].Experimental Botany, 2002, 53(368): 551—558
[15] Fan Y, Li R Z.Induction of callus-like tissue from creeping tissue ofGracilaria lemaniformis(Rhodophyta) and mechanism analysis [J].Oceanologia et Limnologia Sinica, 2000, 31(1): 29—34 [樊扬, 李纫芷.龙须菜匍匐体类愈伤组织诱导及机制分析.海洋与湖沼, 2000,31(1): 29—34]
