藏灵菇中Enterococcus faecalis RQ15的分离及鉴定
2013-07-23孙翠焕冀宝营朱巍巍王艳华朱万芹
孙翠焕,冀宝营,朱巍巍,王艳华,朱万芹
(辽宁省微生物科学研究院,辽宁朝阳 122000)
藏灵菇也称雪莲花,是流传在民间的家庭制作酸奶用菌种。它是一种乳白色、胶质状的块状物,有一定弹性,菌块外部形成多数米粒状,菌块在牛乳中随着培养时间及传代次数增多会逐渐生长,分割后放入乳中培养,生长特性不改变[1]。藏灵菇是由多种微生物共生形成的一种菌团,与国外研究较多的开菲尔粒类似。菌块上栖息的微生物有乳酸菌、酵母菌、醋酸菌[2],在发酵牛乳时,除生成大量的有机酸和少量乙醇外,还有其他丰富的生物活性物质,营养价值较高。据文献记载,藏灵菇具有反抗炎作用[3],其发酵产物可加速唾液、胃酶及胰酶分泌;产生的乳酸、醋酸及抗菌物质可抑制小肠中的腐败微生物生长,抗菌物质还能抑制癌细胞的生成及增殖;发酵产生的微量乙醇可以促进新陈代谢[4]。相关研究显示[2],根据藏灵菇来源不同,其中菌群会有差异,以乳酸球菌为例,可归为5个种属,分别为粪肠球菌(Enterococcus faecalis)、坚强肠球菌、乳酸乳球菌乳脂亚种、假肠膜明串珠菌、类肠膜明串珠菌。粪肠球菌是人和动物肠道中的正常栖生菌,已有作为益生菌使用先例。粪肠球菌能利用多种糖发酵产酸,在国外已应用到干酪的成熟中;瑞典公司将粪肠球菌与长双歧杆菌混合制成胶囊;作为保健药品,我国农业部允许使用粪肠球菌用于饲料添加剂中,国内也有把粪肠球菌用于人用口服液的研究报道。但研究中发现,自藏灵菇中分离的粪肠球菌产生的蛋白酶具有低温蛋白酶的特征[5]。目前应用最多的生产蛋白酶的细菌是枯草芽胞杆菌,其他细菌因产酶能力低,研究较少,尤其是乳酸菌。本文对藏灵菇中粪肠球菌的分离及鉴定作一报道,为其进一步研究与开发利用提供理论依据。
1 材料与方法
1.1 材料
1.1.1 菌种 藏灵菇:本实验室收藏,用于家庭制作酸奶。
1.1.2 培养基 增殖及菌种保藏培养基:12%复原脱脂乳;分离培养[6]:酸化MRS培养基(调整pH值为5.4);M17培养基;改良TJA培养基。
1.1.3 仪器设备 超净工作台;CO2培养箱;恒温培养箱;液体混合振荡器;高压灭菌锅;显微镜。
1.2 方法
1.2.1 菌种的活化与扩增 用无菌水冲洗藏灵菇后,按2%(质量体积比)的比例接种到12%复原脱脂乳中,30℃培养24 h,过滤出藏灵菇,如此连续活化3次,第3次发酵乳备用。显微镜观察菌体生长情况。
1.2.2 菌种的分离、纯化及鉴定[7-9]①无菌吸取活化扩增后的藏灵菇发酵乳1 mL,用无菌生理盐水稀释,在液体混合器上振荡10 min,使菌体分散。以10倍稀释法稀释至10-6、10-72个稀释度,取稀释液 0.1 mL,分别涂布于酸化 MRS、M17、改良TJA培养基上,平板倒置,调整10%CO2浓度,37℃恒温培养24~48 h,观察菌落生长情况及菌体形态。挑选典型菌落进行革兰染色,把革兰染色阳性菌株在改良TJA培养基上划线,37℃恒温有氧培养,进行纯化。同时验证菌株耐氧性;②粪肠球菌的生理生化鉴定:过氧化氢酶测定:挑取纯化平板上单菌落,涂于干净的载玻片上,然后在上面加1滴3%~15%H2O2,如果有气泡产生则为阳性反应,无气泡为阴性反应。石蕊牛乳的培养试验:挑取纯化平板上单菌落,转至含有10 mL灭菌脱脂石蕊牛乳的试管中,37℃恒温培养6~12 h,观察状态变化。出现均匀的凝乳状态,颜色为粉红色,无气泡产生的现象为阳性反应。乳酸发酵的检测试验:采用纸层析法检验发酵过程中乳酸的生成情况。展开剂:水∶苯甲醇∶正丁醇以1∶5∶5的量相混合,然后加1%的甲酸。显色剂:0.04%的溴酚蓝乙醇溶液,用0.1 mol/L的NaOH调pH至6.7。以2%的乳酸和不接种培养液样品为对照。显色后与对照比较,观察在对应位置是否出现黄色斑点,以确定是否有乳酸生成。其他鉴定方法依据参考文献[7]进行。其中碳水化合物试验采用配制好的商品细菌生化微量鉴定管,酸的产生可以利用预先加入到培养基的溴甲酚紫指示剂来断定。37℃恒温培养24 h后观察各管中液体颜色变化情况,当发酵产酸时,可使培养基由紫色变为黄色,为阳性,反之阴性。
2 结果与分析
2.1 藏灵菇发酵乳中菌株形态观察
显微观察藏灵菇发酵乳中酵母菌6 μm×10 μm、球菌直径0.6 μm、杆菌0.3 μm×5 μm 和0.4 μm×9 μm。
2.2 菌种的分离、纯化及形态学、生理生化特性研究[10]
由于分离的菌株在复原乳中保藏,只有球菌出现胨化现象,因此本文只对球菌的研究做一报道。
2.2.1 菌株分离 分离培养基平板上的球菌菌落生长情况及菌体革兰染色、镜检情况见表1。

表1 分离培养情况表Table1 The table for isolation and culture
在分离及纯化培养中,球菌在10%CO2浓度及有氧条件下均能正常生长。分离培养基中球菌菌落形态及菌体形态见图1及图2。
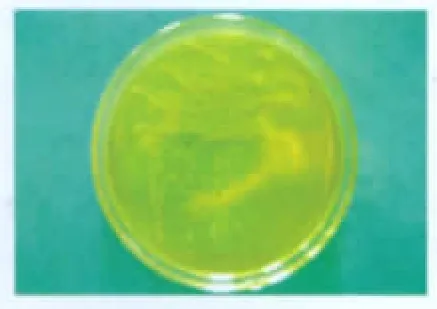
图1 分离培养基中球菌菌落形态Fig.1 Morphology of aureus colony in medium of isolation and culture
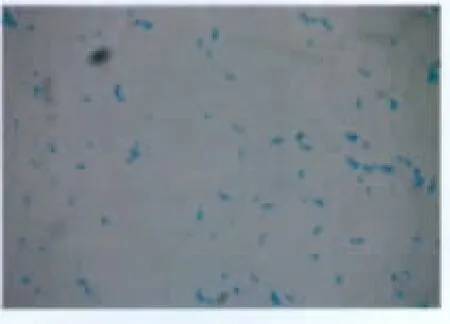
图2 菌体形态Fig.2 Morphology of thallus
2.2.2 乳酸菌的初步鉴定 将纯化后的球菌编号为RQ15,进行过氧化氢酶测定、石蕊牛乳培养试验及乳酸发酵试验。结果为过氧化氢酶阴性、乳酸发酵阳性、石蕊牛乳反应阳性。初步鉴定结果为自藏灵菇中分离的球菌为乳酸球菌。从实验看出,酸化MRS培养基一般情况可分离乳酸杆菌,本次分离时乳酸球菌生长,说明该球菌在较低pH下能生长,以后在该菌株的生长及发酵特性实验时再进一步研究。
2.2.3 乳酸球菌的生理生化特性研究 将纯化培养基上的RQ15单菌落转接入12%无菌复原脱脂乳中,37℃培养至凝乳,冰箱冷藏备用。RQ15在延时培养及在冷藏保存过程中出现胨化现象,蛋白被降解,见图3。从胨化现象分析,RQ15有产低温蛋白酶的可能,将进一步研究进行证实。

图3 RQ15脱脂乳培养物胨化现象Fig.3 Peptone phenomenon in defatted milk culture of RQ15
通过PYR阳性、过氧化氢酶测定、硫化氢的产生、吲哚试验、硝酸盐还原试验均为阴性,不能液化明胶、葡萄糖发酵不产气,并通过RQ15的培养特性试验,在10℃和45℃生长,60℃ 30 min、pH 9.6和6.5%NaCl中均生长,初步鉴定为肠球菌属(Enterococcus Thiercelin and Jouhaud)。通过碳水化合物发酵产酸试验结果,初步鉴定RQ15为粪肠球菌(Enterococcus faecalis)。碳水化合物发酵产酸试验结果见表2及图4。

表2 RQ15碳水化合物发酵产酸试验情况表Table2 The acids produced by the carbohydrate fermentation of RQ15
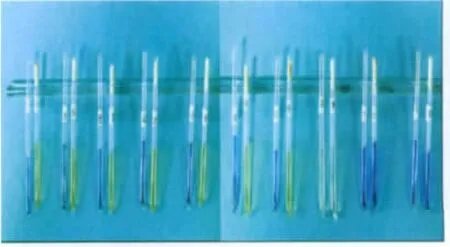
图4 RQ15的碳水化合物发酵试验Fig.4 Test of the carbohydrate fermentation of RQ15
2.2.4 粪肠球菌的生物学鉴定 通过宝生物工程(大连)有限公司对RQ15进行了分子生物学鉴定,结果为RQ15为粪肠球菌(Enterococcus faecalis),编号E.faecalisRQ15。E.faecalisRQ15的16S rRNA序列在 GenBank的检索号为GU373724,与之相近菌株中未见关于蛋白酶研究和应用的信息。通过对该菌株产酶进行纯化和酶学性质分析,证明了该菌株产酶具有低温蛋白酶的特征[5],另文报道。
3 讨论
藏灵菇富集了多种对人体有益的微生物,通过有氧与厌氧相结合的分离方式,利用分离乳酸菌检出率较高的3种培养基,从藏灵菇中分离到1株球菌RQ15。通过对分离到的RQ15进行形态学及生理生化特性研究,并通过分子生物学手段,鉴定RQ15为粪肠球菌。研究发现,E.faecalisRQ15在12%复原脱脂乳中延时培养及冷藏保存时,能使蛋白质降解,分析RQ15可能在不同温度范围内尤其是在低温下能产生蛋白酶。因此,后续的产酶及酶学性质研究中[5],证实了E.faecalisRQ15产低温中性蛋白酶的可能,SDS-PAGE测定该蛋白酶分子质量为32.4 ku,最适作用温度35~40℃,最适pH 7.5。20~40℃之间酶活较高,pH值耐受范围广泛,具有低温蛋白酶的特征。
低温蛋白酶具有反应温度低、对热敏感的特点,所以在饲用、食品、日用品和污水处理等方面有其他蛋白酶无法比拟的优势。粪肠球菌是人体肠道正常栖生菌,虽然目前国内还没有允许使用活菌体直接用于人体,但国外已有用于食品及保健品的先例,利用E.faecalisRQ15进行降解蛋白生产多肽类产品,灭活后作为普通食品或生产保健品、化妆品等,是可行的。因此,E.faecalisRQ15作为食源性菌株,所产的蛋白酶在饲料、食品、化妆品及酶制剂领域的开发应用有着较好的前景。
[1]李剑,周剑忠,孙宇辉,等.藏灵菇中有益微生物的分离与鉴定[J].江苏农业科学,2009,27(1):242-244.
[2]杨希娟,樊明涛,师俊玲,等.西藏灵菇发酵乳中优势菌群的分离鉴定[J].中国酿造,2007,(6):52-55.
[3]Diniz RO,Garla LK,Schneedorf JC,et al.Study of anti-inflammatory activity of Tibetan mushroom,a symbiotic culture of bacteria and fungi encapsulated into a polysaccharide matrix[J].Pharmacological Research,2003,47(1):49-52.
[4]陈杰,徐冲,孙翠焕,等.乳酸菌在食品工业中的应用现状及发展前景[J].微生物学杂志,2012,32(3):91-94.
[5]朱巍巍,李杨,朱万琴,等.Enterococcus faecalisRQ15产低温中性蛋白酶的纯化及酶学性质[J].食品科学,2011,32(11),239-242.
[6]Jonasd,Rosenbaum A,Weyrichs,et al.Enzyme-linked immunoassay for detection of PCR-amplified DNA of Legionellae in bronchoavedar fluid[J].JClin Microbiol,1995,33(5):1247-1257.
[7]凌代文.乳酸细菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999.
[8]R.E.布坎南.伯杰细菌鉴定手册(第八版)[M].北京:科学出版社,1984.
[9]张刚.乳酸细菌—基础、技术和应用[M].北京:化学工业出版社,2007.
[10]史国英,余功明,胡春锦.广西传统发酵米粉中乳酸菌的分离鉴定[J].微生物学杂志,2012,32(5):54-57.
