肝肠钙粘连蛋白对人肝癌细胞株Hep3B生长的影响
2013-07-21郑州大学第一附属医院肝胆外科郑州450052范正军薛建峰刘艳杰
郑州大学第一附属医院肝胆外科(郑州450052) 范正军 彭 飞 薛建峰 程 波 刘艳杰
目前国内外对原发性肝癌(PLC)的发病机制的研究涉及多发面、多层次的内容,从分子生物学水平来说,其发生、发展、侵袭和转移与多基因突变、细胞信号转导通路和异常新生血管增生等密切相关。已有学者研究指出肝肠钙粘连蛋白(LI-cadherin)与肝癌细胞的生长、转移和侵袭性相关,但具体机制尚未阐明[1],本文应用si RNA干扰技术下调人肝细胞肝癌细胞株Hep3B中 LI-cadherin的表达,研究 LI-cadherin对人肝癌细胞增值的影响,并初步探讨其机制。
材料与方法
1 材 料 Hep3B人肝癌细胞株购自于上海汉博生物科技有限公司,脂质体Lipofectamine T M,2000、TRIzol试剂盒购自于美国Invitr ogen公司,氨苄青霉素、RPMI1640培养基、溴化乙锭(EB)、胰酶细胞消化液、DNA Ladder Mar ker购自于大连宝生物工程有限公司,胶回收试剂盒、10%胎牛血清(FBS)、G418购自于GIBCO公司,低熔点琼脂糖粉购自于英国Oxoid公司,LI-cadherin Si RNA(sc-43014)、Contr ol Si RNA(sc-37007)、Wester n blotting 检测试剂盒购自于美国Santa公司,二甲基亚砜(DMSO)、四甲基偶氮哇盐(MTT)购自于美国Sig ma公司,蛋白提取试剂盒、蛋白提取缓冲液购自于北京天恩泽基因科技有限公司。LB培养基、RPMI-1640细胞培养液、50×(Tris-AC)电泳缓冲液(TAE)、琼脂糖电泳凝胶、100μg/ml氨苄青霉素、MTT溶液、PI染液、0.25%胰蛋白酶消化液、Transfer buffer for wester n bl otting(1000 ml),所有实验试剂均严格按照说明书仔细配置。
2 方 法 ①细胞培养及LI-cadherin转染:将Hep3B细胞于37℃含10%PBS的培养液中解冻,加入10 ml RPM-1640培养液制成细胞悬液,于37℃含5%CO2孵箱培养、10 ml含10%胎牛血清但不含抗生素的培养液培养,胰蛋白酶液消化传代,取对数生长期细胞为实验对象。si RNAs转染用 Lipofectamine T M2000脂质体并严格按照操作说明书的转染条件及步骤进行细胞基因转染,72h后收获细胞进行检测和实验。按照转染内容的不同进行细胞分组,即LI-cadherin转染组:转染LI-cadherin特异性Si RNA;阴性对照组:加入等量的转染试剂并转染同浓度的非干扰si RNA;空白对照组:常规培养的人肝癌细胞株Hep3B。②实验组LI-cadherin及Cyclin D1蛋白表达的变化:采用 Western-blotting法检测各实验组LI-cadherin及Cyclin D1蛋白表达的变化情况。各组蛋白样品提取后,根据待测的蛋白分子量的不同分别灌以不同浓度的的积层胶和分离胶,按照 Western-blotting法实验步骤严格操作。③LI-cadherin对肝癌细胞Hep3B生长的作用:利用 MTT法重复三次分别检测Li-cadherin-Si RNA转染组细胞、阴性对照及空白对照组在490nm波长下细胞第12h、24h、36h、48h、72h及96h 6个时间点的光吸收值(OD值),并记录结果进行统计学分析,最后以时间作为横轴,光吸收值为纵轴绘制各组细胞的生长曲线。④检测各实验组细胞周期:将瞬时转染后72h正处于对数生长期的3组细胞分别以1×106接种到6孔板,每组细胞接种3孔,长至80%汇合度,弃去培养液,用3 ml PBS缓冲液小心洗涤两次,0.25%胰蛋白酶-EDTA消化液消化后制成细胞悬液,加入PI(100μg/ml)和5μl Rnase,37℃恒温箱内静置30 min,使用美国BD公司Epics-XLⅡ型流式细胞仪(FCM),通过FSC/SSC散点图收集10000个细胞,采用设门技术排除粘连细胞和细胞碎片,由Cellquest软件分析G0/G1,S,G2/M期细胞含量百分比,并分析细胞的增殖指数:PI[14]=(S+G2/M)/(G0/G1+S+G2/M)×100%。
结 果
1 转染Si RNA后转染效率观察 利用荧光倒置显微镜分别观察三组细胞,发现转染入Si RNA后的Hep3B细胞中可见清晰的荧光,说明转染成功。计算视野内发出荧光的细胞占全部细胞的85%,即转染效率为85%,符合本实验的基本条件。见图1。

图1 LI-cadherin-Si RNA转染 Hep3B细胞的效率
2 转染Si RNA后LI-cadherin与细胞周期蛋白D1(Cyclin D1)的表达 转染后普通培养72h,通过Wester n-blotting检测发现空白对照组、空质粒转染组的LI-cadherin的蛋白表达率无明显差异(P>0.05),Si RNA转染组LI-cadherin的表达均低于空白对照组、空质粒转染组,说明LI-cadherin抑制有效;Si RNA转染组与空白对照组、空质粒转染组相比,Cyclin D1蛋白表达明显升高。见图2。

图2 Si RNA转染Hep3B细胞后LI-cadherin及Cyclin D1的表达
3 LI-cadherin对肝癌细胞生长的作用 见表1。通过MTT方法分别检测6个时间点发现,Si RNA转染组在12h、24h、36h时阴性对照组和空白对照组细胞均开始了增值,转染组生长高于空白对照组和空质粒转染组,但是在统计学上无显著性差异(P>0.05),48h、72h、96h肝肠钙粘连蛋白Si RNA转染组细胞株生长明显加快,明显高于空质粒转染组和空白对照组,具有统计学意义(P<0.05)。见图3。

表1 LI-cadherin对肝癌细胞株Hep3B生长的作用(n=6)

图3 LI-cadherin对肝癌细胞生长的作用
4 流式细胞仪检测肝肠钙粘连蛋白对肝癌细胞周期的影响 见表2。Si RNA转染组 Hep3B-LI-cadherin-Si RNA细胞与空白对照组和空质粒转染组相比S期及G2/M期百分含量明显增多,G0/G1期百分含量明显减少,PI较高,差异均具有统计学意义(P<0.05);空白对照组和空质粒转染组相比各期细胞百分比及PI值变化不大,差异无统计学意义(P>0.05)。Si RNA转染组与空白对照组和空质粒转染组相比Cyclin D1蛋白的表达明显升高(P<0.05),而空白对照组和空质粒转染组Cyclin D1蛋白变化无明显差异(P>0.05)。此结果提示下调LI-cadherin的表达后,明显增加了Cyclin D1蛋白的表达,同时促进G1向S期转化,加快细胞的分裂、促进细胞增殖。
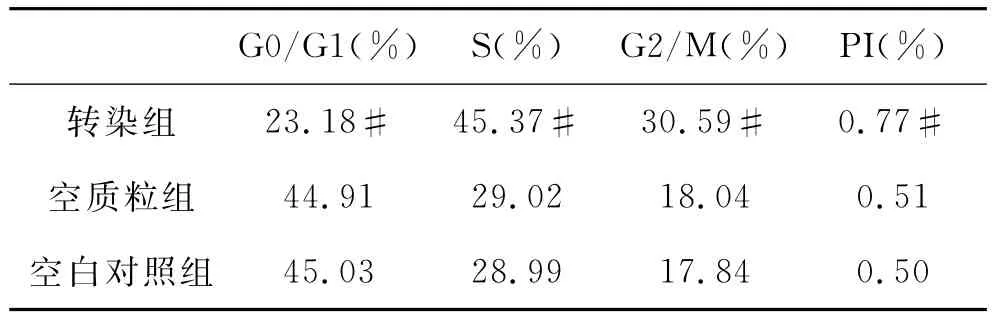
表2 CDH17对肝癌细胞周期的影响
讨 论
经典钙粘连蛋白的细胞质的钙连环部分由150个氨基酸残基组成,是一个基因序列高度稳定的保守区域,而肝肠钙粘连蛋白的细胞质的钙连环片段却仅由20个氨基酸残基组成,其基因结构上决定其是不稳定区域,同时发现LI-cadherin的细胞质肌动蛋白(actins)和钙粘连环蛋白(catenins)之间的相互作用表达受限和异常减少[2]。有研究表明,LI-cadherin在直肠癌、胃癌等多种上皮源性肿瘤组织及肿瘤组织周围有表达,并发现LI-cadherin与肿瘤细胞的生长、转移和侵袭性相关,范正军等[3]通过对56例直径不等的肝癌标本研究发现LI-cadherin与肝癌的直径呈现负相关关系,并表明LI-cadherin可抑制肝癌的生长,相反陈筱婷等[4]利用单克隆抗体技术沉默LI-cadherin基因的表达进而抑制了肝癌细胞株的增殖,在体外证明了LI-cadherin可促进肝癌的生长,但其未做相关机制研究,阐述不够充分。
目前已有研究证实,多种肿瘤中都存在Cyclin D1基因结构和功能异常,如肺癌[5-6]、食管癌[7]和肝癌[8-9]等,Cyclin D1在肿瘤的诊断、预后以及治疗方面的价值可观,已成为目前恶性肿瘤研究领域中的热点话题。本实验通过si RNA技术转染Hep3B并经蛋白免疫印迹检测LI-cadherin蛋白表达证明有效下调后,通过MTT法检测表明si RNA转染组细胞在12、24、36h与两个对照组相比无统计学意义,但是在第36h检测时已经发现转染组生长明显较快,在48h以后则表现出了明显的差异性,根据实验结果表明其可抑制肝癌细胞的生长。通过研究3组细胞在培养第72h表现出生长显著差异性时,利用流式细胞术检测细胞周期并通过DNA含量的不同计算各时相的比例发现,下调LI-cadherin表达的转染组G0/G1期占细胞周期含量分布的23.18%,较对照组低,S期占45.37%以及G2/M期占30.59%,均较对照组高,增值指数(P I)达77%也显著高于对照组,表明生长明显增快的Si RNA转染组生长分数较高,而对照组生长分数较低。通过对比各组细胞各细胞周期分布的不同,我们进一步在实验中检测调节G1/S期的细胞周期蛋白D1,发现转染组CCND1表达量明显高于对照组,因此我们推测,特异性沉默Hep3B细胞的LI-cadherin基因后,其生长速度增快,很可能是因为LI-cadherin基因的沉默刺激了CCND1基因的改变并过度表达,使G0期静止的激活进入S期,且缩短了G1期,加速进入S期,促进了肿瘤的快速生长,同时间接说明肝肠钙粘连蛋白可能通过细胞周期蛋白D1调控细胞周期而起到抑制肝癌细胞增殖的作用。
[1]范正军,房祥杰,王家祥,等.肝肠钙粘连蛋白对人肝癌细胞粘附和迁移的作用[J].中华实验外科杂志,2011,28(8):1396.
[2]Ueta T,Ikeguchi M,Hirooka Y,et al.Beta-catenin and cyclin D1 expression in hu man hepatocellular carcinoma[J].Oncol Rep,2002,9:1197-1203.
[3]范正军.肝肠钙粘连蛋白与肝细胞癌的关系及对粘附和侵袭作用的初步研究[D].郑州大学外科学,2011.
[4]陈筱婷,杜红延,原少斐,等.肝肠钙粘连蛋白单克隆抗体的制备及其对Hep G2的生长抑制作用[J].南方医科大学学报,2009,29(5):880-883.
[5]Hirsch FR,Witta S.Bio mar kers for prediction of sensitivity to EG2FR inhibitors in non-s mall cell lung cancer[J].Curr Op in Oncol,2005,17(2):118-122.
[6]Hirsch FR,Witta S.Bio mar kers for prediction of sensitivity to EG2FR inhibitors in non-s mall cell lung cancer[J].Curr Op in Oncol,2005,17(2):118-122.
[7]Donnellan R,Chetty R.Cyclin D1 and hu man neoplasia[J].Clin Pathol Mol Part,1998,51:127.
[8]黄光琳.肝癌血清标志物研究进展[J].陕西医学杂志,2010,39(12):1681-1682.
[9]Makdissi FB,Machado LV,Oliveira AG.Expression of E-cadherin,Snail and Hakai in epit helial cells isolated fro m the pri mary tu mor and fr o m perit u moral tissue of invasive ductal breast carcino mas[J].Braz J Med Biol Res,2009,42(12):1128-1137.
