兔自体脂肪来源干细胞对增生性瘢痕的作用研究
2013-07-19卞媛媛梁久龙刘晓燕
卞媛媛,梁久龙,韩 悦,刘晓燕
瘢痕是皮肤组织创伤修复后的必然产物,其发生机制尚不清楚,组织学上以成纤维细胞过度增生和细胞外基质的过度聚集为特征[1]。增生性瘢痕是创伤后修复异常的一种表现,属于一种病理性瘢痕。增厚的瘢痕组织不仅严重影响外观,且后期常发生挛缩,导致组织器官移位变形,位于关节功能部位时常出现功能障碍[2]。目前常用的治疗方法有:手术切除、持续加压疗法、放射疗法、冷冻疗法、激光疗法、硅凝胶片敷贴法、药物治疗、生长因子相关药物、基因疗法[3]。亦可多种疗法联合使用,但效果并不理想。
Morris 等[4]在对兔耳创面研究过程中发现,在兔耳的急性、慢性创面上可以发生类似人类增生性瘢痕样的改变。李荟元等[5]经过对数十只日本大耳白兔双耳近400 个创面的观察,开展了建立增生性瘢痕动物实验模型的系列研究,探索兔耳在不同创伤条件下形成的增生与人类增生性瘢痕的相似性,并探讨其成为增生性瘢痕动物模型的可能性。
2001 年Zuk 等[6]首次从人抽脂术中抽取的脂肪组织悬液中分离获得了多向分化干细胞。脂肪来源干细胞(ASCs)是脂肪组织中的一种“半成品” 细胞[7],具有一般干细胞的特点,可以自我更新繁殖,同时也可以分化成各种各样的祖细胞,后者又可进一步成熟发展成许多有特定功能的细胞系。ASCs 所具有的修复、替代和再生的能力也为临床医学提供了一个发展新疗法的机会[8]。
1 材料和方法
1.1 材料
1.1.1 实验材料 健康雄性新西兰大耳白兔12 只(沈阳军区总医院动物实验中心提供),体重2 ~2.5 kg,平均月龄4 个月。
1.1.2 主要试剂和仪器 Ⅰ型胶原酶(Invitrogen 公司),胰蛋白酶(HyClone 公司),DMEM 培养基(HyClone 公司),标准胎牛血清(HyClone 公司),钙盐染色试剂盒(福州迈新生物技术开发有限公司),油红O 染色试剂盒(福州迈新生物技术开发有限公司)。二氧化碳孵箱(日本Sanyo 公司),实验数码摄像显微镜(日本Olympus 公司),超净工作台(香港 Heal Force 公司)。
1.2 实验方法
1.2.1 ASCs 的提取、原代培养和传代[9]取大耳白兔称重,速麻安(0.1 ml/kg)肌内注射,待麻醉满意后于兔左侧腹股沟处皮肤备皮,切开约3 cm 切口,结扎出血点,暴露脂肪垫。用眼科剪剪下脂肪,去除外包膜和明显的结缔组织,剔除血管,用含抗生素的PBS 冲洗,将脂肪装于无菌离心管中,剪碎脂肪,加入1 mg/ml Ⅰ型胶原酶10 ml 消化,37 ℃摇床45 min,见脂肪被消化,离心管内液体呈黏稠状,1 000 r/min 离心10 min,弃上层液体,加入培养液(含100 ml/L 胎牛血清的低糖DMEM 培养基),摇匀,200 目纱网过滤,滤液装入培养皿。含10%胎牛血清DMEM 的培养液,10 万U/L 青霉素。37 ℃、5%饱和水气二氧化碳培养箱中培养。每3 d 换液1 次。传代:吸出培养液,用PBS 漂洗细胞1 次,加入0.25%胰酶1 ml,二氧化碳培养箱内3 ~5 min 使细胞脱离培养皿,加入新鲜培养液,终止消化,反复吹打,使细胞悬浮按1∶3 传代率进行传代。
1.2.2 瘢痕模型建立 设白兔左耳为实验组,右耳为对照组。于兔耳腹侧设计直径为1 cm 的圆形术区,每只兔耳共设计4 个圆形缺损,每个缺损之间间隔距离为2 cm 左右。先用美蓝设计直径1 cm 的圆形术区,然后于术区周围注射生理盐水,层次为软骨膜上层,然后用手术刀沿术区切开至软骨上层次,提起皮肤,用眼科剪锐性分离,剔除皮肤及皮下组织,暴露软骨,并剔除软骨膜,彻底止血,油纱保护创面。
1.2.3 ASCs 鉴定 ①ASCs 诱导成脂:取生长状态良好的第3 代ASCs,向细胞培养皿中置入无菌载玻片,2 d 后镜下观察细胞爬满载玻片,倒去培养液,PBS 冲洗,缓慢加入诱导培养基(10%FBS、胰岛素10 μmol/L、地塞米松1 μmmol/L 、吲哚美辛200 μmol/L 及异丁基甲基黄嘌呤0.5 mmol/L),每隔2 d全量更换诱导培养液,诱导第6 天后按半量换液,定向分化诱导2 周后进行油红O 染色。②另取生长状态良好的第3 代ASCs,向细胞培养皿中置入无菌载玻片,2 d 后镜下观察细胞爬满载玻片,倒去培养液,PBS 冲洗,改用向成骨细胞分化的诱导培养基定向诱导(含10%FBS、地塞米松0.1 μmol/L、抗坏血酸50 μmol/L和β-甘油磷酸钠10 mmol/L),2 ~3 d 更换1 次诱导培养基,定向诱导3 周后行钙盐染色定性观察。
1.2.4 ASCs 注射 采用已经培养的并生长活跃的兔ASCs(浓度5×106/ml),于1、7、20 d 对实验组兔耳增生性瘢痕呈环形注射兔自体ASCs(最好在软骨上层次注射),每个圆形创面注射0.2 ml,对照组注射同样剂量的生理盐水,于增生最显著的第35 d 切除两耳增生性瘢痕,行甲醛固定,石蜡包埋、切片、染色。1.2.5 统计学方法 对数据采用配对t 检验及方差分析进行统计学处理。
2 结果
2.1 干细胞鉴定结果
诱导成脂14 d,可见圆形或多边由小脂滴聚集的脂泡,脂滴为橙红色(图1a),诱导成骨21 d,骨中钙质呈黑褐色(图1b)。
2.2 大体观察
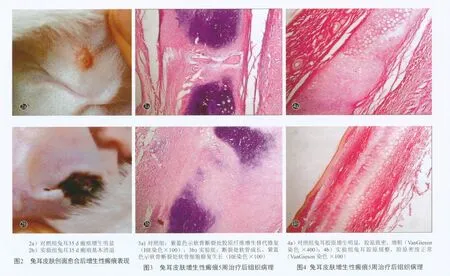
1 ~2 周兔耳皮肤创面愈合早期增生性瘢痕表现为明显可触及的圆形凸起斑块,质硬,色红。5 周时对照组兔耳瘢痕呈现明显的增生状态(图2a),实验组兔耳瘢痕则萎缩平软,色泽接近正常(图2b)。
2.3 光镜下观察
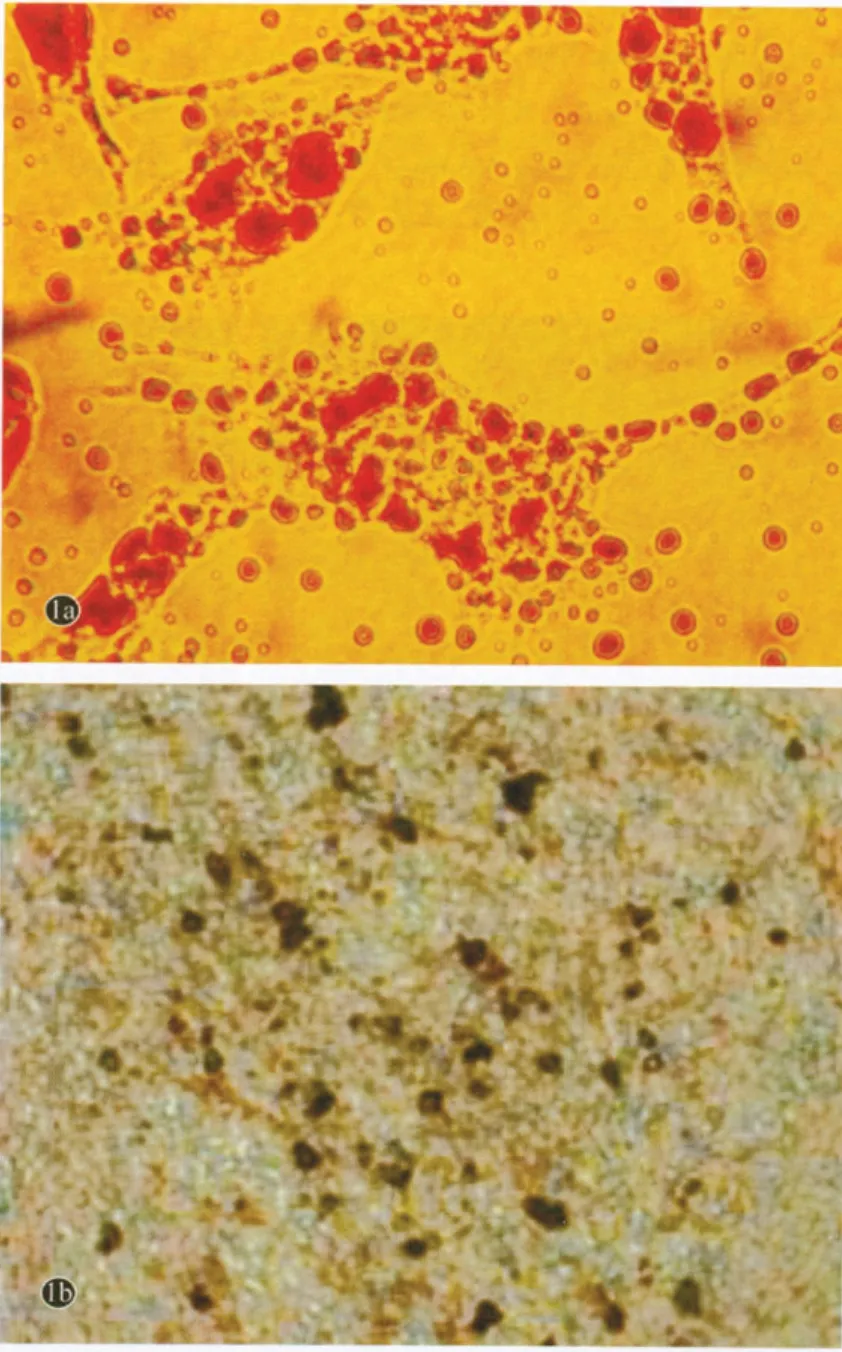
图1 兔自体ASCs鉴定结果
经5 周治疗后,苏木精-伊红(HE)染色切片可见实验组与对照组增生的肉芽组织均厚于周边正常皮肤,斑块内有大量的成纤维细胞、细胞外基质和毛细血管,浅部可见环形或螺旋样分布,深部与软骨平行排列。组织内有少量炎性细胞浸润,部分切片可见软骨修复生长(图3);对照组早期真皮乳头层消失,有胶原沉积,真皮浅层胶原纤维呈结节或旋涡状排列;后期真皮以胶原纤维聚集为主,呈杂乱无序的堆积,其间未见明显毛囊、汗腺等皮肤附属器的结构;VanGieson染色切片两组胶原均染成红色,对照组真皮层中有大量排列无序的成纤维细胞,细胞核深染,大量胶原沉积,呈结节或旋涡状,间质中可见增生的毛细血管及炎性细胞浸润,实验组胶原形态纤细,排列比较规则,漩涡结构及炎性细胞浸润不明显(图4)。
2.4 瘢痕增生指数、成纤维细胞密度和胶原纤维面密度比较
瘢痕增生指数(HI)计算:HI=A/B(A:低倍镜下用显微镜测量尺测量增生的瘢痕厚度,B:周围正常皮肤厚度);成纤维细胞密度(NA)计算:400倍光镜下观察HE、VanGieson 染色切片,在瘢痕中央浅部、中央深部、两侧部各随机选取10 个矩形视野,目测计数并计算切片内单位面积成纤维细胞的数量,结果取均数;胶原纤维面密度(AA)计算:观察VanGieson 染色组织切片,在瘢痕中央浅部、深部、两侧部各随机选取10 个视野,利用计算机辅助病理图像分析系统计算红染胶原的面密度,结果取均数。经方差分析,2 组间瘢痕增生指数,成纤维细胞密度和胶原纤维面密度均数不完全相等(P <0.05),实验组显著低于对照组(P <0.01)(表1)。
3 讨论
近年来,有研究发现人体脂肪组织提取物中存在一些类似于骨髓基质干细胞的细胞,其具有向多种组织分化的潜能,并称之为脂肪干细胞[9]。它在体外培养扩增迅速,目前已证实此种干细胞可分化为成骨细胞、软骨细胞、肌源性细胞等多种组织细胞,是组织工程重要的种子细胞之一[10,11]。
表1 两组瘢痕增生指数、成纤维细胞密度和胶原面密度比较(±s)
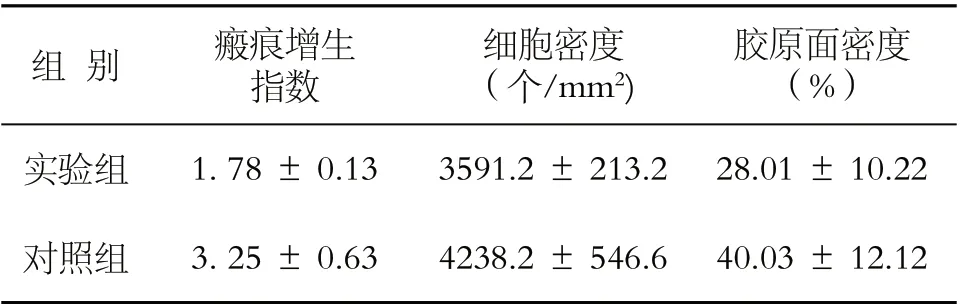
表1 两组瘢痕增生指数、成纤维细胞密度和胶原面密度比较(±s)
胶原面密度(%)实验组1. 78 ± 0.133591.2 ± 213.2 28.01 ± 10.22对照组3. 25 ± 0.634238.2 ± 546.6 40.03 ± 12.12组 别瘢痕增生指数细胞密度(个/mm2)
成体干细胞的可塑性是目前临床治疗性应用的基础,但一直备受争议。特别是2002 年Nature 杂志发表了Terada 和Ying 等将标记有绿色荧光蛋白(GFP)的骨髓间充质干细胞(MSC)与胚胎干细胞(ES)进行共培养,观察到形成GFP+ES 样细胞后,这种争论与质疑便进一步受到人们的关注,并引发了相关论战。但在争论的背后,临床的某些领域,如心血管、中枢神经系统、下肢缺血性疾病治疗等,已在利用这一特性进行相关的治疗研究,且有报道已取得了喜人的治疗效果。在皮肤烧创伤领域,利用成体干细胞的可塑性进行的治疗性研究主要集中在诱导皮肤表皮干细胞以及应用MSC 重建汗腺、皮脂腺以及毛囊等方面,最终达到减少瘢痕形成和实现皮肤功能性修复的目的[12]。
本实验对6 只雄性大白兔进行了脂肪来源干细胞的提取和培养,并成功诱导分化成脂和成骨。我们又根据李荟元等的方法在12 只兔的24 只兔耳上成功建立了96 个兔耳增生性瘢痕模型。利用提取的生长良好的第3 代干细胞对瘢痕进行研究性应用治疗,最后于实验增生最显著的第35 天切除两耳增生性瘢痕,并行甲醛固定,石蜡包埋、切片、染色。通过一系列观察我们发现,局部注射自体ASCs 能减轻兔耳瘢痕的增生程度,使其变软、变平。经过测量与计算,瘢痕增生指数显著下降,瘢痕体积缩小。我们认为这可能与干细胞可以进行诱导分化,进而为修复各种组织缺损提供精确指导,真正是“缺什么就补什么”,为临床治疗瘢痕提供了一个新视角,新方法。
[1] 徐阳成, 罗成群. 烧伤瘢痕的形成机制与防治 [J]. 中国烧伤创疡杂志, 2003, 15(4):354-357.
[2] Niessen FB, Spauwen PH, Schalkwijk J, et al. On the nature of hypertrophic scars and keloids: a review [J]. Plast Reconstr Surg, 1999, 104(5):1435-1458.
[3] Kischer CW, Thies AC, Chvapil M. Perivascular myofibroblasts and microvascular occlusion in hypertrophic scars and keloids [J]. Hum Pathol, 1982, 13(9):819-824.
[4] Morris DE, Wu L, Zhao LL, et al. Acute and chronic animal models for excessive dermal scarring: quantitative studies [J].Plast Reconstr Surg, 1997, 100(3):674-681.
[5] 李荟元, 刘建波, 兰海. 建立增生性瘢痕动物模型 [J]. 第四军医大学学报, 1998, 19(6):655-657.
[6] Zuk PA, Zhu M, Mizuno H, et al. Multilineage cells from human adipose tissue: implications for cell-based therapies [J]. Tissue Eng, 2001, 7(2):2ll-228.
[7] 牟洪善, 李金萍, 王昌留. 脂肪干细胞研究近况 [J]. 生命科学仪器, 2006, 4(3):22-24.
[8] Sondell M, Lundborg G, Kanje M. Regeneration of the rat sciatic nerve into allografts made acellular through chemical extraction [J]. Brain Res, 1998, 795(1-2):44-54.
[9] Bain JR, Machinnon SE, Hunter DA. Functional evaluation of complete sciatic, peroneal, and posterior tibial nerve lesions in the rat [J]. Plast Reconstr Surg, 1989, 83(1):129-138.
[10] Sen A, Lea-Currie YR, Sujkowska D, et al. Adipogenic potential of human adipose derived stromal cells from multiple donors is heterogeneous [J]. J Cell Biochem, 2001, 81(2):312-319.
[11] Katz AJ, Llull R, Hedrick MH, et al. Emerging approaches to the tissue engineering of fat [J]. Clin Plast Surg, 1999, 26(4): 587-603.
[12] 方利君, 付小兵, 孙同柱, 等. 在体外诱导充质干细胞分化为表皮细胞的初步观察 [J]. 中华创伤杂志, 2003, 19(4):212-214.
