钴(Ⅱ)对纤维蛋白原硝化损伤及活性的影响研究
2013-07-18罗云敬史建龙徐世奎
丁 杨,罗云敬,史建龙,徐世奎
(北京工业大学,北京100124)
钴(Ⅱ)对纤维蛋白原硝化损伤及活性的影响研究
丁 杨,罗云敬,史建龙,徐世奎
(北京工业大学,北京100124)
以纤维蛋白原为研究对象,运用紫外分光光度法、三维荧光光谱法、SDS-PAGE和Von-Clauss法研究了Co (Ⅱ)参与过氧亚硝酸根(ONOO-)介导的纤维蛋白原硝化反应过程。结果表明,Co(Ⅱ)对ONOO-硝化损伤纤维蛋白原存在明显的促进作用,并加剧了硝化损伤后纤维蛋白原凝聚活性的下降。
过氧亚硝酸根;纤维蛋白原;Von-Clauss法;钴(Ⅱ)
纤维蛋白原(Fibrinogen,Fg)是一种可溶于水的糖蛋白,每个纤维蛋白原分子由3对非等同的多肽链Aα、Bβ和γ构成[1,2],易被氧化硝化,它的损伤可导致体内的血粘度升高,血小板聚集性增强,冠状动脉血栓发生率增加,促进冠状动脉粥样硬化[3-5]。过氧亚硝酸根离子(ONOO-)具有很强的硝化和氧化能力,可以在生理或病理条件下,对蛋白质进行翻译后修饰[6]。这种修饰可造成蛋白质的硝化进而导致变性,产生一系列的细胞毒性作用,最终可能引发疾病,如心血管疾病、帕金森症等等[7,8]。钴是生物体内存在的重要且必需的微量金属元素,能刺激人体骨髓的造血系统,并与心血管疾病有着一定的联系。有报道表明钴可以催化芳香类化合物的硝化[9,10]。鉴于钴元素的重要生物功能,作者对Co(Ⅱ)参与的ONOO-硝化损伤纤维蛋白原残基过程进行了研究并对硝化损伤后纤维蛋白原的生物活性进行了评价,对于揭示ONOO-的生理作用机制,了解相关疾病的发病机理并进行预防和治疗有着重要意义。
1 实验
1.1 试剂与仪器
纤维蛋白原、凝血酶,美国Sigma公司。ONOO-溶液按照1995年Uppu等[11]提出的两相反应体系过氧化氢与亚硝酸异戊酯的取代反应制备。每次实验前用紫外可见分光光度计在302 nm处测定ONOO-的吸光度,根据ε302=1670 L·mol-1·cm-1计算ONOO-浓度。实验用水为二次去离子水,其它常用试剂均为分析纯或电泳级。
U3010型紫外可见分光光度计、F4500型荧光分光光度计,日本日立公司;DYY-12C型电泳仪,北京六一仪器厂。
1.2方法
1.2.1 紫外分光光度法
将纤维蛋白原溶于0.1 mol·L-1的PBS缓冲溶液(p H值7.4)中,37℃下孵育5 min。将ONOO-以0.018 mmol·L-1·min-1的恒定速率(ONOO-终浓度为0.53 mmol·L-1)注入到不断搅拌的纤维蛋白原溶液(1 mg·m L-1,37℃)中反应30 min。在反应体系中分别加入0μL、5μL、10μL、15μL、20μL、25μL浓度为10 mmol·L-1的CoCl2溶液[即反应体系中CoCl2终浓度(mmol·L-1)分别为0、0.017、0.03、0.05、0.067、0.083],反应前后体系p H值变化不超过0.1个p H单位。随后测定反应体系在360 nm处的紫外吸光度值(纤维蛋白原修饰产物3-NTyr在360 nm处有最大吸收ε=4400 L·mol-1· cm-1)。
1.2.2 三维荧光光谱法
在比色管中加入纤维蛋白原溶液,再分别加入0μL、5μL、10μL、15μL和20μL浓度为10 mmol· L-1的CoCl2溶液[即反应体系中CoCl2终浓度(mmol ·L-1)分别为0、0.017、0.03、0.05、0.067]。随后以0.018 mmol·L-1·min-1的速率向比色管中加入ONOO-至终浓度为0.53 mmol·L-1,恒温37℃下反应30 min。反应结束静置10 min后进行三维荧光分析。
1.2.3 SDS-PAGE电泳
将纤维蛋白原溶于0.1 mol·L-1的PBS缓冲溶液(p H值7.4)中,加入0μL、5μL、10μL、15μL、25μL和30μL 10 mmol·L-1的CoCl2溶液[即反应体系中CoCl2终浓度(mmol·L-1)分别为0、0.017、0.03、0.05、0.083、0.1],与ONOO-反应5 min,测硝化纤维蛋白原的电泳图。采用12%的分离胶和5%的浓缩胶,上样后,设置起始电压为100 V,待指示前沿到达分离胶后调节电压为120 V。当前沿指示距底端约1 cm时,切断电压。染色1 h,脱色至背景色完全消失。
1.2.4 Von-Clauss法
将凝血酶均匀溶于0.05 mol·L-1的CaCl2溶液中,使其活力为100 U·m L-1;37℃水箱孵育5 min后,以1∶1(体积比)的比例向纤维蛋白原的反应溶液中加入凝血酶,用Von-Clauss法检测其凝聚时间。具体如下:在加入凝血酶后,用带钩的小棒以每分钟1次的固定速度上下钩动溶液,当出现明显纤维丝和凝聚块时,记录时间,每个样品进行3组平行实验。
2 结果与讨论
2.1 紫外分光光度法检测Co(Ⅱ)对纤维蛋白原硝化损伤的作用(图1)
由图1可知,随着反应体系中CoCl2浓度由0逐渐增大到0.083 mmol·L-1,3-NTyr的生成量也不断增多,体系在360 nm处的紫外吸光度值由最初的1.067逐渐增大到1.764,增幅65.3%。表明Co(Ⅱ)促进了3-Ntyr的生成,即Co(Ⅱ)在ONOO-硝化损伤纤维蛋白原的反应中起到了正向的促进作用。
2.2 三维荧光法检测Co(Ⅱ)对纤维蛋白原硝化损伤的作用(图2)

图2 Co(Ⅱ)存在下ONOO-损伤纤维蛋白原的三维荧光光谱Fig.2 3D-Fluorescence spectra of fibrinogen treated by ONOO-in the presence of Co(Ⅱ)
蛋白质受激发能够产生荧光,其荧光值不仅决定于蛋白质本身,也与蛋白质所处微环境相关,二者的变化都能引起蛋白质荧光值的变化。由图2可知,1 mg ·m L-1的纤维蛋白原未硝化原液在Ex=280 nm、Em=340 nm左右有较强的荧光峰,峰值为1035,在Ex= 270 nm、Em=320 nm左右有一较弱的荧光峰,峰值为762。初步判断这两个峰分别为色氨酸和酪氨酸。随着反应体系中Co(Ⅱ)浓度的逐渐增大,两个荧光峰峰值呈现连续下降的趋势,当Co(Ⅱ)的浓度为0.067 mmol·L-1时,其荧光峰峰值为642和423,较纤维蛋白原原液分别下降了37.9%和44.5%。硝化损伤后纤维蛋白原荧光值的下降,是因为加入ONOO-后,使纤维蛋白原产生修饰产物3-NTyr、色氨酸发生硝化,改变了蛋白质所处的微环境,使得纤维蛋白原的荧光发生猝灭,荧光强度下降。在反应体系中加入Co (Ⅱ)并增大其浓度,促进了3-NTyr的生成并进一步改变纤维蛋白原所处微环境,使其荧光值持续下降。进一步验证了Co(Ⅱ)对于ONOO-硝化损伤纤维蛋白原起到促进作用,Co(Ⅱ)浓度越大,促进作用越明显,两者之间呈正相关。
2.3 SDS-PAGE检测Co(Ⅱ)对纤维蛋白原硝化损伤的作用(图3)
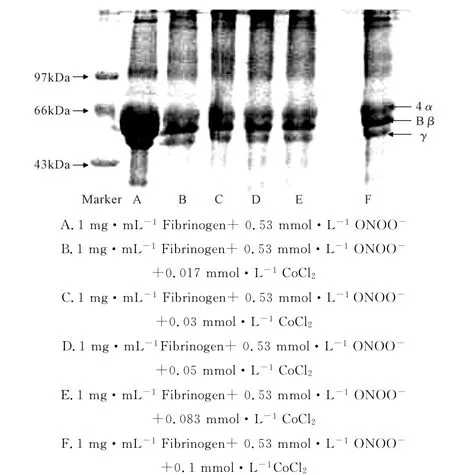
图3 Co(Ⅱ)存在下ONOO-损伤纤维蛋白原的SDS-PAGE图谱Fig.3 SDS-PAGE Electrophorogram of fibrinogen treated by ONOO-in the presence of Co(Ⅱ)
由图3可知,纤维蛋白原在电泳图上均出现了3条明显的条带,至上而下分别为纤维蛋白原Aα(66 k Da)、Bβ(52 k Da)和γ(46 k Da),相对于纤维蛋白原的原液来说,随着Co(Ⅱ)浓度的增大,肽链损伤明显,其中γ链最先变浅。表明Co(Ⅱ)的加入,加重了ONOO-对纤维蛋白原氨基酸的硝化损伤,使纤维蛋白原结构中γ链首先受损,α链次之受损。
2.4 Co(Ⅱ)对ONOO-损伤纤维蛋白原凝聚活性的影响
在反应体系中分别加入0μL、5μL、10μL、15μL、20μL、25μL、30μL的10 mmol·L-1CoCl2溶液,硝化后用Von-Clauss法检测纤维蛋白原凝聚活性,结果见图4。

图4 Co(Ⅱ)存在下ONOO-对纤维蛋白原凝聚活性的影响Fig.4 The clotting activity of fibrinogen treated by ONOO-in the presence of Co(Ⅱ)
由图4可知,纤维蛋白原凝集成丝的时间分别为9 s、11 s、13 s、15 s、17 s、20 s、22 s,成丝后再凝集成块的时间分别12 s、17 s、20 s、22 s、25 s、27 s、29 s。在硝化相同时间下,纤维蛋白原的凝聚活性随着Co(Ⅱ)添加量的增加而不断降低,当加入45μL时,能看到少许的细丝,但无法在凝血酶的作用下形成凝胶,失去了凝聚活性,而对照实验中Co(Ⅱ)本身并不能与纤维蛋白原发生作用。这表明,Co(Ⅱ)在ONOO-损伤纤维蛋白原的过程中表现出了促进作用,并且纤维蛋白原的凝聚活性与Co(Ⅱ)的添加量呈负相关。
3 结论
选用人体正常浓度范围内的Co(Ⅱ),较好地模拟了Co(Ⅱ)存在于体内时ONOO-损伤纤维蛋白原的情况。Co(Ⅱ)对纤维蛋白原的硝化损伤有催化作用,促进纤维蛋白原产生修饰产物3-NTyr,Co(Ⅱ)浓度与硝化损伤程度呈正相关;在Co(Ⅱ)的促进作用下, ONOO-首先损伤纤维蛋白原的γ链;随着反应时间的延长,纤维蛋白原的凝聚活性逐渐降低,并且在Co (Ⅱ)添加量达到一定程度时完全失去了凝聚能力。
[1] Birger B.Fibrinogen and fibrin-proteins with complex roles in hemostasis and thrombosis[J].Thromb Res,1996,83(1):1-75.
[2] Matsuda M.Structure and function of fibrinogen inferred from hereditary dysfibrinogens[J].Int J Hematol,2000,14(2):187-197.
[3] Ernst E.The role of fibrinogen as a cardiovascular risk factor[J]. Atherosclerosis,1993,100(1):1-12.
[4] Kosmas I P,Daryll M B,George E V,et al.The role of fibrinogenand fibrinolysis in peripheral arterial disease[J].Thromb Res, 2008,122(1):1-12.
[5] Sean P H,Ioannis P,Marina C,et al.Inflammation induces fibrinogen nitration in experimental human endotoxemia[J].Free Radical Bio Med,2009,47(8):1140-1146.
[6] Giuseppe L S,William A P.The formation of peroxynitrite in vivo from nitric oxide and superoxide[J].Chem-Biol Interact,1995,96 (2):203-206.
[7] Harry I.Biological tyrosine nitration:A pathophysiological function of nitric oxide and reactive oxygen species[J].Arch Biochem Biophys,1998,365(1):1-11.
[8] Gonzalo P,Rafael R.Biochemistry of protein tyrosine nitration in cardiovascular pathology[J].Cardiovasc Res,2007,75(2):291-301.
[9] Yurii V G,Alan J B,Jennifer J C,et al.Highly efficient and stable catalyst for peroxynitrite decomposition[J].Can J Chem,2001,79 (5-6):792-794.
[10] Zhang W,Luo Y J,Zhong R G,et al.Influence of metallic ions on tyrosine modification by peroxynitrite[J].Chinese J Inorg Chem, 2006,22(6):1113-1117.
[11] Uppu R M,Pryor W A.Synthesis of peroxynitrite in a two-phase system using isoamyl nitrite and hydrogen peroxide[J].Anal Biochem,1996,236(2):242-249.
Study on Influence of Co(Ⅱ)on Nitration Damage of Fibrinogen and Its Activity
DING Yang,LUO Yun-jing,SHI Jian-long,XU Shi-kui
(Beijing University of Technology,Beijing 100124,China)
Taking fibrinogen as the object,its nitration reaction process via ONOO-in the presence of Co (Ⅱ)was investigated through ultraviolet spectrometry,3D-fluorescence spectrum,SDS-PAGE and Von-Clauss method.The results showed that Co(Ⅱ)promoted remarkably the fibrinogen nitration damage by ONOO-, and enhanced the clotting activity decrease of the fibrinogen damaged.
peroxynitrite(ONOO-);fibrinogen;Von-Clauss method;Co(Ⅱ)
O 611.62 Q 51
A
1672-5425(2013)03-0017-04
10.3969/j.issn.1672-5425.2013.03.005
国家自然科学基金资助项目(20875006),北京市自然科学基金资助项目(2102005),北京市教委科技面上项目(KM201210005032)
2013-01-10
丁杨(1987-),男,湖北襄阳人,硕士研究生,研究方向:生物化学与分子生物学;通讯作者:罗云敬,教授,E-mail:luoyj@ bjut.edu.cn。
