Q强阴离子交换色谱快速纯化精氨酸激酶及其多克隆抗体的研究
2013-07-18吴继美李任强
陈 婷,吴继美,李任强
(暨南大学生物工程学系,广东广州510632)
陈 婷,吴继美,李任强
(暨南大学生物工程学系,广东广州510632)
利用QSepharoseTM-XL强阴离子交换色谱从虾的精氨酸激酶粗提液中纯化出精氨酸激酶,以其免疫大白兔,然后利用QSepharoseTM-XL强阴离子交换色谱从高免疫兔血清中纯化精氨酸激酶的多克隆抗体。采用SDS-PAGE检测精氨酸激酶及其抗体的纯度,并进行了活性测定。结果表明,利用QSepharoseTM-XL强阴离子交换色谱纯化出的精氨酸激酶及其多克隆抗体纯度高、活性强。建立了快速高效、操作方便而又适合实际应用的制备精氨酸激酶及其多克隆抗体的方法,可为精氨酸激酶及食品过敏的相关研究提供帮助。
QSepharoseTM-XL强阴离子交换色谱;精氨酸激酶;多克隆抗体;纯化
精氨酸激酶(ATP:精氨酸N-磷酸转移酶,EC 2.7.3.3.Argininekinase,AK)是磷酸原激酶家族的一员,对于调节无脊椎动物磷酸精氨酸与ATP之间能量的平衡具有重要作用[1],还与机体的病原识别、免疫反应等多种重要的生理过程密切相关[2-4]。近年来的一系列研究表明,AK在肌肉组织内大量表达[5],为甲壳类动物体内最重要的致敏原之一[6,7]。虽然目前对于AK的基因克隆表达、分子结构、催化特性等的研究较多[8],但直接从甲壳类动物中提取纯化AK的报道不多,且分离纯化方法普遍较繁杂、效率不高,如姚翠鸾等[9]采用CM-纤维素批量层析、SephadexG-100柱层析、DEAE-纤维素柱层析等多个步骤从凡纳滨对虾中分离纯化AK。因此,若能快速高效地直接从动物组织中纯化出AK,对于开展AK的研究是相当有实用意义的。
作者利用QSepharoseTM-XL强阴离子交换色谱[10]分离纯化AK,同时,针对AK是过敏原,用纯化了的AK进行动物免疫,并采用QSepharoseTM-XL强阴离子交换色谱对AK多克隆抗体进行纯化,从而建立了一种成本低、快速有效的制备AK多克隆抗体的方法。为海产品食物中基于AK过敏的相关检测研究奠定了基础。
1 实验
1.1 材料与试剂
新西兰大白兔,暨南大学实验动物中心;刀额新对虾(基围虾)购于广州石牌市场。
QSepharoseTM-XL树脂,GEHealthcareBio-SciencesAB;辣根过氧化物酶(HRP)标记的山羊抗兔IgG、脱脂奶粉、苯甲基磺酰氟(PMSF)、完全弗氏佐剂、不完全弗氏佐剂,Sigma公司;三羟甲基氨基甲烷(Tris),广州健阳生物科技有限公司;其它试剂均为分析纯或化学纯,广州化学有限公司。
1.2 AK的纯化与活性检测
1.2.1 AK粗提液的制备
根据Yu等[11]的方法作少量改进。所有操作均在4℃下进行。
取新鲜虾肉,加入预冷的缓冲溶液A(0.1mol· L-1Tris-HCl、10mmol·L-1巯基乙醇、1mmol· L-1EDTA、5μmol·L-1NaN3、25μmol·L-1PMSF,pH值8.0),用组织捣碎机磨成匀浆;继续加缓冲溶液A至5倍体积,抽提16h,12000r·min-1离心20min,收集上清液;上清液加硫酸铵至饱和度70%,静置2h,12000r·min-1离心20min,取上清;继续加硫酸铵至饱和度达90%,静置2h,12000r·min-1离心20 min,取沉淀;用缓冲溶液B(10 mmol· L-1Tris-HCl、10 mmol·L-1巯基乙醇、0.1 mmol· L-1EDTA,p H值8.0)溶解,继续用缓冲溶液B透析,得AK粗提液。
1.2.2 AK的纯化
取Q SepharoseTM-XL强阴离子交换树脂进行溶胀、洗涤、抽气等处理后装柱(20 cm×1.5 cm),连接好洗脱检测仪(以280 nm处的光吸收值OD280监测洗脱液),以0.5 m L·min-1流速用平衡缓冲溶液(0.02 mol·L-1Tris-HCl,p H值8.0)平衡柱子8 h以上;取5 m L AK粗提液,用平衡缓冲溶液稀释10倍,以0.5 m L·min-1流速上样至已平衡好的Q SepharoseTM-XL色谱柱,继续用平衡缓冲溶液洗脱使洗脱液的OD280至基线后(趋于0),用0.1~1 mol·L-1的NaCl溶液以0.5 m L·min-1的流速进行梯度洗脱,收集各洗脱峰;将各洗脱组分用平衡缓冲溶液透析后,真空冷冻干燥浓缩,采用还原性SDS-PAGE进行纯度鉴定和分子量测定。
1.2.3 AK活性的检测
AK活性的检测采用改进的p H值比色法[12],在25℃下进行。反应液体系包括:2 mmol·L-1ATP, 10 mmol·L-1精氨酸,复合酸碱指示剂(0.15%麝香草酚蓝+0.025%甲酚红),50 mmol·L-1乙酸镁, 50 mmol·L-1Tris-HCl,p H值8.0。取1 m L反应液于塑料比色杯中,加入10μL酶液(样液),迅速混合,测定1 min内575 nm处吸收值的减少值。
1个酶活力单位定义为:在上述条件下,1 min内AK催化磷酸精氨酸反应产生1μmol H+所需的酶量。
1.3 多克隆抗体血清的制备
将纯化的AK与完全弗氏佐剂等体积混合乳化,采用多点背部皮下注射方式对体重约3 kg的雌性新西兰大白兔进行免疫(500μg·只-1)[13]。共进行3次加强免疫后从兔耳动脉取血,采用间接酶联免疫吸附试验(ELISA)[14]检测动物体内产生的抗体滴度,当滴度符合要求后收集兔血清。
1.4 多克隆抗体的分离纯化与活性检测
参照文献[10]分别进行免疫和不免疫(阴性)血清中多克隆抗体的纯化。取1.0 m L收集到的血清,用0.02 mol·L-1p H值8.0的Tris-HCl缓冲溶液稀释至10 m L,以0.3 m L·min-1流速上样至已平衡好的Q SepharoseTM-XL强阴离子交换色谱柱,用平衡缓冲溶液继续过柱,收集在280 nm波长处有吸收值(OD280)的洗出液,当穿透峰的OD280降至基线时,用含0.05 mol·L-1NaCl的0.02 mol·L-1Tris-HCl缓冲溶液(p H值6.0)进行洗脱,收集洗脱峰;当OD280再次降至基线后,用1 mol·L-1NaCl溶液进行洗脱并收集洗脱峰。将各洗脱液用去离子水透析后,真空冷冻干燥浓缩,分别使用非还原性SDS-PAGE和还原性SDS-PAGE进行鉴定。非还原性电泳分离胶浓度为8%,浓缩胶浓度为4%;还原性电泳分离胶浓度为12%,浓缩胶浓度为4%。采用电泳分析系统对电泳图像进行分析。
用BCA蛋白浓度测定试剂盒测定各蛋白样品的浓度。抗原为AK,以兔阳性血清的抗体为实验组,兔阴性血清的抗体为对照组,通过间接ELISA检测已纯化的抗体的活性。
2 结果与讨论
2.1 AK的纯化与活性
Q SepharoseTH-XL强阴离子交换色谱柱用0.1~1 mol·L-1NaCl溶液梯度洗脱,得到2个明显的洗脱峰(图1中峰2、3),对峰2部分进行SDS-PAGE鉴定,结果如图2所示。
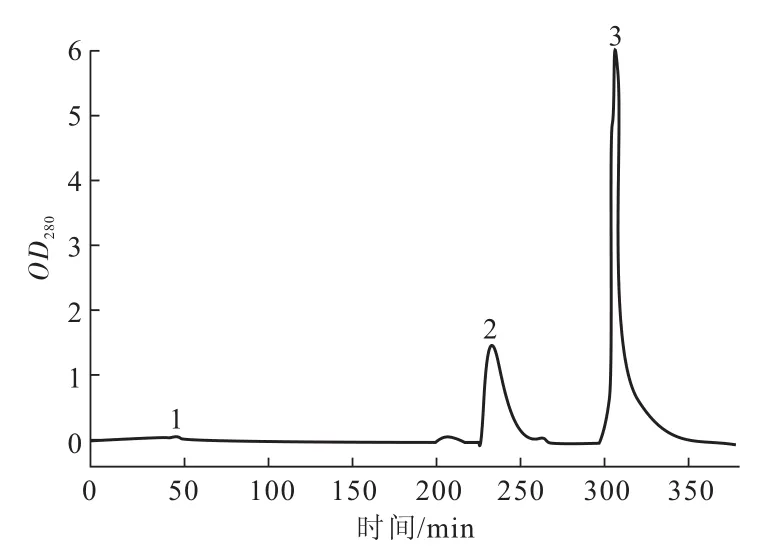
图1 Q SepharoseTM-XL强阴离子交换色谱分离精氨酸激酶的色谱图Fig.1 Elution profile of arginine kinase with Q SepharoseTM-XL strong anion exchange chromatography
色谱和电泳鉴定结果表明,AK粗提液中AK含量高,但杂蛋白也较多,它们都完全被吸附到Q SepharoseTM-XL色谱柱上。峰2部分虽有2条带,但主要蛋白相对分子质量约为40 ku,与AK的相对分子质量相当,电泳密度扫描显示其纯度大于95%。因此,色谱柱分离得到的洗脱峰2是AK,纯度高,达到了实验的要求。对峰2部分进行AK活性测定,其活力约为240 U·mg-1,具有正常的活力,进一步验证了其为AK。
2.2 Q SepharoseTM-XL色谱柱对血清中Ig(抗体)的分离纯化
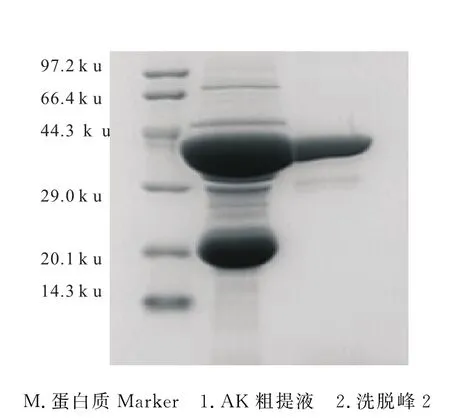
图2 精氨酸激酶的SDS-PAGE图谱Fig.2 SDS-PAGE Analysis of arginine kinase
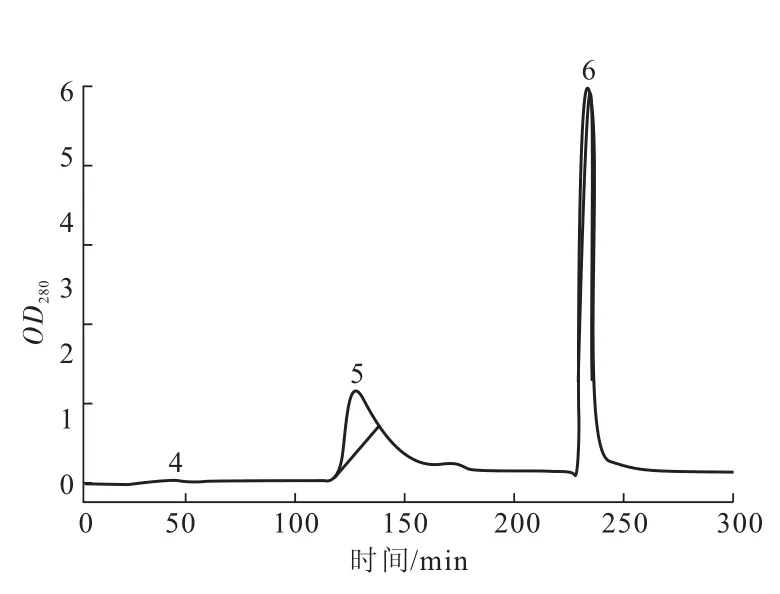
图3 Q SepharoseTM-XL强阴离子交换色谱分离精氨酸激酶多克隆抗体的色谱图Fig.3 Elution profile of arginine kinase polyclonal antibody with Q SepharoseTM-XL strong anion exchange chromatography
Q SepharoseTM-XL强阴离子交换色谱分离阳性样液得到的洗脱峰5(图3)部分经非还原性SDSPAGE检测其蛋白绝大部分为一条带(图4a,泳道2),经计算其相对分子质量约为150 ku,与相对分子质量为150 ku的Ig相当。同样纯化方法得到的阴性对照也与相对分子质量为150 ku的Ig相当(图4a,泳道4)。而在还原性SDS-PAGE中,该蛋白呈现2条带(图4b,泳道2与4),相对分子质量分别为50 ku和25 ku,与文献报道的Ig有一条重链和一条轻链的相对分子质量相符合[15],说明洗脱峰5为AK的多克隆抗体和阴性抗体,经电泳密度扫描分析,获得的抗体纯度在95%以上,纯度较高。
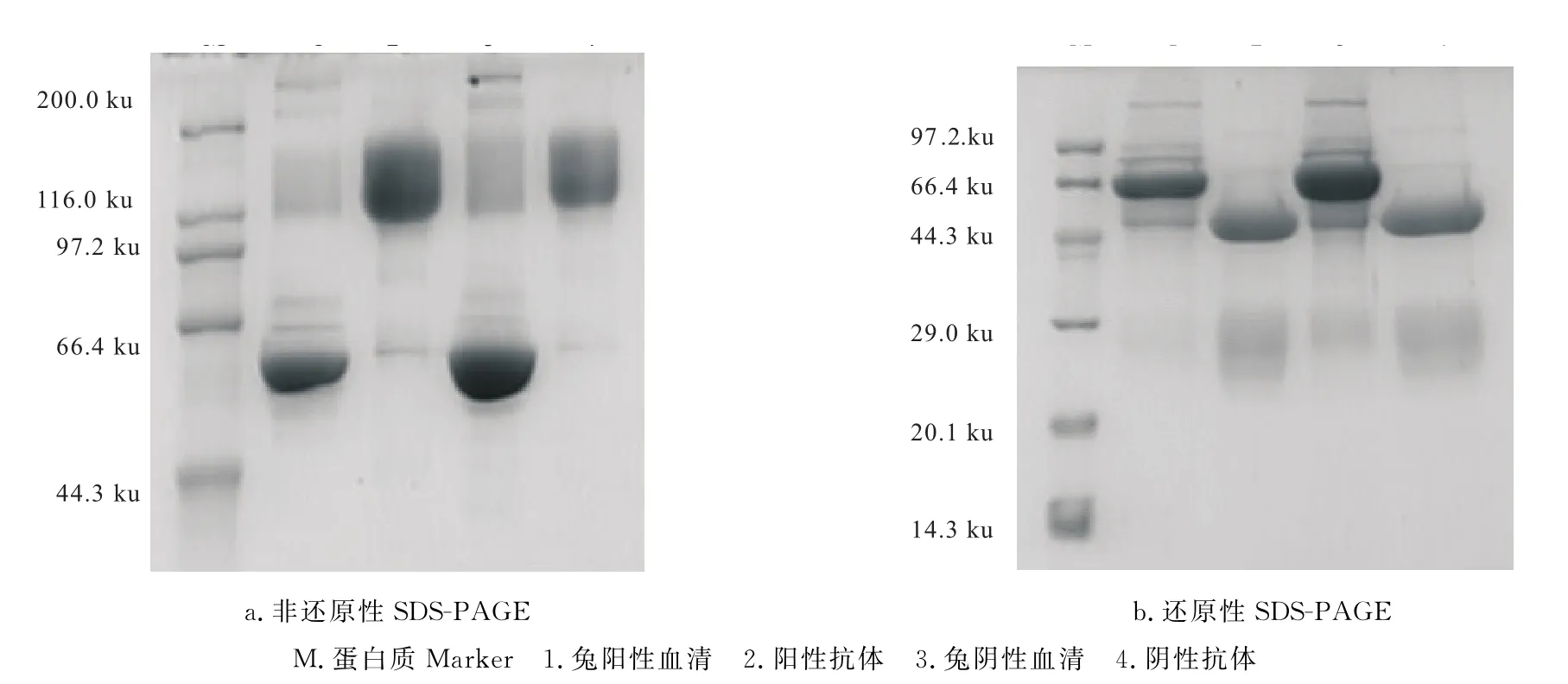
图4 血清抗体的SDS-PAGE图谱Fig.4 SDS-PAGE Analysis of serum antibody
2.3 间接ELISA检测Ig(抗体)的活性
为了证明所纯化出的目标物是AK抗体且具有正常活性,除了进行SDS-PAGE鉴定,还对目标物进行活性检测,结果见图5。
由图5可以看出,在实验组中,随着纯化阳性抗体浓度的增大,其对应的OD450逐渐增大,并呈线性关系,相关系数R2达0.994。而阴性对照组中,随着纯化阴性抗体浓度的增大,其对应的OD450一直维持在0.3,并与空白对照组(磷酸缓冲溶液)的OD450接近(数据未列出)。表明通过Q SepharoseTM-XL强阴离子交换色谱从阳性血清中纯化出的目标蛋白就是保持正常生物活性的AK多克隆抗体。
2.4 讨论
Q SepharoseTM-XL树脂是一种高容量强阴离子吸附剂,以琼脂糖凝胶Sepharose XL作为载体偶联葡聚糖链、强Q阴离子基团以醚键牢固结合于葡聚糖链上发挥作用。离子交换色谱是依赖于不同蛋白吸附于离子交换剂能力的不同[16]进行纯化的一种简单快捷的技术,具有交换容量大、重复利用率高[17]等优点。本实验证明,对于AK粗提液,利用Q SepharoseTMXL强阴离子交换色谱能一步纯化出高纯度的AK,建立了一种快速有效、操作相对简单的直接从生物组织中分离纯化AK的方法。
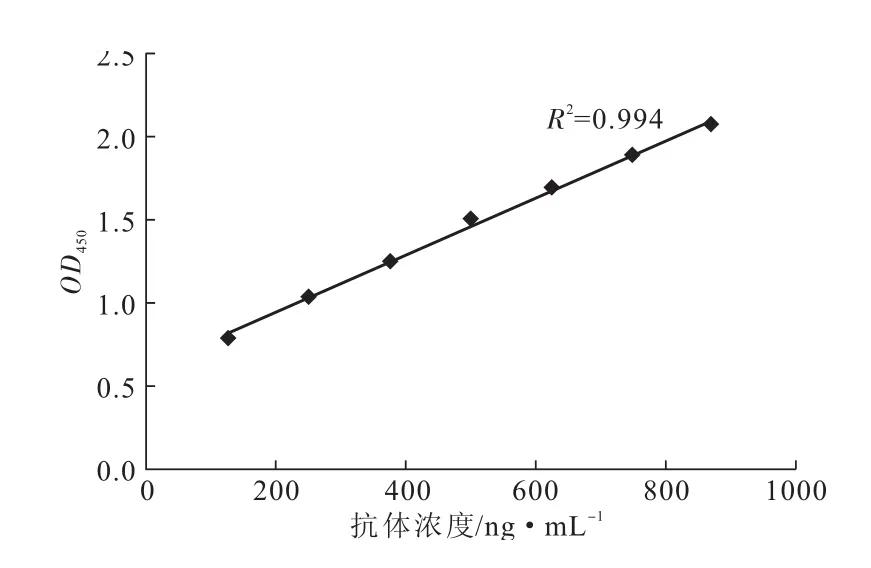
图5 阳性抗体间接ELISA检测结果Fig.5 Indirect ELISA results of purified positive antibody
目前纯化抗体大多采用A蛋白亲和色谱法[18-20],一般是在p H值为3的酸性条件下进行洗脱获得的,这类方法容易使部分抗体失活或者降低生物活性。另外,血清白蛋白(SA)和免疫球蛋白(IgG)是血清中含量最多的两种蛋白,它们的等电点分别约为4.8和7.8[21],差别较大,这为利用离子交换色谱分离它们提供了依据。本实验先将血清中几乎所有蛋白吸附于色谱柱上,再选择在p H值为6.0时进行洗脱,可将SA和IgG分开而获得较纯的抗体(Ig),且抗体活性容易保持。本实验成功快速纯化出了具有正常活性的抗体,建立了成本低、快速高效、适合实际应用的制备AK多克隆抗体的方法。
3 结论
在p H值8.0下,从虾组织获得的AK粗提液中的全部蛋白都完全被吸附到Q SepharoseTM-XL强阴离子交换色谱柱上,通过0.1~1 mol·L-1NaCl溶液的梯度洗脱,纯度大于95%又有正常活性的AK被单独洗脱而得以纯化。将纯化的AK免疫大白兔,同样利用Q SepharoseTM-XL强阴离子交换色谱柱从高免疫兔血清中分离纯化出AK多克隆抗体,得到的AK多克隆抗体具有正常活性,纯度大于95%。本研究建立了快速高效、操作方便而又适合实际应用的制备AK及其多克隆抗体的方法。
[1] 姚翠鸾,王志勇,相建海.甲壳动物精氨酸激酶的结构与功能[J].中国生物化学与分子生物学报,2008,24(3):203-208.
[2] Yao C L,Wu C G,Xiang J H,et al.Molecular cloning and response to laminarin stimulation of arginine kinase in haemolymph in Chinese Shrimp,Fenneropenaeus chinensis[J].Fish&Shellfish Immunology,2005,19(4):317-329.
[3] 曾勇,路承平.螯虾免疫相关基因的检出及丝氨酸蛋白酶抑制物基因分析[J].中国水产科学,2004,11(4):319-324.
[4] Wang B,Li F,Dong B,et al.Discovery of the genes in response to white spot syndrome virus(WSSV)infection in Fenneropenaeus chinensis through cDNA microarray[J].Mar Biotech,2006,8(5): 491-500.
[5] Ellington W R.Phosphocreatine represents a thermodynamic and functional improvement over other muscle phosphagens[J].Indian Journal of Experimetal Biology,1989,143:177-194.
[6] Dearman R J,Kimber I.Foodallergy:What are the issues[J]. Toxicology Letters,2001,120(3):165-170.
[7] Malarkey T.Human health concerns with GM crops[J].Mutation Research,2003,544(2-3):217-221.
[8] Liu N,Wang J S,Wang W D,et al.The interaction between residues 62 and 193 play a key role in activity and structural stability of arginine kinase[J].International Journal of Biological Macromolecules,2011,49(3):402-408.
[9] 姚翠鸾,王志勇,张瑞英,等.凡纳滨对虾精氨酸激酶的分离纯化及性质研究[J].水产学报,2008,32(5):690-696.
[10] 秦宗华,陈婷.强阴离子交换色谱结合分子排阻色谱纯化血清中免疫球蛋白和白蛋白[J].色谱,2012,30(8):851-855.
[11] Yu C J,Lin Y F,Chiang B L,et al.Proteomics and immunological analysis of a novel shrimp allergen Penm2[J].Journal of Immunology,2003,170(1):445-453.
[12] Yu Z,Pan J,Zhou H M.A direct continuous p H-spectrophotometric assay for arginine kinase activity[J].Protein and Peptide Letters,2002,9(6):545-552.
[13] Laemmli U K.Cleavage of structural proteins during the assembly of the head of bacteriophage T4[J].Nature,1970,227 (5259):680-685.
[14] 何光志,田维毅,王平,等.应用间接ELISA检测猪旋毛虫抗体[J].中国动物检疫,2010,27(1):47-48.
[15] 周光炎.免疫学原理[M].上海:上海科学技术出版社,2007.
[16] 钱庭宝,刘组林.离子交换树脂应用手册[M].天津:南开大学出版社,1989.
[17] Qian W B,Wu J L,Yang L,et al.Modeling the c AMP desorption process from an anion exchange chromatography column[J]. Chemical Engineering Science,2012,80:317-325.
[18] 邓瑞春,张明伟,毛宁.A蛋白亲和色谱法纯化动物血清抗体的效果比较[J].生物技术通讯,1998,9(4):271-273.
[19] 周冬梅,邹汉法,杨利,等.蛋白A高效亲和膜色谱法测定人血浆中免疫球蛋白G的含量[J].色谱,1998,16(3):195-197.
[20] Batalla P,Bolivar J M,Lopez-Gallego F,et al.Oriented covalent immobilization of antibodies onto heterofunctional agarose supports:A highly efficient immune-affinity chromatography platform[J].Journal of Chromatography,2012,1262:56-63.
[21] 范家佑,蔡惠芬,林艳红,等.黄鳝不同发育阶段血清蛋白含量及
电泳分析[J].山地农业生物学报,1999,18(4):216-218.
Study on Fast Purification of Arginine Kinase and Its Polyclonal Antibody via Q SepharoseTM-XL Strong Anion Exchange Chromatography
CHEN Ting,WU Ji-mei,LI Ren-qiang
(Department of Biotechnology,Jinan University,Guangzhou 510632,China)
Q SepharoseTM-XL strong anion exchange chromatography was used to purify shrimp arginine kinase from arginine kinase crude extract.After the white rabbit was immunized using arginine kinase,the hyperimmune sera was collected and Q SepharoseTM-XL strong anion exchange chromatography was again used to purify arginine kinase polyclonal antibody from these sera.The high purity and activity of arginine kinase and its polyclonal antibody purified by Q SepharoseTM-XL strong anion exchange chromatography had been proved by SDS-PAGE.Laboratory method for fast and efficiently purification of arginine kinase and its polyclonal antibody has been built,which would be helpful for arginine kinase study and food allergies research.
Q SepharoseTM-XL strong anion exchange chromatography;arginine kinase;polyclonal antibody; purification
TQ464.7
A
1672-5425(2013)03-0067-04
10.3969/j.issn.1672-5425.2013.03.018
2013-01-09
陈婷(1987-),女,湖北鄂州人,硕士研究生,研究方向:分子细胞生物学;通讯作者:李任强,教授,E-mail:trqli@jnu.edu. cn。
