乙酸乙酯水解实验的改进
2013-07-17姜伟曹强
姜伟 曹强
(会宁县第五中学 甘肃 白银 730700)
一、问题的提出
酯的重要化学性质是在一定条件下能够跟水发生水解反应。为了说明酯在不同介质中的水解速率,高中化学人教版选修5《有机化学基础》教师教学用书第66页安排了乙酸乙酯水解反应的演示实验。要求通过酯层消失、酯香味消失的时间判断水解速率的快慢。[1]但在实验操作中效果不理想,原因有四点:
(1)实验可信度太差。乙酸乙酯与水层界面不明显,只有前排几个学生看到酯层消失的现象;用闻酯香味消失的时间来判断水解速率是不恰当的,因为后排学生可能闻不到,不仅分辨率低,不具说服力,而且也不能使全班学生获得明显的体验;
(2)加热温度偏高(70~80℃),没有冷凝装置,会使乙酸乙酯以及水解生成的乙酸、乙醇挥发,造成一定的误差;
(3)水解产物无法判断,不能很好的探究乙酸乙酯的水解产物,实验说服力不强;
(4)乙酸乙酯在中性、酸性、碱性条件下的水解很难在短时间内观察出酯层的变化,影响课堂教学的完成情况。针对以上问题,本文对此实验进行了改进,改进后的实验现象明显,达到了很好的教学效果。
二、实验设计思路
加大乙酸乙酯用量,改变酯层与溶液层颜色的差别,有利于酯层高度的比较,有利于判断乙酸乙酯水解的速率,增强了演示实验的直观性;增添冷凝装置,提高水浴温度,加速酯的水解,减少演示时间,有利于课堂教学;通过石蕊试液颜色的变化说明产物中有乙酸生成;最后再加入1mL酸性重铬酸钾溶液通过溶液颜色的变化,说明产物中有乙醇生成,通过溶液颜色的不同,还可进一步说明在不同介质中的水解速率,更适合于新课程之下的课堂探究教学。
三、实验改进
1.实验仪器和药品
500mL 烧杯一只、试管 4支(20×150mm)、5mL 注射器3支、带有单孔橡皮塞的玻璃导管(25cm)3支、红蓝铅笔一支;乙酸乙酯、3mol/L的稀硫酸、30%的氢氧化钠溶液、石蕊试液、酸性重铬酸钾溶液、蒸馏水、开水。
2.实验装置图
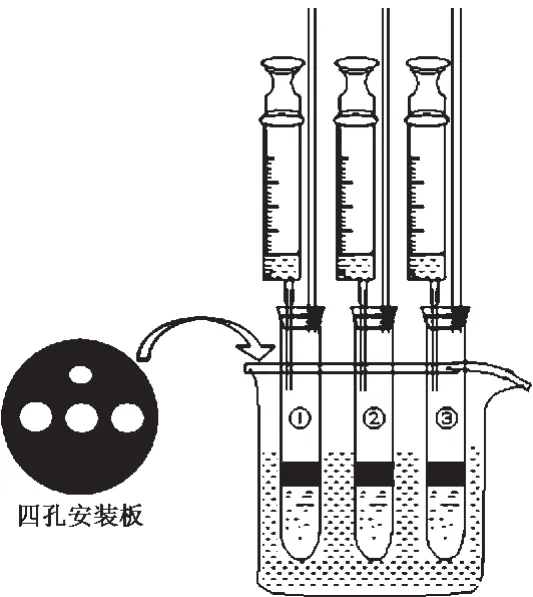
图1 乙酸乙酯水解实验新装置
3.实验过程
(1)给酯染色
取20mL乙酸乙酯倒入试剂瓶中,加入几段红蓝铅笔中的红笔芯,浸泡2小时,给酯染上红色,备用[2]。
(2)酯的水解
①取4支20×150mm的试管,分别标为①、②、③、④,在①、②号试管中各加入蒸馏水5mL、在③号试管中加入3mol/L的稀硫酸5mL、在④号试管中加入30%的氢氧化钠溶液5mL;然后向4支试管中各滴入5滴石蕊试液振荡、静置。四支试管里的溶液分别呈紫色、紫色、红色和蓝色;
②在上述4支试管中各加入2mL乙酸乙酯,振荡、静置。液面均有分层现象,上层酯层厚度一样,四支试管里的溶液分别呈紫色、紫色、红色和蓝色;
③把上述(2)中的①号试管置于试管架上,然后同时将②、③、④号试管放入73~76℃的水浴中加热3min,取出,振荡10s后,静置。在②号试管里,酯层厚度基本上没有变化,溶液变为浅红色;在③号试管里,酯层厚度变薄,溶液红色加深;在④号试管里,酯层几乎消失,溶液蓝色逐渐变浅。通过酯层厚度的变化,说明乙酸乙酯在碱性介质中水解速率最快,酸性次之,中性也能水解,不过速率很慢;通过①、②号试管溶液颜色的对比,说明水解产物中有乙酸生成;
(4)最后用注射器分别向上述(3)中的②、③、④号试管中同时注入1mL酸性重铬酸钾溶液 (橙红色),振荡、静置。在②号试管里,溶液变为橙红色;在③号试管里,溶液变为墨绿色;在④号试管里,溶液变为绿色。说明乙酸乙酯水解会产生乙醇,根据溶液颜色的变化,进一步说明在碱性介质中水解速率最快。
四、实验创新点
(1)实验装置简单、操作方便,现象明显,直观性强,容易比较,可信度大,需时短(仅需3min),有利于启发讲解,拓宽学生思维,充分体现了新课程下的课堂探究教学。
(2)在水层中滴加石蕊试液能够指示水层的成分,并且通过①、②号试管的对照,可判断水解产物乙酸的生成。
(3)通过与②号试管的对照,不仅说明无机酸和碱促进乙酸乙酯水解的情况,而且还能说明在没有催化剂存在的条件下乙酸乙酯也能发生微弱的水解。
(4)加入酸性重铬酸钾溶液不仅可以检验水解产物中有乙醇生成,同时可通过溶液颜色的变化进一步判断酯的水解速率(绿色越深,说明生成的乙醇越多,从而说明水解速率越快)。
(5)本实验增添了冷凝装置,这样就不需要控制热水温度,也不用担心水浴温度超过乙酸乙酯的沸点,可用热水瓶中的开水直接水浴加热,使实验操作简单化。
[1] 人民教育出版社化学室编著.普通高中课程标准实验教科书·化学选修5·《有机化学基础》教师教学用书[M].北京:人民教育出版社,2007:66
[2] 相虎.酯的水解实验改进[J].化学教育,2003,24(4):45
