大孔树脂纯化蓝莓总黄酮及其抗氧化活性研究
2013-07-17邵盈盈李向荣
邵盈盈,李向荣
(1.浙江大学药学院,浙江杭州 310058;2.浙江大学城市学院,浙江杭州 310015)
蓝莓,又称越橘,属杜鹃花科,越橘属植物,为多年生落叶或常绿灌木,是地球上少有的真正的蓝色食物之一[1]。果实富含花青素,绿原酸,黄酮等多种生物活性成分,而其中的黄酮类化合物在抗氧化、保护人体免受自由基的损伤,增强血管弹性,改善循环系统,增强免疫力,延缓衰老,保护视力,改善弱视等方面起到一定的作用[2-4]。因此蓝莓是理想的天然抗氧化产物的来源。大孔吸附树脂是一种有机高聚物吸附剂,具有性质稳定、选择性强、处理量大、再生方便等优点,在天然产物工业化提取分离中有广泛的应用[5]。目前对蓝莓果渣、蓝莓叶中花青素和黄酮的纯化及其抗氧化活性研究较多[6],而对蓝莓果实中总黄酮的分离纯化和抗氧化活性少见报道,因此,本实验对4种树脂进行筛选,考察了各工艺对纯化效果的影响,确定最优纯化条件,初步探讨了蓝莓总黄酮的抗氧化活性,为蓝莓在食品、药品领域的进一步开发和综合利用提供了实验依据。
1 材料与方法
1.1 材料与仪器
芦丁标准品 中国药品生物制品检定所,批号:100080-200707;蓝莓 智利进口,品种:蓝丰蓝莓;AB-8、NKA-9、NKA-Ⅱ、D101 型大孔吸附树脂 南开大学化工厂;VC对照品 桐乡市康普达生物科技有限公司,批号:20110630;DPPH 美国Sigma公司;邻二氮菲 天津市大茂化学试剂厂生产;其他试剂均为分析纯。
Mettler Toledo AL104电子天平 梅特勒-托利多仪器上海有限公司;KQ-700DB型数控超声波清洗器 昆山市超声仪器有限公司;TU-1901型双光束紫外可见分光光度计 北京普析通用仪器有限公司;旋转蒸发器 RE-2000B型 上海亚荣生化仪器厂;DKZ-1型电热恒温振荡水槽 上海精宏实验设备有限公司;粉碎机FW135 天津市泰斯特仪器有限公司;DHG-9240A型电热恒温鼓风干燥箱 上海精宏实验设备有限公司;SHB-ⅢA型循环水式多用真空泵 河南省太康科教器材厂;HH-4型数显恒温水浴锅 国华电器有限公司;φ2cm×40cm层析柱 常青化工。
1.2 标准曲线的制备[7]
精密称取芦丁标准品40.0mg,置于100mL容量瓶中,用60%乙醇溶解并定容,配成0.4mg·mL-1的标准品储备液。分别吸取储备液0、0.2、0.4、0.8、1.2、1.6、2.0、2.4、2.8、3.2mL 至 10mL 刻度试管中,加 30%乙醇至5.4mL,摇匀,加5%NaNO2溶液0.3mL,摇匀静置6min,加10%Al(NO3)3溶液0.3mL,摇匀静置6min,加4%NaOH溶液4mL,摇匀静置15min后在510nm处测定吸光度(以试剂空白做参比),建立回归方程为A=13.693C-0.0103(R2=0.9994)。
1.3 蓝莓总黄酮的提取及含量测定
1.3.1 蓝莓预处理 蓝莓鲜果洗净自然晾干后,放入干燥箱内40℃下干燥1d,取出剪开后继续干燥至恒重。将干燥蓝莓粉碎成细颗粒状,过24目筛,密封保存备用。
1.3.2 蓝莓总黄酮的提取 取预处理蓝莓粉末50g,用20倍量50%乙醇于40℃超声提取三次,每次45min,固定超声功率560W,超声提取后抽滤,合并滤液,旋转蒸发浓缩后备用。
1.3.3 样品溶液黄酮含量的测定 取样品溶液1mL,置于10mL刻度试管中,自“加30%乙醇至5.4mL”起,按标准曲线测定方法操作,测定吸光度,计算样品溶液的浓度及黄酮含量。
1.4 大孔树脂纯化蓝莓总黄酮
1.4.1 大孔树脂预处理 用体积分数95%的乙醇浸泡24h,而后用95%乙醇洗至取出适量流出液加水混合不出现浑浊为止,在乙醇中储存备用。
1.4.2 树脂静态筛选 分别取一定体积(相当于1g干树脂)的四种树脂置100mL具塞锥形瓶中,加提取液30mL,25℃水浴振荡24h,使其达到饱和吸附,静置2h过滤,吸取滤液测定总黄酮浓度。按式(1)计算树脂饱和吸附量:

过滤出来的树脂吸干表面水分,加入体积分数50%的乙醇30mL,25℃水浴振荡6h,静置2h过滤,测定滤液浓度,按式(2)计算洗脱率:

1.4.3 纯化蓝莓总黄酮单因素考察 上样浓度对黄酮回收率的影响:将不同浓度的蓝莓总黄酮提取液动态上样,用3BV的60%乙醇溶液(调pH3)洗脱,洗脱流速为2mL·min-1。洗脱液pH对黄酮回收率的影响:将一定浓度的蓝莓总黄酮提取液动态上样,用3BV的pH分别为1、2、3、4、5的60%乙醇溶液洗脱,洗脱流速为2mL·min-1。洗脱液浓度对黄酮回收率的影响:将一定浓度的蓝莓总黄酮提取液动态上样,用3BV浓度分别为40%、50%、60%、70%、80%的固定 pH3的乙醇溶液洗脱,洗脱流速为2mL·min-1。洗脱流速对黄酮回收率的影响:将一定浓度的蓝莓总黄酮提取液动态上样,用3BV的60%乙醇溶液(调pH3)洗脱,洗脱流速分别控制在0.5、1、2、3、4mL·min-1。四个单因素实验中上样流速均固定为2mL·min-1,上样完成后静置1h,洗脱前用3BV纯化水对树脂柱进行冲洗,洗脱过程中收集洗脱液,计算回收率。
1.4.4 纯化蓝莓总黄酮的正交实验 以25mL床层体积(BV)的树脂装柱,用大量蒸馏水冲洗树脂至流出液无醇味为止。根据单因素实验结果,确定因素水平表,按各正交实验号下条件进行上样,见表1,上样流速固定2mL·min-1,上样完成后静置1h使黄酮类成分能够大量吸附,洗脱前用3BV纯化水对树脂柱进行冲洗,然后用3BV的相应洗脱液洗脱,收集洗脱液,计算回收率。

表1 因素水平表Table1 Factors and levels
1.4.5 蓝莓总黄酮纯度的测定 按最佳条件纯化后的蓝莓总黄酮洗脱液55℃真空干燥后称重、测定其中总黄酮的含量,计算纯度。
1.5 蓝莓总黄酮抗氧化活性测定
1.5.1 对 DPPH自由基的清除能力[7]精密称取19.716mg DPPH,用无水乙醇溶解定容于250mL容量瓶中,得C=0.2mmol·L-1的溶液。将纯化后的蓝莓总黄酮、芦丁标准品和VC分别用无水乙醇配置成各个浓度,在10mL比色管中加入待测样液2mL,DPPH·溶液2mL,混匀,避光静置30min,在517nm处测定吸光度A样品,以2mL无水乙醇代替待测液,得到吸光度A空白,以2mL无水乙醇代替DPPH·溶液,得到吸光度A对照。每一吸光度平行测定三次,取平均值。清除率按式(3)计算:


1.5.2 对羟基自由基(·OH)的清除能力[8]在比色管中加入1.5mmol·L-1邻二氮菲的无水乙醇溶液1mL,PBS 溶液 2mL 和 1.5mmol·L-1FeSO4溶液1mL,混匀后,再加入各浓度样液1mL和0.1%H2O2溶液1mL,充分混匀后,37℃水浴60min,在536nm处测定样品吸光度A样品。以蒸馏水2mL代替样液和H2O2溶液所测吸光度为空白吸光度A空白,以蒸馏水1mL代替样液所测吸光度为损伤吸光度A损伤。清除率按式(4)计算:
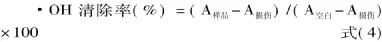
2 结果与分析
2.1 四种树脂的静态吸附与解析实验结果
由表2可知,NKA-Ⅱ型树脂的饱和吸附量最高,NKA-9和AB-8型次之,D101型树脂的吸附量最小,从解析率来看,也是NKA-Ⅱ型树脂最容易解析,其次分别是 NKA-9、D101、AB-8。因此选择NKA-Ⅱ型树脂作为纯化蓝莓总黄酮的树脂。
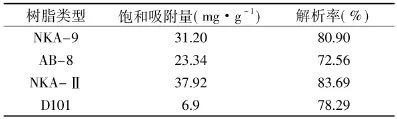
表2 四种树脂的静态吸附-解析结果Table2 Static adsorption capacity and elution ratio result of four types of macroporous resins
2.2 单因素考察实验结果
分析表3~表6可知,随着上样液浓度的增大,黄酮回收率增加,当浓度为1.355mg·mL-1时,回收率达到最大,之后浓度增加,黄酮回收率呈下降趋势。当洗脱液pH为3时总黄酮的回收率最高。乙醇浓度较低时,回收率随着浓度上升而增加,到达60%时最高,随后略有下降。流速较慢时,回收率变化不大,增加流速,回收率逐渐降低。

表3 上样浓度对黄酮回收率的影响Table3 Effect of concentration of liquid sample on recovery yield of total flavonoids

表4 洗脱液pH对黄酮回收率的影响Table4 Effect of eluent’s pH on recovery yield of total flavonoids

表5 洗脱液浓度对黄酮回收率的影响Table5 Effect of concentration of ethanol on recovery yield of total flavonoids

表6 洗脱流速对黄酮回收率的影响Table6 Effect of elution velocity on recovery yield of total flavonoids
2.3 NKA-Ⅱ型树脂纯化蓝莓总黄酮正交实验结果
分析表7可得:B为主要因素,C和A次之,D最小,最佳工艺条件为A2B2C3D2,因此确定纯化蓝莓总黄酮的最佳工艺条件为上样浓度1.355 mg·mL-1,洗脱 pH为 3,洗脱乙醇浓度 70%,洗脱流速2mL·min-1。在该条件下重复实验两次,回收率为96.83%,均高于正交实验时的回收率。将最佳工艺条件下纯化后的洗脱液真空干燥,计算纯度得41.41%,比未纯化前提高33.94倍。
2.4 蓝莓总黄酮抗氧化活性测定结果
2.4.1 DPPH自由基清除能力 DPPH·是一种稳定的以氮为中心的自由基,其乙醇溶液呈深紫色,在517nm处有一强吸收。当有自由基清除剂存在时,其供氢或供质子特性,可以与DPPH·的单电子配对,使自由基浓度降低,紫色减弱。褪色程度与DPPH·接受的电子数量成定量关系,反应快速、灵敏、简便,因此可用于评价天然产物的自由基清除活性。由表8可知,芦丁、蓝莓总黄酮和VC对DPPH·的清除能力表现为随着浓度的升高,清除率迅速上升,而且基本呈线性关系,蓝莓总黄酮和芦丁的清除能力相当,但弱于VC。
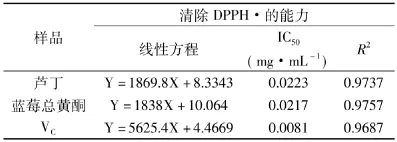
表8 蓝莓总黄酮、芦丁和VC对DPPH·清除能力Table8 Scavenging activity of flavonoids from blueberry lutin and VCon DPPH·
2.4.2 羟基自由基(·OH)清除能力 Fe2+与H2O2反应生成·OH,Fe2+与邻二氮菲反应生成红色配合物,·OH能氧化Fe2+成为Fe3+而使红色配合物减少,当有抗氧化剂存在时,抗氧化剂与·OH作用减弱了·OH对Fe2+的氧化,而使吸光度有所变化,因此常用来检测天然化合物的抗氧化活性。芦丁、蓝莓总黄酮和VC对·OH的清除率也是随着浓度的升高而迅速上升,基本呈线性关系,蓝莓总黄酮清除·OH的能力最强,高于芦丁和VC,见表9,因此可知蓝莓总黄酮具有较好的清除·OH的能力。
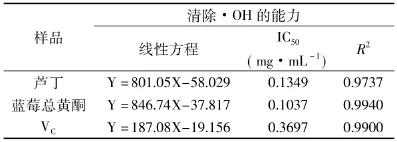
表9 蓝莓总黄酮、芦丁和VC对·OH清除能力Table9 Scavenging activity of flavonoids from blueberry lutin and VCon·OH
3 结论与讨论
本实验通过对四种树脂进行筛选,得出NKA-Ⅱ型树脂对蓝莓总黄酮有较好的吸附和解吸性能,富集效果好,因此选用NKA-Ⅱ树脂进行纯化正交实验。最佳纯化工艺为:上样浓度1.355 mg·mL-1,洗脱pH为 3,洗脱乙醇浓度 70%,洗脱流速2mL·min-1。其中洗脱液pH对纯化的影响最大,在pH为3时的效果最好,因为黄酮类物质为多羟基化合物,呈现一定的酸性,所以在微酸性条件下容易被树脂吸附,而且蓝莓总黄酮中花青苷类所占比例较大,花青苷类物质在pH等于3时最稳定。大孔树脂纯化有效成分是利用其对有效成分吸附-解析的可逆性,因此洗脱剂浓度亦是纯化过程中的重要影响因素,本实验得出洗脱剂乙醇的浓度为70%时纯化效果较好,与50%和60%的乙醇相比,更易将蓝莓总黄酮从大孔树脂上解析下来。
实验中,上样时采用的流速是2mL·min-1,因为大孔吸附树脂的柱层析是一种动态吸附过程,溶液上样流速的变化直接影响黄酮分子向树脂内表面的扩散,从而影响吸附效率,流速过快,树脂对总黄酮吸附不充分,易造成浪费,但流速过慢,将导致整个生产周期的延长。上样完成后静置1h使黄酮类成分能够充分吸附,在洗脱前,用3BV的纯化水先对树脂柱进行冲洗,以除去大部分糖类和氨基酸等杂质,保证醇洗脱时流出液具有最大的纯度。蓝莓总黄酮提取液经大孔吸附树脂处理后纯度增加,杂质大幅度降低,同时树脂处理可有效地除去提取液中的糖类、无机盐、蛋白质等。此纯化方法操作简便,回收率高,对于工业化生产有一定的参考意义。
本文还采用DPPH法和邻二氮菲法评价了蓝莓总黄酮的抗氧化活性,通过对蓝莓总黄酮、芦丁和VC的对照实验表明,蓝莓总黄酮可有效清除DPPH·和·OH,其中对·OH的清除能力优于天然抗氧化剂VC,推测黄酮类化合物中的多元酚羟基是其具有抗氧化活性的主要药效基团。总之,蓝莓中的黄酮类化合物是一种良好的自由基清除剂,可作为一种新的提取天然食品抗氧化剂的水果加以开发利用,具有广阔的市场前景。
[1]胡雅馨,李京,惠伯棣.蓝莓果实中主要营养及花青素成分的研究[J].食品科学,2006,27(10):600-603.
[2]Pietta P G.Flavonoids as antioxidants[J].J Nat Prod,2000,63:1035-1042.
[3]陈介甫,李亚东,徐哲.蓝莓的主要化学成分及生物活性[J].药学学报,2010,45(4):422-429.
[4]Cho M J,Howard L R,Prior R L,et al.Flavonoid glycosides and antioxidant capacity of various blackberry,blueberry and red grape genotypes determined by high-performance liquid chromatography/mass spectrometry[J].Journal of the Science of Food and Agriculture,2004,84:1771-1782.
[5]姚玉翠,李向荣.大孔吸附树脂分离纯化玫瑰花中原花青素的研究[J].中药材,2008,31(8):1239-1241.
[6]李颖畅,孟宪军.蓝莓叶黄酮提取物抗氧化活性的研究[J].营养学报,2008,30(4):427-429.
[7]高丽威,李向荣.微波萃取法提取紫心甘薯总黄酮及其抗氧化活性研究[J].浙江大学学报:理学版,2009,36(5):571-574.
[8]金鸣,蔡亚荣,李金荣,等.邻二氮菲-Fe2+氧化法检测H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555.
