丹酚酸B在巨噬细胞胆固醇外排中的作用
2013-07-13王丽姜华军杨帆杜郁贾晓健司书毅洪斌
王丽,姜华军,杨帆,杜郁,贾晓健,司书毅,洪斌
丹酚酸B在巨噬细胞胆固醇外排中的作用
王丽,姜华军,杨帆,杜郁,贾晓健,司书毅,洪斌
100050 北京,中国医学科学院医药生物技术研究所卫生部抗生素生物工程重点实验室(王丽、姜华军、杨帆、杜郁、贾晓健、洪斌),国家新药(微生物)筛选实验室(司书毅)
考察丹酚酸 B(SAB)对巨噬细胞胆固醇外排的影响。
分别采用巨噬细胞 RAW 264.7 和 PMA 诱导的 THP-1 细胞,利用流式细胞仪检测丹酚酸 B 对已摄取DiI-acLDL 的细胞外排脂质作用的影响,对 RAW 264.7 细胞表面 ABCA1 蛋白表达水平的影响。采用 ABCA1 的抑制剂 DIDS 及小分子干扰 RNA 的方法检测ABCA1 在丹酚酸 B 诱导的促进脂质外排过程中的作用。进而利用靶向 CD36 的小分子干扰 RNA,通过抑制 CD36 的表达,检测 CD36 在丹酚酸 B 促进载脂巨噬细胞脂质外排过程中的作用。
采用 DiI 荧光标记的脂质检测巨噬细胞对脂质的外排作用,结果显示 SAB 显著增加了荷脂细胞对 DiI-acLDL 的外排作用。对脂代谢相关转运蛋白表达的检测结果显示,在荷脂的 RAW 264.7 细胞中,SAB 能够以一定剂量依赖的方式增加细胞表面 ABCA1 蛋白水平的表达。进一步研究显示,上述 SAB 促进外排的作用可被 ABCA1 的抑制剂或者 siRNA 的作用消除,确证了 ABCA1 在 SAB 介导的脂质外排过程中的重要作用。同样利用 CD36 小分子干扰 RNA 将 CD36 表达抑制后,SAB 促进外排的作用消失,说明 SAB 介导的细胞脂质的外排作用同样依赖于 CD36。
丹酚酸 B 通过上调 ABCA1 的表达,促进巨噬细胞胆固醇或脂质的外排,且该作用依赖于 ABCA1 及 CD36,为 SAB 抗动脉粥样硬化作用新机制的研究提供了重要依据。
动脉粥样硬化; 丹酚酸 B; ATP 结合盒转运蛋白 A1; 抗原, CD36; 胆固醇逆转运
心脑血管疾病是当今世界发病率最高的疾病之一,其致死、致残率高居各类疾病之首。动脉粥样硬化(atherosclerosis,AS)是心脑血管疾病的主要病理基础,而脂质代谢紊乱尤其是胆固醇代谢紊乱是其公认的主要致病因子。大量的流行病学和临床研究表明,血浆中低密度脂蛋白(low density lipoprotein,LDL)水平与动脉粥样硬化危险性呈正相关[1-2],而高密度脂蛋白(high density lipoproteins,HDL)水平与动脉粥样硬化危险性呈负相关[3-5]。20 世纪 70 年代发现胆固醇摄取的 LDL 受体(low density lipoprotein receptor,LDLR)调节通路[6-7]上调肝脏 LDLR 的表达成为降低血液胆固醇浓度的最主要手段。此外,要进一步降低心血管疾病的危害,在降低 LDL-C 的同时必须从预防和(或)逆转 AS 的新的治疗靶点出发来寻找具有新作用机制的药物。近年来在新型调血脂药物研发过程中,血浆脂蛋白代谢过程中的另两个关键步骤:氧化的低密度脂蛋白(oxLDL)诱导的泡沫细胞形成过程,以及与 HDL 代谢密切相关的胆固醇逆向转运(reverse cholesterol transfer,RCT)通路中相关的各个靶点受到人们的广泛重视。
近年来的研究发现,体内修饰的 LDL(modified LDL,mLDL)(主要是 oxLDL)致 AS主要基于其参与泡沫细胞形成,进而形成动脉粥样硬化病灶,而 B 族清道夫受体 CD36 作为此过程的重要参与者,可无限制摄取 oxLDL(即在摄取时不受负反馈调控),在泡沫细胞形成中起重要作用[8-10]。胆固醇逆转运是指机体将不便于进行胆固醇调节和利用的外周组织中的胆固醇转运到肝脏代谢及在固醇激素生成组织中被利用,从而可能使已经形成的动脉粥样硬化脂质斑块通过胆固醇逆转运的方式得到缓解甚至逆转。该过程主要包括胆固醇从外周组织的流出、HDL 颗粒中胆固醇的酯化、HDL 中胆固醇酯的转移、HDL 的清除等 4 个环节[11-12]。其中 ATP 结合盒转运蛋白 ABCA1(ATP-binding cassette transporter A1)在此过程中发挥了关键的作用。ABCA1 以 ATP 为能源,可将细胞内过剩的胆固醇和磷脂转运至初生的HDL,在细胞内脂质清除过程中起到外排泵的作用,这是 RCT 的第一个关键环节[13]。
前期工作中,我们针对 CD36 建立了 CD36 拮抗剂高通量筛选模型,并通过筛选获得了一系列阳性化合物[14],包括化合物丹酚酸 B(salvianolic acid B,SAB)。丹酚酸 B 属于酚酸类化合物,为唇形科植物丹参(Bge)的主要药理学活性水溶性组分之一[15],被认为具有抗氧化活性,可预防 LDL 氧化以及脂质过氧化作用[16-17]。我们首次在分子水平和细胞水平证实 SAB 作为 CD36 可逆的竞争性拮抗剂,可抑制巨噬细胞摄取脂质以及泡沫细胞形成的作用,并证实该作用依赖于 CD36,并且 SAB 能够抑制 oxLDL 诱导的 CD36 表达上调作用[18]。本工作在此基础上最新发现 SAB 作为 CD36 的小分子拮抗剂,还可促进荷脂细胞中脂质的外排,并证实 SAB 介导的细胞脂质外排作用是通过胆固醇逆转运过程中的关键转运蛋白 ABCA1 实现的,且该作用同样依赖于 CD36。由此推测 CD36 的小分子拮抗剂通过作用于 CD36,不仅可以抑制巨噬细胞对 oxLDL 的摄取及泡沫细胞的形成,而且可能通过影响巨噬细胞内信号转导通路,最终影响 ABCA1 表达,从而促进胆固醇逆转运过程。
1 材料与方法
1.1 材料
1.1.1 细胞株 人单核细胞THP-1(ATCC TIB-202)、小鼠单核/巨噬细胞株RAW 264.7 (ATCC TIB-71)均为本实验室保存。
1.1.2 试剂和试剂盒 SV 总 RNA 提取试剂盒购自美国 Promega 公司;转染试剂(Lipofectamine™ 2000)、Opti-MEM®I Reduced-Serum Medium 培养基、逆转录试剂盒(SuperScript III First-Strand)均购自美国 Invitrogen 公司;实时荧光定量 RT-PCR 试剂盒购自瑞士 Roche 公司;DMEM-高糖培养基、RPMI-1640 培养基均购自美国 Hyclone 公司;胎牛血清购自美国 Gibco 公司;丹酚酸 B 购自中国药品生物制品检定所,纯度为 97.2%,批号:111562-200807;DIDS 购自美国 Sigma 公司;DiI-acLDL 购自美国 Biomedical Technologies(BTI)公司;兔抗小鼠ABCA1 多克隆抗体(NB400-105)购自美国 Novus Biological 公司;小分子干扰 siRNA 由美国 Invitrogen 公司合成。
1.1.3 仪器 iQ5 实时荧光定量 PCR 仪为美国Bio-Rad 公司产品;C6 流式细胞仪为美国 BD 公司产品。
1.2 方法
1.2.1 细胞培养 人单核细胞 THP-1 为悬浮细胞,培养于含 10% 胎牛血清的 RPMI-1640 培养基中,于 37 ℃、5% CO2条件下培养。THP-1 细胞经 160 nmol/L PMA 处理 24 h 后细胞聚集贴壁,诱导分化为巨噬细胞。RAW 264.7 细胞培养于 DMEM 高糖培养基中,培养条件同 THP-1。
1.2.2 小分子干扰 RNA 转染 将 THP-1 细胞以 3 × 105个/ml 的细胞密度接种同时经PMA 诱导 12 h 后细胞贴壁生长。利用 Forward Transfection转染方法,采用 Opti-MEM®I Reduced-Serum Medium 细胞培养基和 LipofectamineTMRNAiMAX转染试剂对相应的RNAi 双链复合物进行细胞转染。转染 24 h 后,检测基因抑制效率或继续其他实验操作。
1.2.3 实时荧光定量 PCR 化合物 SAB 等作用于 RAW 264.7 细胞一定时间后,用 SV 总 RNA 提取试剂盒提取细胞的总 RNA,采用试剂盒SuperScript III First-Strand合成 cDNA,采用 2 × TaqMan®Gene Expression Master Mix 进行荧光定量 PCR 反应,利用数据分析软件分析并计算 Ct 值。以 GAPDH 为内参,采用相对 Ct 的方法对荧光素酶基因的转录水平进行定量。
1.2.4 细胞表面蛋白表达水平检测(流式细胞技术) 将 RAW 264.7 细胞接种于 6 孔细胞培养板中,加入化合物 SAB 作用 24 h 后,消化收集细胞,经 4%(w/v)多聚甲醛室温固定 15 min,PBS漂洗,含 5% FBS 的 PBS 封闭 15 min,PBS 漂洗后标记相应一抗处理 50 min,PBS 漂洗细胞 3 ~ 5 次,随后相应二抗处理 50 min,利用流式细胞仪进行检测相应蛋白表达水平的变化。其中 ABCA1 抗体以 1:50 稀释,FITC 标记的二抗以 1:150 稀释。各组细胞样品的平均检测细胞数为 10000 个,每组细胞的相对荧光强度以对数积分图表示。
1.2.5 细胞外排DiI-acLDL 作用的检测 RAW 264.7 细胞传代后以 2 × 105个/ml 的细胞密度接种于 24 孔或 6 孔板培养,24 h 后,加入 2 μg/ml DiI-acLDL 37 ℃孵育 12 h 使细胞负载脂质。加入化合物处理 12 h 后,将各组培养基分别加入黑色 96 孔荧光检测板中,利用流式细胞技术对每组细胞的相对荧光强度进行检测。外排率(%)= [1 -(化合物处理组-空白对照组)/(荷脂细胞组-空白对照组)] × 100%。
2 结果
2.1 SAB 能够促进荷脂巨噬细胞脂质的外排
利用荧光标记的 DiI-acLDL 对 RAW 264.7 细胞的脂质转运情况进行了初步检测。按照 1.2.5 中所述实验方法,使 RAW 264.7 细胞充分摄取 DiI-acLDL 后变为荷脂状态,加入100 μmol/L SAB,检测 SAB 分别作用 4、12、24 h 后,对细胞中脂质含量的影响。结果如图 1 所示,随着作用时间的递增,SAB 可显著降低荷脂细胞中 DiI-acLDL 的含量,在 3 个作用时间点的外排率分别为 6.7%、15.8%、29.8%。后续实验均选择作用 24 h 后进行检测。
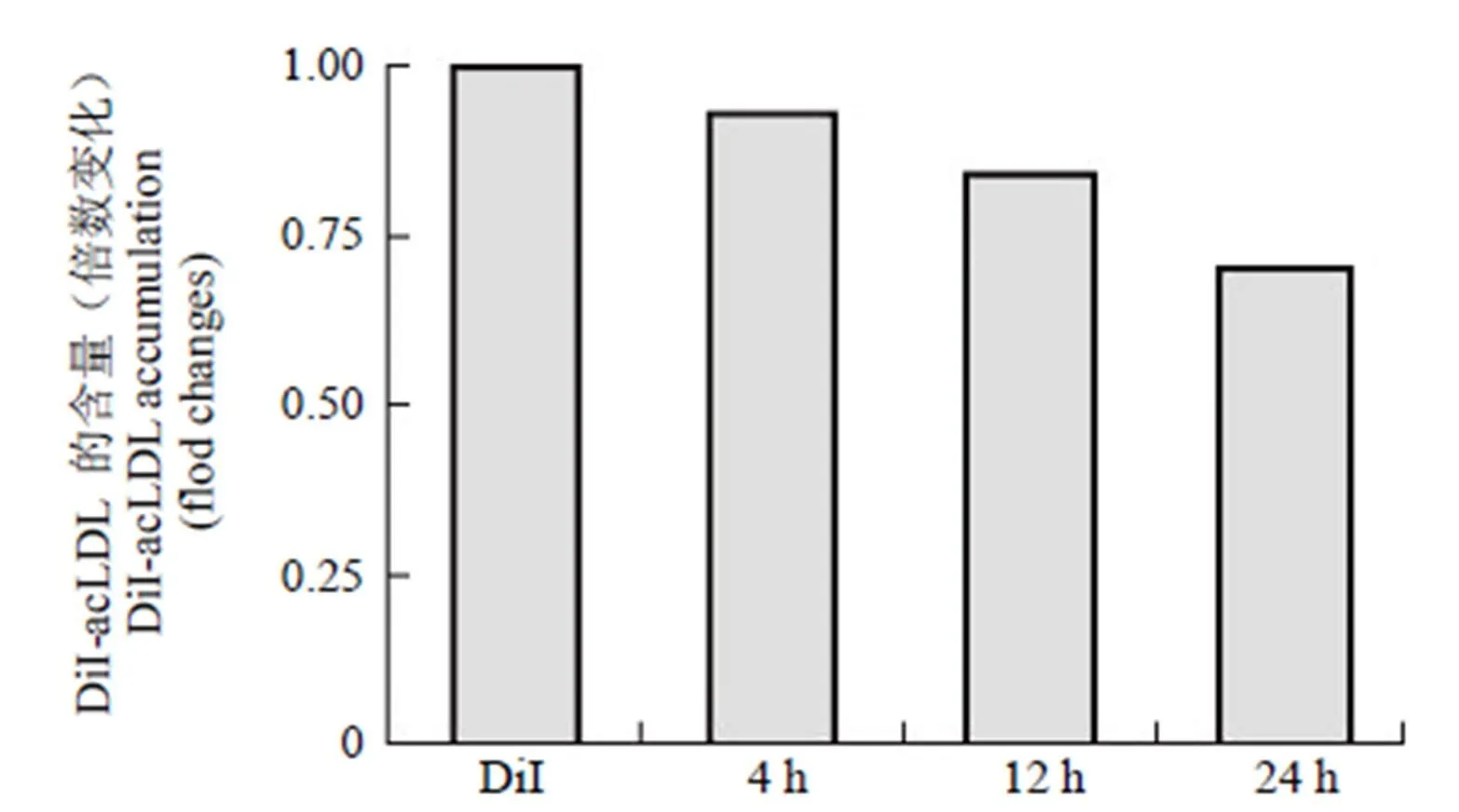
图 1 不同时间点 SAB 对 RAW 264.7 细胞外排 DiI-acLDL 作用的影响
Figure 1 SAB increases the efflux of DiI-acLDL from RAW 264.7 cells in time dependent manner
通过 3 次独立实验,检测了 100 μmol/L SAB 作用 24 h 后对 RAW 264.7 细胞外排作用的影响,统计结果如图 2 所示:对照组细胞几乎没有 DiI-acLDL 外排至培养基中;SAB 作用 24 h 后,细胞内相对荧光强度显著降低,外排率为 20.7%,同时对应培养基中的相对荧光强度显著增加,说明 SAB 促进了 RAW 264.7 细胞对 DiI-acLDL 的外排,推测这一作用是通过胆固醇逆转运过程中的关键转运蛋白来实现的。另外,我们还采用了 PMA 诱导的 THP-1 细胞,对 SAB 促进巨噬细胞外排 DiI-acLDL 的作用进行了检测,结果与上述 SAB 在 RAW 264.7 细胞上的作用一致。
2.2 SAB 对巨噬细胞脂代谢相关转运蛋白表达的影响
ABCA1 在胆固醇清除过程中发挥关键的作用,因此我们检测了 SAB 对 RAW 264.7 细胞表面 ABCA1 蛋白表达的影响。按照实验方法 1.2.4中所述,采用 RAW 264.7 细胞,加入 SAB 作用 24 h,固定细胞后标记相应抗体,利用流式细胞仪检测细胞表面 ABCA1 蛋白水平的变化。检测结果发现,SAB 没有显著地影响 RAW 264.7 细胞表面 ABCA1 蛋白的表达。
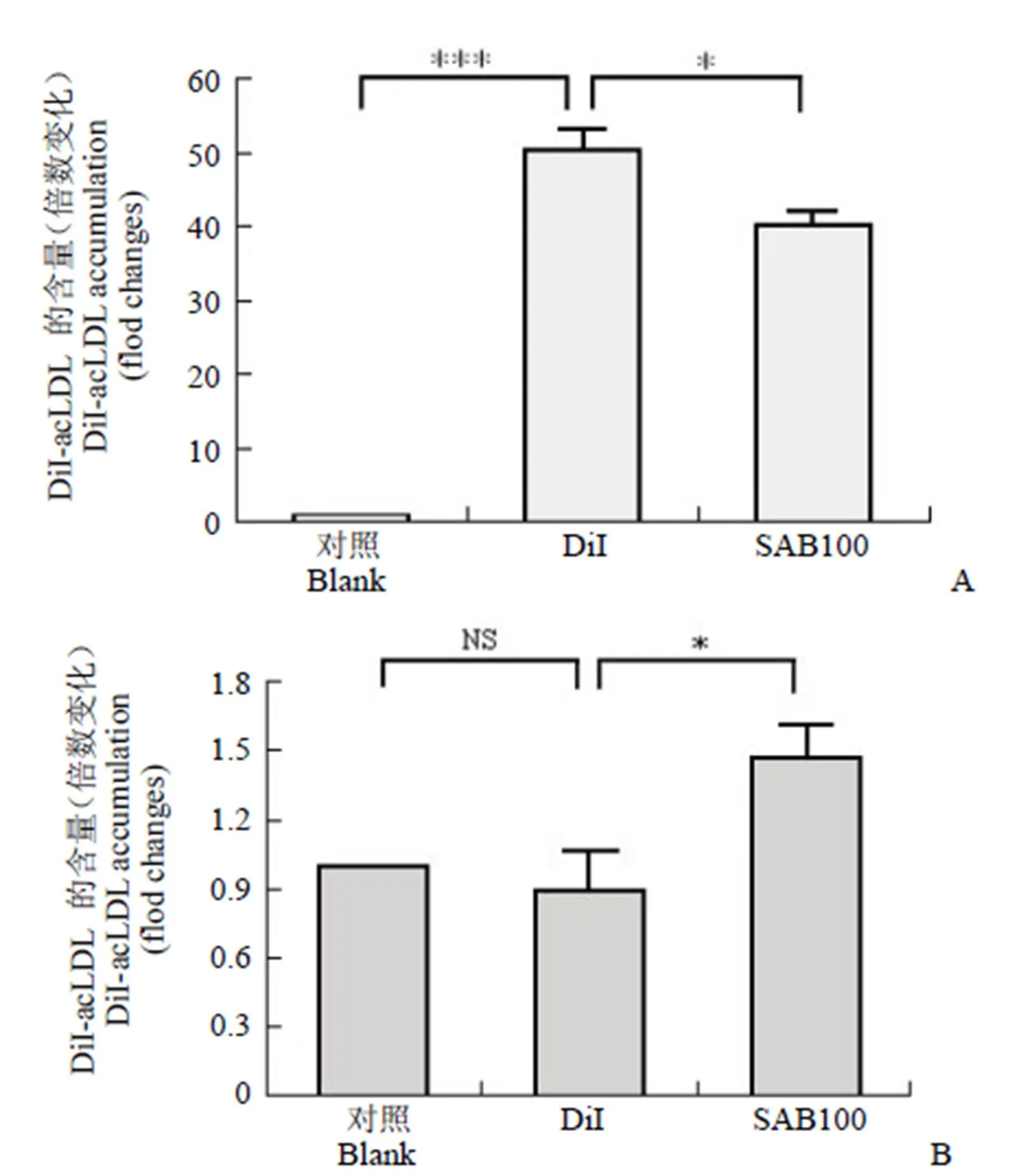
图 2 SAB 促进 RAW 264.7 细胞对 DiI-acLDL 的外排作用[A:各组细胞荧光值检测结果;B:各组细胞相对应的培养基中的荧光值检测结果;*P < 0.05,***P < 0.001 和 NS 无显著差异(n = 3)]
Figure 2 SAB significantly increases the efflux of DiI-acLDL from RAW 264.7 cells [A: DiI fluorescence of RAW 264.7 cells was detected by flow cytometer; B: DiI fluorescence in medium was detected using multimode microplate reader;*< 0.05,***< 0.001 and NS not significant (n = 3)]
RAW 264.7 细胞在荷脂状态下,按照上述实验方法接种细胞后,单独加入 oxLDL 作用或同时加入 oxLDL 和 SAB 共同孵育 24 h,其余操作步骤同上。检测结果显示,在 25 μg/ml oxLDL 存在的情况下,100 μmol/L 和 400 μmol/L SAB 可以一定剂量关系上调 RAW 264.7 细胞表面 ABCA1 蛋白水平的表达,上调率分别为 38.8% 和 92.9%(图 3),说明 SAB 可增加荷脂的 RAW 264.7 细胞表面 ABCA1 的表达。
2.3 ABCA1 在SAB 介导的脂质外排中的作用
采用 ABCA1 抑制剂DIDS[19],通过阻断脂质的外排,从而对其作用进行检测。以 DiI-acLDL(2 μg/ml)与巨噬细胞 RAW 264.7 共同孵育 12 h 后,将 DIDS(100 nmol/L)和 SAB(100 μmol/L)共同或单独作用 24 h,利用流式细胞技术对经不同处理的各组细胞的荧光值进行检测,结果如图 4 所示,DIDS 可显著抑制 SAB 介导的荷脂的 RAW 264.7 细胞对 DiI-acLDL 外排的作用,说明 SAB 是通过作用于 ABCA1,从而促进细胞脂质的外排。
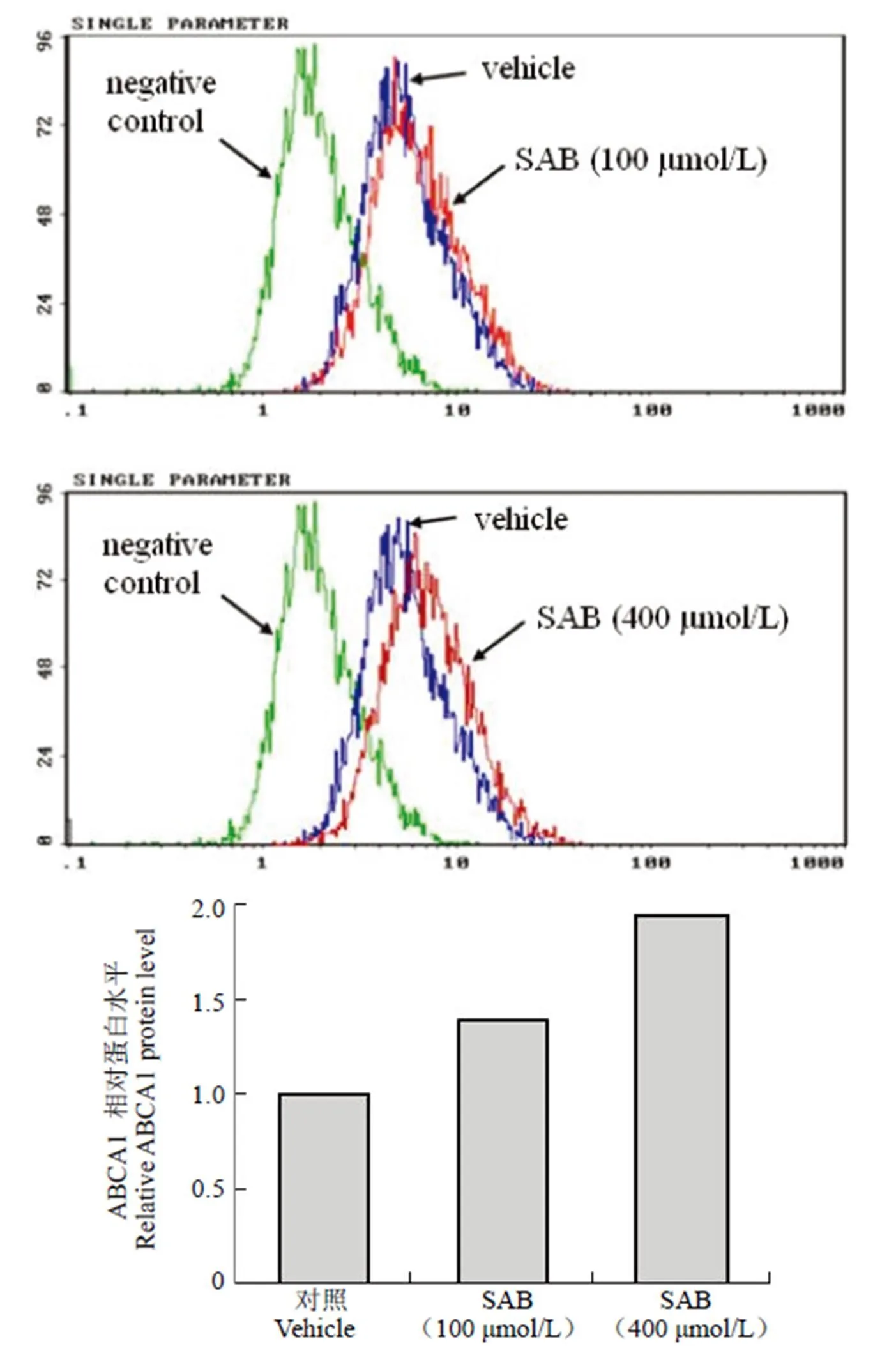
图 3 流式细胞技术检测 oxLDL 存在的情况下 SAB 对 ABCA1 蛋白水平的影响
Figure 3 Flow cytometry analysis for the effect of SAB on ABCA1 protein level in presence of oxLDL in RAW 264.7 cells. Negative control cells were neither treated by SAB nor incubated with primary antibody, vehicle cells were not treated by SAB before incubated with primary antibody and secondary antibody
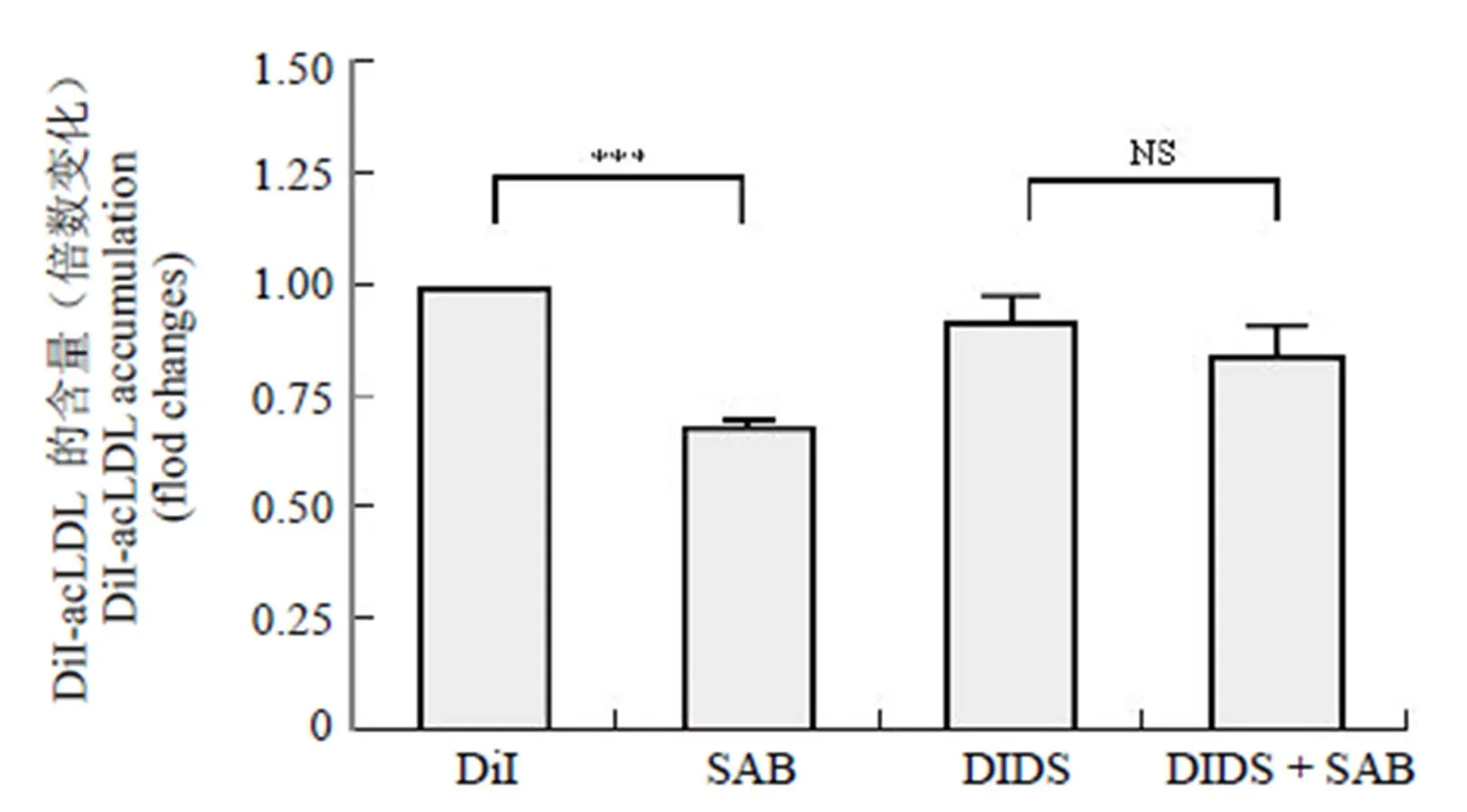
图 4 DIDS 对 SAB 介导的促进 DiI-acLDL 外排作用的影响[***P < 0.001 和NS 无显著差异(n = 3)]
Figure 4 The effect of SAB on DiI-acLDL efflux from RAW 264.7 cells with/without DIDS [***< 0.001 and NS not significant (n = 3)]
进而采用 RNA 干扰(RNAi)技术,对上述结果进行了验证。将 THP-1 细胞接种于24 孔细胞培养板中,并以 160 nmol/L PMA 诱导 24 h 后分化为巨噬细胞,将 ABCA1 siRNA 转染细胞 24 h后,加入 DiI-acLDL(2 μg/ml)与 THP-1(PMA)细胞共同孵育 12 h,使细胞充分荷脂,随后加入 SAB(100 μmol/L)作用 24 h 后检测。结果显示,在 scrambled siRNA 对照组中,SAB 能够显著降低荷脂细胞内 DiI-acLDL 的含量(c 柱与 b 柱相比),当 ABCA1 的表达被抑制后,SAB 促进荷脂细胞对 DiI-acLDL 外排的作用减小且无显著性差异(f 柱与 e 柱相比),外排率由 38.8% 变为12.6%(c 柱与f 柱相比差异显著),说明 SAB 是通过 ABCA1 发挥促进巨噬细胞外排 DiI-acLDL 的作用(图 5),其中 ABCA1 siRNA 的有效抑制率为 73.8%。
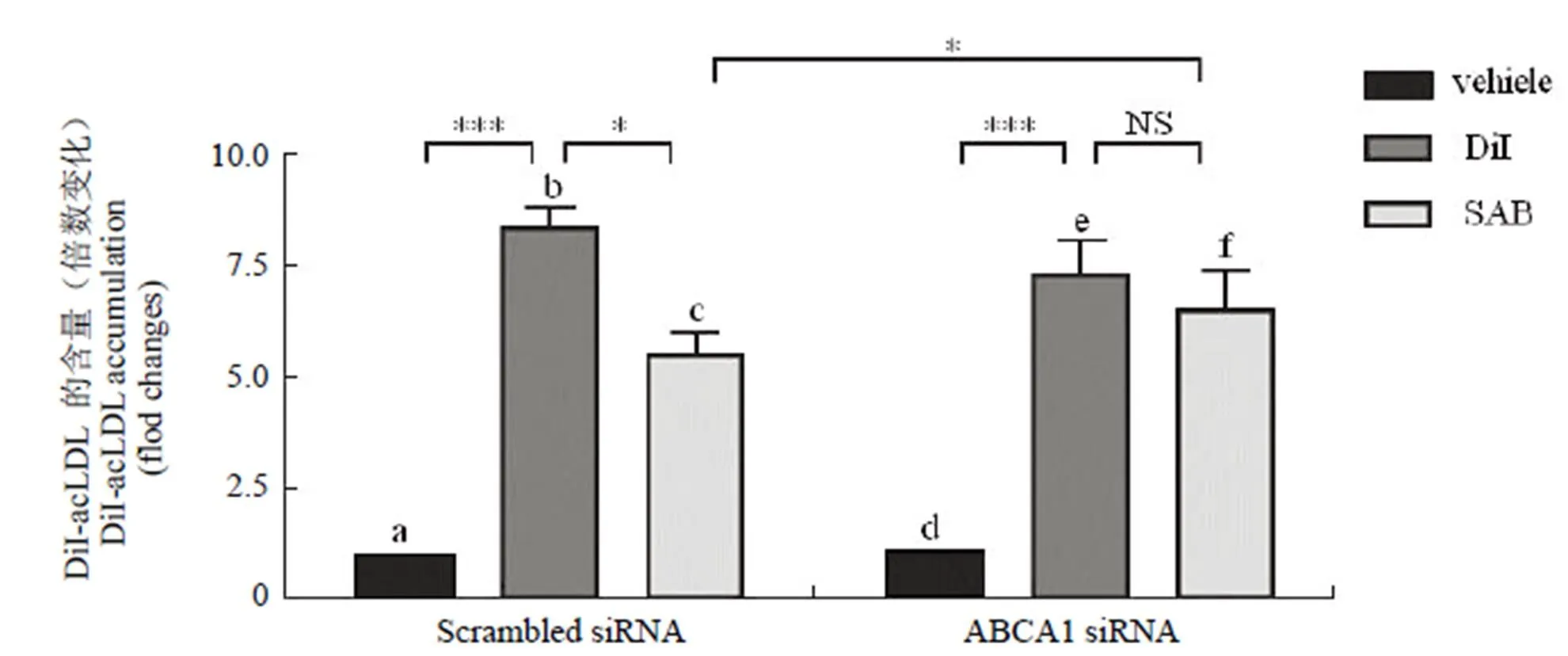
图 5 ABCA1 表达抑制对 SAB 介导的促进巨噬细胞外排 DiI-acLDL 作用的影响[*P < 0.05 和 NS 无显著差异(n = 3)]
Figure 5 The effect of SAB on the efflux of DiI-acLDL from PMA-induced THP-1 cells with/without ABCA1 siRNA [*< 0.05 and NS not significant (n = 3)]

图 6 CD36 表达抑制对 SAB 介导的巨噬细胞外排 DiI-acLDL 作用的影响[*P < 0.05,**P < 0.01,***P < 0.001 和 NS 无显著差异(n = 3)]
Figure 6 The effect of SAB on the efflux of DiI-acLDL from PMA-induced THP-1 cells with/without CD36 siRNA [*< 0.05,**< 0.01,***< 0.001 and NS not significant (n = 3)]
2.4 SAB 促进脂质外排的作用依赖于 CD36
通过 RNA 干扰的方法抑制 CD36 基因的表达,之后按照上述方法利用流式细胞技术来检测细胞充分摄取 DiI-acLDL 后 SAB 对细胞中脂质含量的影响。实验采用经160 nmol/L PMA 诱导后的 THP-1 巨噬细胞,将 CD36 siRNA 或scrambled siRNA 转染细胞 24 h 后,加入 DiI-acLDL(2 μg/ml)与 THP-1(PMA)细胞共同孵育 12 h,使细胞充分荷脂,加入 SAB(100 μmol/L)作用 24 h 后检测。结果显示,在 scrambled siRNA 对照组中,SAB 能够显著降低荷脂细胞内 DiI-acLDL 的含量(c 柱与 b 柱相比),外排率为 34.2%;而当 CD36 的表达被抑制后,SAB 促进荷脂细胞对 DiI-acLDL 外排的作用基本消失(f 柱与 e 柱相比无显著性差异),且 c 柱与 f 柱相比差异显著(图 6)。说明 SAB 促进巨噬细胞外排 DiI-acLDL 的作用依赖于 CD36。
3 讨论
丹酚酸 B 属于酚酸类化合物,为唇形科植物丹参的主要药理学活性水溶性组分之一[15]。注射用丹参多酚酸盐已在临床上被广泛应用于冠心病、心绞痛等心血管疾病的治疗,其主要成分为 SAB 镁盐(> 80%)[20]。目前普遍认为 SAB 的作用机制为其抗氧化、清除自由基的活性。本课题组前期工作中发现 SAB 通过拮抗 CD36与 oxLDL 的结合,抑制巨噬细胞对脂质的摄取,提示这可能是 SAB抗动脉粥样硬化的一个新的作用机制[18]。在此基础上,本工作发现 SAB 还可通过上调 ABCA1 的表达,从而促进荷脂细胞中脂质的外排,更进一步丰富了 SAB 在抗动脉粥样硬化过程中的作用,为 SAB 更好地应用于临床提供了新的理论依据。
ABCA1 通过将细胞中过剩的胆固醇和磷脂转运出胞,在胆固醇逆转运的起始步骤中起到关键作用。小鼠 ABCA1 功能的缺失可导致 HDL 胆固醇的不足[21]。而在 ABCA1 敲除小鼠中转入人 ABCA1,其蛋白表达水平与野生型小鼠相当,并且完全补偿了胆固醇外流活性及脂质水平[22]。另外,人 ABCA1 的基因突变可导致 Tangier 病[23]和家族性胆固醇缺失(familial HDL deficiency,FHA)[24]。这些结果说明 ABCA1 在 HDL 胆固醇代谢,尤其是外周细胞中胆固醇的外流中发挥了重要的作用,上调 ABCA1 的表达很可能成为抗动脉粥样硬化药物发现的新途径。对其调控机制研究显示,ABCA1 基因启动子区包含一个 LXR 顺式作用元件,Repa 等[25]研究发现 LXR 通过与 RXR 形成异源二聚体调控 ABCA1 的表达,激活 LXR 信号通路可增加 ABCA1 在巨噬细胞中的表达,促进胆固醇逆转运过程,加速胆固醇清除。此外,PPARγ可通过作用于 LXRα 或 CD36 的启动子区调控其表达。
在本工作中我们采用 DiI 荧光标记的脂质检测了巨噬细胞对脂质的外排作用,结果显示SAB 显著增加了荷脂细胞对 DiI-acLDL 的外排作用,推测其通过促进脂质外流在胆固醇逆转运过程中发挥了重要的作用。对脂代谢相关受体或转运蛋白表达的检测结果显示,在荷脂的 RAW 264.7 细胞中,SAB 能够以一定剂量依赖的方式增加细胞表面 ABCA1 蛋白水平的表达,因此推测 SAB 可能通过上调荷脂的巨噬细胞 ABCA1 的表达在胆固醇逆转运过程中发挥作用。进一步研究显示,上述 SAB 促进外排的作用可被 ABCA1 的抑制剂或者 siRNA 的作用消除,确证了 ABCA1 在 SAB 介导的脂质外排过程中的重要作用。
本工作首次发现,SAB 作为 CD36 拮抗剂同时在细胞脂质摄取和外排中发挥作用。前期工作已证实 SAB 介导的抑制脂质摄取作用依赖于 CD36[18],本研究发现,CD36 表达抑制后 SAB 促进外排的作用消失,说明 SAB 介导的细胞脂质的外排作用同样依赖于 CD36,提示 SAB 在细胞对脂质摄取和外排两方面的作用是相关的。CD36 作为细胞表面膜受体,在信号转导过程中也发挥了重要的作用。CD36 作为重要的信号传递受体,参与形成了复杂的信号转导调控网络[10]。另有文献[26]报道,生长激素释放多肽(GHRPs)可作为 CD36 的配基,在心血管疾病方面具有重要作用。其中,GHRP 家族的六肽化合物 hexarelin 可以与 oxLDL 竞争性结合 CD36 并影响巨噬细胞对 oxLDL 的摄取,从而发挥了保护心血管的作用[27]。由 GHRPs 家族衍生而来的 EP 80317作为 CD36 选择性配基,在拮抗 CD36 与 oxLDL 结合的同时可以通过上调 PPARγ-LXRα-ABCA1 转运蛋白的信号通路,促进胆固醇外排,从而发挥抗动脉粥样硬化活性[28-29]。Hexarelin 和 EP 80317均属多肽类,需静脉注射给药。基于本研究获得的结果,SAB 表现出类似于 EP 80317 的活性,而小分子化合物往往比多肽类化合物稳定性好且不易降解。据此推测的 SAB 介导的脂质转运相关作用通路:oxLDL 可通过 LXR 上调 ABCA1 的表达,但 oxLDL 同时可激活 CD36 正反馈调控导致 oxLDL 的无限制摄取;SAB 一方面可拮抗 CD36 对 oxLDL 的结合,另一方面,SAB 虽不能直接上调 LXR,但可能通过其他途径增加巨噬细胞表面 ABCA1 的表达,既抑制了摄取,又促进了外排。进一步信号通路的研究有待于深入开展。
综上所述,SAB 可通过竞争结合 CD36,抑制巨噬细胞对 mLDL 的摄取,同时可能影响一系列胞内信号通路,上调胆固醇逆转运过程中相关基因的表达,促进细胞胆固醇或脂质的外排,从而发挥抗动脉粥样硬化的作用,为 SAB 发挥抗动脉粥样硬化作用新机制的研究提供了重要依据。结合清除自由基、抗氧化等已知活性,SAB 在抗动脉粥样硬化药物研发方面很有广阔的发展前景。此外,SAB 还可作为工具药物,对胆固醇代谢相关信号通路研究具有重要意义。
[1] Babiak J, Rudel LL. Lipoproteins and atherosclerosis. Baillieres Clin Endocrinol Metab, 1987, 1(3):515-550.
[2] Dresel HA, Friedrich EA, Otto I, et al. The low density lipoprotein and low density lipoprotein receptors and their possible importance in the pathogenesis of atherosclerosis. Arzneimittelforschung, 1985, 35(12A):1936-1940.
[3] Tall AR. Plasma high density lipoproteins. Metabolism and relationship to atherogenesis. J Clin Invest, 1990, 86(2):379-384.
[4] Barter PJ, Rye KA. High-density lipoproteins and coronary heart disease. J Cardiovasc Risk, 1994, 1(3):217-221.
[5] Kwiterovich PO Jr. The antiatherogenic role of high-density lipoprotein cholesterol. Am J Cardiol, 1998, 82(9A):13Q-21Q.
[6] Brown MS, Goldstein JL. Receptor-mediated endocytosis: insights from the lipoprotein receptor system. Proc Natl Acad Sci U S A, 1979, 76(7):3330-3337.
[7] Faust JR, Goldstein JL, Brown MS. Squalene synthetase activity in human fibroblasts: regulation via the low density lipoprotein receptor. Proc Natl Acad Sci U S A, 1979, 76(10):5018-5022.
[8] Kunjathoor VV, Febbraio M, Podrez EA, et al. Scavenger receptors class A-I/II and CD36 are the principal receptors responsible for the uptake of modified low density lipoprotein leading to lipid loading in macrophages. J Biol Chem, 2002, 277(51):49982-49988.
[9] Febbraio M, Podrez EA, Smith JD, et al. Targeted disruption of the class B scavenger receptor CD36 protects against atherosclerotic lesion development in mice. J Clin Invest, 2000, 105(8):1049-1056.
[10] Collot-Teixeira S, Martin J, McDermott-Roe C, et al. CD36 and macrophages in atherosclerosis. Cardiovasc Res, 2007, 75(3):468-477.
[11] Glomset JA, Norum KR. The metabolic role of lecithin: cholesterol acyltransferase: perspectives form pathology. Adv Lipid Res, 1973, 11:1-65.
[12] Rosenson RS, Brewer HB Jr, Davidson WS, et al. Cholesterol efflux and atheroprotection: advancing the concept of reverse cholesterol transport. Circulation, 2012, 125(15):1905-1919.
[13] Semenuk G, Beher WT. The plasma lecithin: cholesterol acyltransferase reaction in normal, hypophysectomized and thyroidectomized rats and in hamsters. Life Sci, 1969, 8(4):183-188.
[14] Wang L, Bao Y, Yang Y, et al. Discovery of antagonists for human scavenger receptor CD36 via an ELISA-like high-throughput screening assay. J Biomol Screen, 2010, 15(3):239-250.
[15] Zhou L, Zuo Z, Chow MS. Danshen: an overview of its chemistry, pharmacology, pharmacokinetics, and clinical use. J Clin Pharmacol, 2005, 45(12):1345-1359.
[16] O K, Lynn EG, Vazhappilly R, et al. Magnesium tanshinoate B (MTB) inhibits low density lipoprotein oxidation. Life Sci, 2001, 68(8): 903-912.
[17] Yang TL, Lin FY, Chen YH, et al. Salvianolic acid B inhibits low-density lipoprotein oxidation and neointimal hyperplasia in endothelium-denuded hypercholesterolaemic rabbits. J Sci Food Agric,
2011, 91(1):134-141.
[18] Bao Y, Wang L, Xu Y, et al. Salvianolic acid B inhibits macrophage uptake of modified low density lipoprotein (mLDL) in a scavenger receptor CD36-dependent manner. Atherosclerosis, 2012, 223(1):152- 159.
[19] Chinetti G, Lestavel S, Bocher V, et al. PPAR-alpha and PPAR-gamma activators induce cholesterol removal from human macrophage foam cells through stimulation of the ABCA1 pathway. Nat Med, 2001, 7(1):53-58.
[20] Li G, Shi ZX, Yang HJ, et al. Comparative analysis on the major constituents in Radix Salviae Miltiorrhizae injectable preparations. China Pharm, 2009, 20(3):207-209. (in Chinese)
李耿, 史载祥, 杨洪军, 等. 丹参类注射剂中主要成分含量的比较分析. 中国药房, 2009, 20(3):207-209.
[21] Christiansen-Weber TA, Voland JR, Wu Y, et al. Functional loss of ABCA1 in mice causes severe placental malformation, aberrant lipid distribution, and kidney glomerulonephritis as well as high-density lipoprotein cholesterol deficiency. Am J Pathol, 2000, 157(3):1017- 1029.
[22] Coutinho JM, Singaraja RR, Kang M, et al. Complete functional rescue of the ABCA1-/- mouse by human BAC transgenesis. J Lipid Res, 2005, 46(6):1113-1123.
[23] Bodzioch M, Orsó E, Klucken J, et al. The gene encoding ATP-binding cassette transporter 1 is mutated in Tangier disease. Nat Genet, 1999, 22(4):347-351.
[24] Brooks-Wilson A, Marcil M, Clee SM, et al. Mutations in ABC1 in Tangier disease and familial high-density lipoprotein deficiency. Nat Genet, 1999, 22(4):336-345.
[25] Repa JJ, Turley SD, Lobaccaro JA, et al. Regulation of absorption and ABC1-mediated efflux of cholesterol by RXR heterodimers. Science, 2000, 289(5484):1524-1529.
[26] Bodart V, Febbraio M, Demers A, et al. CD36 mediates the cardiovascular action of growth hormone-releasing peptides in the heart. Circ Res, 2002, 90(8):844-849.
[27] Demers A, Rodrigue-Way A, Tremblay A. Hexarelin signaling to PPARgamma in metabolic diseases. PPAR Res, 2008, 2008:364784.
[28] Marleau S, Harb D, Bujold K, et al. EP 80317, a ligand of the CD36 scavenger receptor, protects apolipoprotein E-deficient mice from developing atherosclerotic lesions. FASEB J, 2005, 19(13):1869-1871.
[29] Bujold K, Rhainds D, Jossart C, et al. CD36-mediated cholesterol efflux is associated with PPARgamma activation via a MAPK- dependent COX-2 pathway in macrophages. Cardiovasc Res, 2009, 83(3):457-464.
Salvianolic acid B promotes cholesterol efflux from macrophages
WANG Li, JIANG Hua-jun, YANG Fan, DU Yu, JIA Xiao-jian, SI Shu-yi, HONG Bin
: Key Laboratory of Biotechnology of Antibiotics of Ministry of Health (WANG Li, JIANG Hua-jun, YANG Fan, DU Yu, JIA Xiao-jian, HONG Bin), National Laboratory for Screening New Microbial Drugs (SI Shu-yi), Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences, Beijing 100050, China
To investigate the effect of salvianolic acid B (SAB) on cholesterol efflux from macrophages.
The effect of SAB on cholesterol efflux from RAW 264.7 cells and PMA-induced THP-1 cells loaded with DiI-acLDL was detected by flow cytometry analysis. The expression of ABCA1 in RAW 264.7 cells regulated by SAB was detected using flow cytometry. Then ABCA1 inhibitor DIDS and ABCA1 siRNA were applied to investigate the role of ABCA1 in SAB-mediated cholesterol efflux. The role of CD36 in this process was also detected by CD36 siRNA interference.
Macrophages loaded with DiI-acLDL were used and the DiI fluorescence in the macrophages or medium was detected respectively. The results showed that SAB significantly promoted cholesterol efflux from DiI-acLDL-loaded macrophages. The expression of transporters in lipid metabolism was also detected. SAB upregulated ABCA1 protein level in lipid-rich RAW 264.7 cells in a dose-dependent manner. Further investigation using ABCA1 inhibitor or siRNA revealed that ABCA1 played an important role in SAB mediated cholesterol efflux. Similar role of CD36 in this process was testified by attenuating CD36 mRNA level, implicating that the cholesterol efflux mediated by SAB was dependent on CD36.
SAB promotes cholesterol efflux from macrophages through upregulating ABCA1 expression, which is dependent on ABCA1 and CD36, providing an important basis for the investigation of novel anti-atherosclerosis mechanisms of SAB.
Atherosclerosis; Salvianolic acid B; ATP-binding cassette transporter A1; Antigens, CD36; Reverse cholesterol transport
HONG Bin, Email: binhong69@hotmail.com
国家自然科学基金(81102442);2011 年度协和青年科研基金;“重大新药创制”科技重大专项“十二五”实施计划(2012ZX09301002-003、2012ZX09301002-001)
洪斌,Email:binhong69@hotmail.com
2012-12-07
10.3969/cmba.j.issn.1673-713X.2013.02.004
