红曲霉固态发酵生产MonacolinK的工艺优化
2013-07-12殷军帅梁秋丽方佳茂罗石柱孙中涛
殷军帅,梁秋丽,方佳茂,罗石柱,孙中涛,*
(1.山东农业大学生命科学学院,山东 泰安 271018;2.广东环西生物工程有限公司,广东 普宁 515300)
Monacolin K 又 称Lovastatin、mevinolin 和Mevacor,是一种抑制胆固醇合成的药物,最初由日本学者远滕章(Akira Endo)于1979 年从红曲霉(Monascus ruber)的次级代谢产物中发现[1],随后陆续从土曲霉(Aspergillus terreus)、青霉属(Penicillium)和木霉属(Trichoderma) 等真菌的次级代谢产物中发现[2]。Monacolin K 可通过竞争性抑制胆固醇合成限制酶—3-羟基-3-甲基戊二酰辅酶A 还原酶(HMG-CoA)的活性而抑制胆固醇的合成,从而降低人类和动物的血浆胆固醇水平[3-4]。此外,Monacolin K 还具有抑制肿瘤,预防和治疗动脉硬化、冠心病、高血压、肥胖症等作用[5-8]。
目前,Monacolin K 主要是以红曲霉通过固态发酵或液态发酵的方式进行生产。欧美等西方国家推崇液态发酵,主要是因为其自动化程度高、劳动强度低、生产效率高;但液态发酵设备投资大、能耗高、发酵液产物浓度低,提取困难、生产成本高。固态发酵具有液态发酵不可比拟的优势,主要是设备投资小、能耗低、生产过程节水、生产成本低、无废水废渣产生、不会造成二次污染,并且固态发酵的产物可以全部被利用,从而省去了复杂的提取过程,可进一步降低生产成本[9-10]。因此,固态发酵是国内Monacolin K 最主要的生产方式。
Plackett-Burman 实验设计与响应面法(response surface methodology,RSM)已广泛地应用于发酵工艺优化,其中包括Moancolin K 的液态发酵工艺[11-12],但少有用于Moancolin K 固态发酵工艺优化的报道[13]。本篇论文采用Plackett-Burman 与Box-Benhnken 实验设计对红曲霉固态发酵生产Monacolin K 的工艺进行了系统的优化,以提高Monacolin K 的产量,降低生产成本。
1 材料与方法
1.1 材料
1.1.1 菌种
红色红曲霉(Monascus ruber MY-01):由山东农业大学生命科学学院发酵工程研究室分离保存。
1.1.2 培养基
菌种保藏培养基:马铃薯葡萄糖琼脂培养基(PDA);种子培养基(g/L):葡萄糖30、蛋白胨20、硝酸钠2、磷酸二氢钾1、硫酸镁1、pH 自然;固体发酵基础培养基:市售粳米50 g,放于250 mL 的三角瓶中,加水浸泡2 h,于0.08 MPa 灭菌20 min[14]。
1.1.3 主要仪器和试剂
LC-310 液相色谱仪:江苏天瑞仪器股份有限公司;HH-4 型数显恒温水浴锅:龙口市先科仪器公司;DHZ-D 大容量全温振荡器:太仓市实验设备厂;HJ-CF-2D 型双人净化工作台:上海苏净实业有限公司;Monacolin K 标准样:浙江海正药业;甲醇、乙腈为国产色谱纯;葡萄糖、麦芽糖、甘油、蔗糖、蛋白胨、无水乙醇、无机盐等试剂均为国产分析纯。
1.2 方法
1.2.1 培养方法
斜面培养:挑取1 环新鲜菌种接种于菌种保藏培养基,30 ℃恒温培养7 d。三角瓶种子培养:将斜面菌种用5 mL 无菌水洗下孢子,吸取1 mL 接种于装有200 mL 种子培养基的500 mL 三角瓶中,30 ℃、150 r/min恒温培养48 h。固态发酵:将三角瓶种子液接种于装有50 g 发酵培养基的250 mL 三角瓶中,于30 ℃的恒温培养12 d。
1.2.2 Monacolin K 的检测[2]
准确称取MonacolinK 标准样品0.0200 g,于100 mL的容量瓶中用甲醇定容,配成浓度为0.2 mg/mL 的标准溶液。
固态发酵样品于40 ℃烘干至恒重,研磨成粉末,取2 g 粉末样品加入装有100 mL 甲醇∶蒸馏水(1∶1,体积比)萃取液的250 mL 三角瓶中,于30 ℃,200 r/min萃取2 h,然后10 000 r/min 离心10 min,取上清液用0.45 μm 微膜过滤,收集滤液待测。Monacolin K 检测采用高效液相色谱法,色谱柱为C18柱,流动相为0.02 mol/L 磷酸缓冲液(pH 7.7)∶乙腈=65∶35(体积比);紫外检测器的波长为238nm,体积流量为1mL/min。
1.2.3 干重减重
固态培养时,直接测量丝状真菌的生物量十分困难,这是因为很难从固体基质中将菌丝体分离出来。Terebiznik and Pilosof[15]发现菌丝体的生长量与基质的干重减重呈正相关,因此可以通过测定基质的干重减重来间接反映真菌在固态发酵体系中的生长状况。
1.2.4 最佳附加碳源与氮源的选择
在基础培养基的基础上,分别加入2%(质量分数)的葡萄糖、蔗糖、可溶性淀粉、甘油、麦芽糖、乳糖,按上述方法进行固态发酵实验,以确定最佳附加碳源的种类,然后再通过0%、2%、4%、6 %、8 %、10 %、12%(质量分数)等7 个水平的单因素试验确定其最佳用量。
在最佳附加碳源优化结果的基础上,分别加入1 %(质量分数)的蛋白胨、酵母浸粉、硝酸铵、氯化铵、硝酸钠,按上述方法进行固态发酵实验,以确定最佳附加氮源的种类,然后再通过0 %、1 %、2 %、3 %、4 %、5%(质量分数)等6 个水平的单因素试验确定其最佳用量。
1.2.5 Plackett-Burman 试验设计
在单因素试验的基础上,采用7 因素的Plackett-Burman 试验设计,考察培养基含水量、装瓶量、接种量、pH、温度、附加碳源和氮源等因素对Monacolin K产量的影响,以确定其显著因素。各因素及其水平见表1。试验设计和数据分析均采用软件Design Expert 7.1(Stat-Ease Corp.,Minneapolis,MN,USA)。
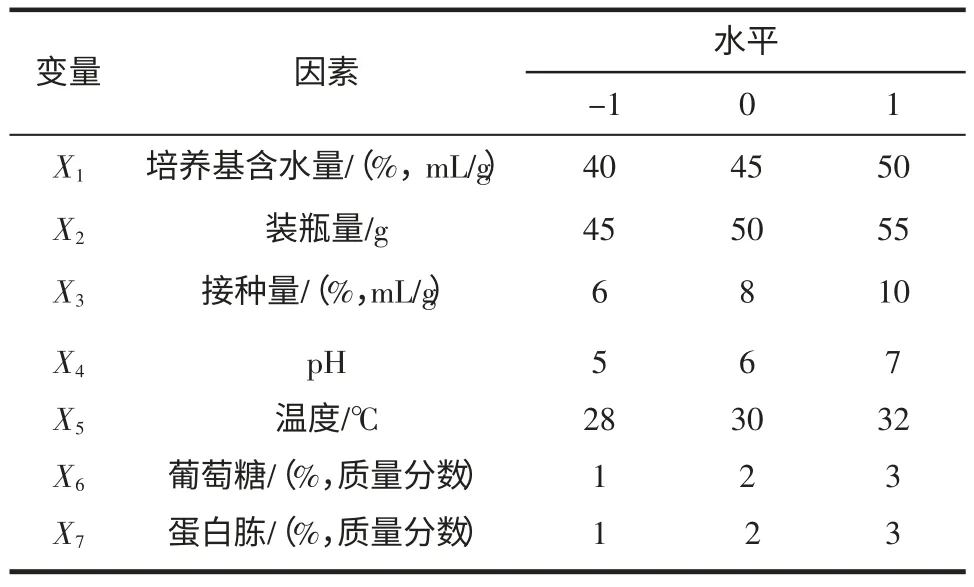
表1 Plackett-Burman 试验的因素和水平Table 1 The coded and uncoded values of factors in Plackett-Burman design
1.2.6 Box-Behnken 试验设计
在Plackett-Burman 实验的基础上,采用Box-Behnken 中心组合设计对影响Monacolin K 产量的3个显著性因素作进一步的优化,实验因素与水平见表2。采用最小二乘法对实验数据进行拟合得二元多项方程为:
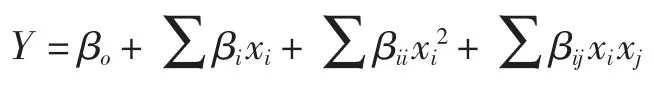
式中:Y 为Monacolin K/(mg/g);xi,xj为自变量代码值;βo为常系数;βi为线性系数;βii为二次项系数;βij为交互项系数。实验设计和数据分析均采用软件Design Expert 7.1 (Stat-Ease Corp.,Minneapolis,MN,USA)。

表2 Box-Behnken 试验的因素和水平Table 2 Experimental ranges and levels of the independent variables in Box-Behnken design
1.2.7 发酵时间对基质干重减重和Monacolin K 产量的影响
取数个三角瓶,按照所优化后的条件进行发酵。从第1 天开始,每隔1 天取1 次样,每次做3 个平行。按上述方法检测并分析数据,以探讨发酵时间对基质干重减重和Monacolin K 产量的影响。
2 结果与分析
2.1 附加碳源对Monacolin K 产量的影响
本实验向基础培养基中添加的数种附加碳源对Monacolin K 产量的影响见图1 所示。
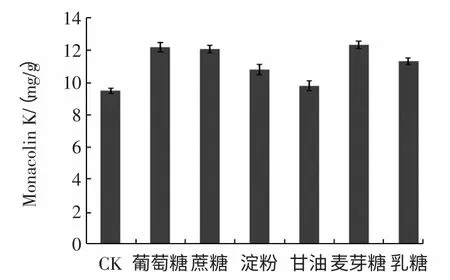
图1 附加碳源对Monacolin K 产量的影响Fig.1 Effect of extra carbon sources on the production of Monacolin K
由图1 可知,附加碳源葡萄糖、蔗糖、淀粉、麦芽糖、乳糖等碳源均可显著提高发酵水平(P<0.01),其中以添加葡萄糖、蔗糖和麦芽糖时Monacolin K 的产量最高,三者之间差异不显著(P>0.01)。综合考虑生产成本,我们选用价格较低的葡萄糖为最适附加碳源。此结果与魏培莲等[16]的研究结果一致,但在熊晓辉等[17]的研究中甘油是最佳碳源,这可能因为所采用的红曲霉菌株不同,其生理特性存在差异。另外,通过实验可知附加碳源葡萄糖的添加量对红曲霉生长量和Monacolin K 的产量有很大的影响,见图2。
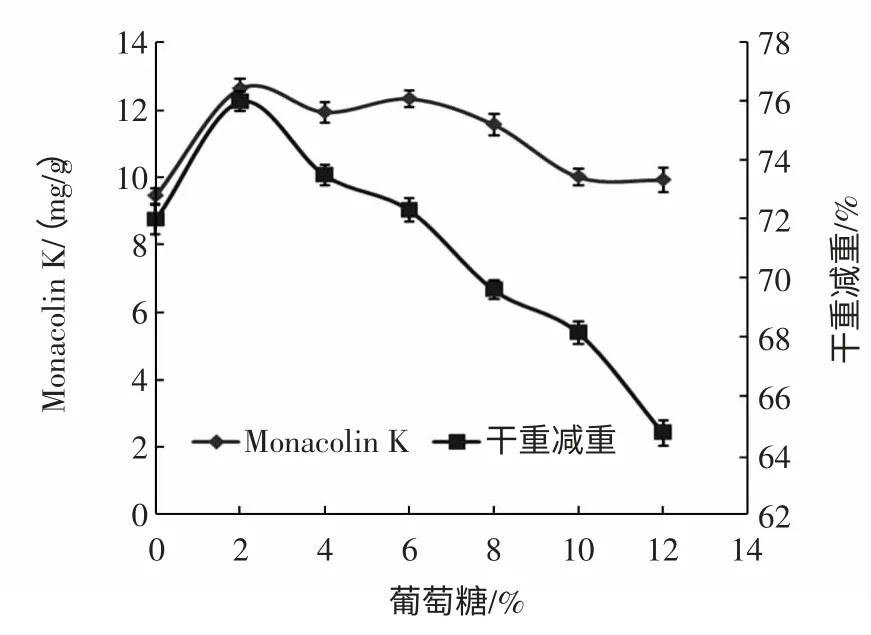
图2 葡萄糖含量对Monacolin K 产量与干重减重的影响Fig.2 Effect of glucose on the production of Monacolin K and dry matter weight loss
由图2 可知,当葡萄糖的含量为2%(质量分数)时,基质的干重减重最大,红曲霉菌丝体生长最好,此时的Monacolin K 的产量最高,为12.62 mg/g。
2.2 附加氮源对Monacolin K 产量的影响
本实验向基础培养基中添加的数种附加氮源对Monacolin K 产量的影响见图3 所示。
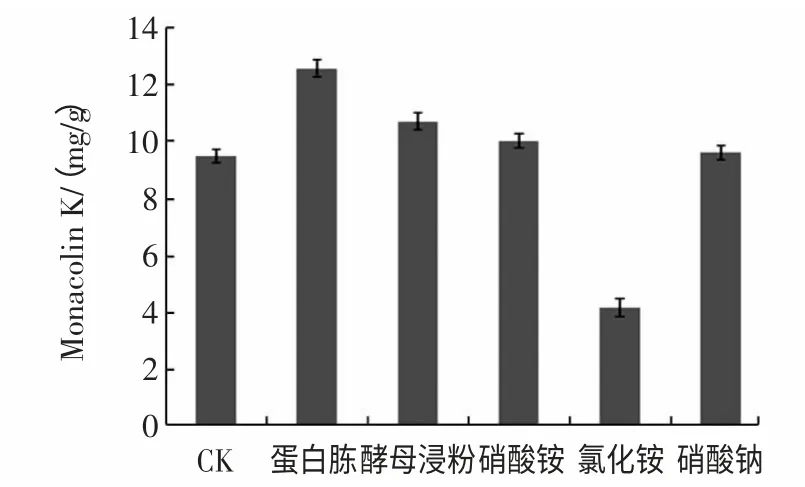
图3 附加氮源对Monacolin K 产量的影响Fig.3 Effect of extra nitrogen sources on the production of Monacolin K
由图3 可知,蛋白胨作为附加氮源时,Monacolin K的产量远高于酵母浸粉、硝酸铵、氯化铵和硝酸钠等作为附加氮源时Monacolin K 的产量,其差异达到了显著水平(P<0.01)。此结果与董永胜等[18]的研究结果一致,但在熊晓辉等[17]的研究中,玉米浆是最佳氮源,这表明不同的生产菌株,其最适氮源也存在差异。蛋白胨含量对Monacolin K 产量与干重减重的影响见图4。
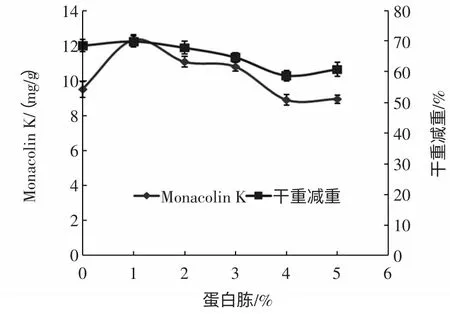
图4 蛋白胨含量对Monacolin K 产量与干重减重的影响Fig.4 Effect of peptone on the production of Monacolin K and dry matter weight loss
由图4 可知,蛋白胨的添加量对红曲霉生长量和Monacolin K 的产量有很大的影响,其中当蛋白胨的含量为1%(质量分数)时,红曲霉菌丝体生长的最好,基质的干重减重最大,此时Monacolin K 的产量最高,为12.34 mg/g。
2.3 Plackett-Burman 试验结果
Plackett-Burman 试验结果如表3 所示,采用Design Expert 7.1 软件对试验数据进行一次多项回归拟合,获得一次回归方程:
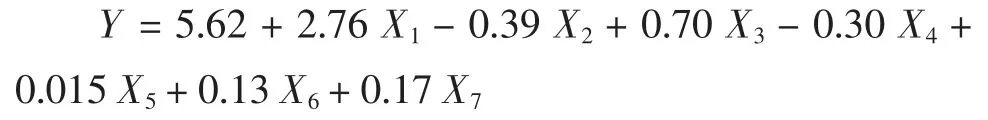
式中:Y 为Monacolin K,(mg/g);X1~X7为自变量的编码值。该回归模型极显著(P<0.01),失拟项不显著(P>0.05),相关系数R2=0.982 7,这表明其拟合度和可信度均很高,实验中98.27%的变异可由该模型进行解释。
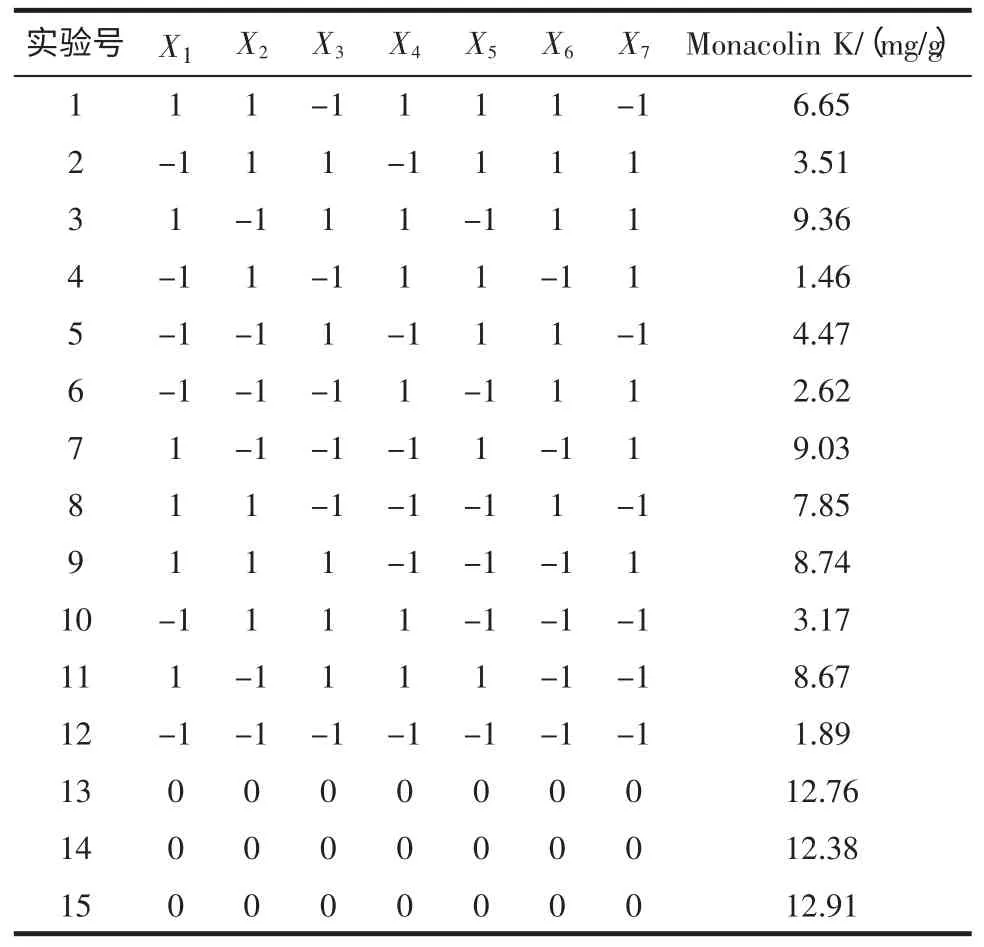
表3 Plackett-Burman 试验设计与结果Table 3 The design and results of Plackett-Burman design for the production of Monacolin K
方程系数的方差分析结果如表4 所示。
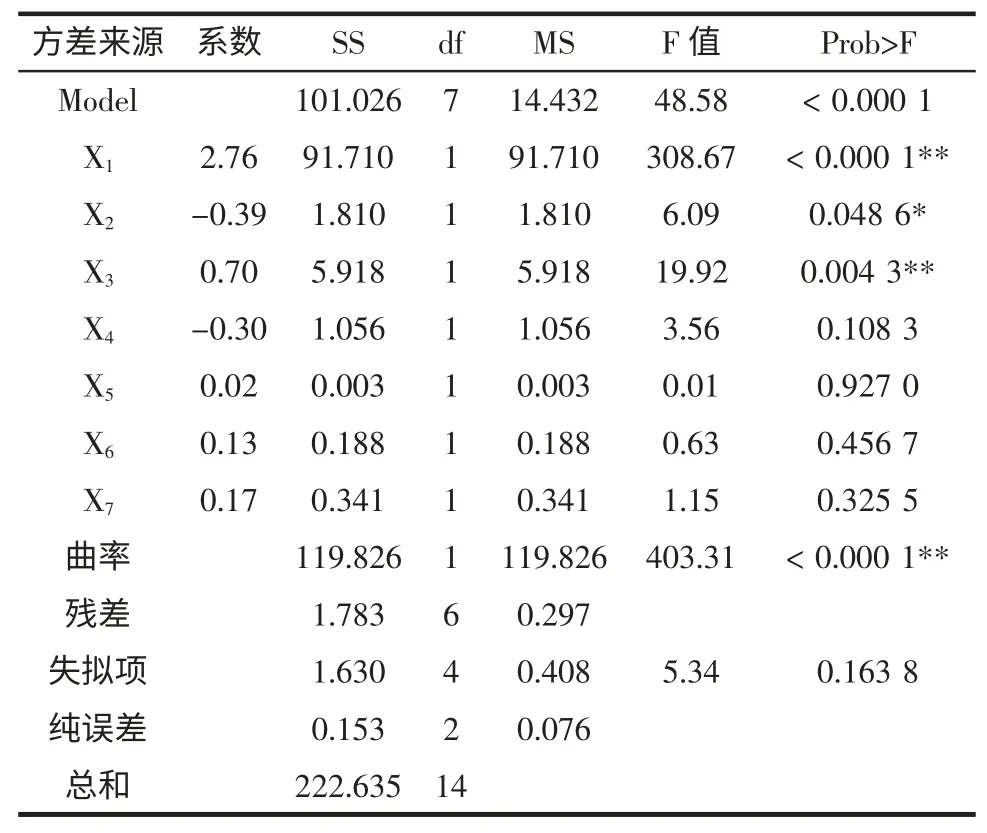
表4 Plackett-Burman 试验回归分析结果Table 4 Results of the Plackett-Burman design regression analysis for the production of Monacolin K
培养基含水量(X1)与接种量(X3)对Monacolin K产量的影响达到了极显著水平(P<0.01),为正效应,装瓶量(X2)为显著水平(P<0.05),是负效应;但其它各因素的影响均不显著(P>0.05)。显著性因素(X1、X2与X3)将采用响应面法进一步优化。非显著性因素中X4为负效应,后续实验直接采用Plackett-Burman 设计中的低水平为最佳水平,即pH 5;X5、X6、X7为正效应,但因为其为非显著因素,考虑到生产上节约成本,后续实验也直接采用Plackett-Burman 设计中的低水平为最佳水平,即28 ℃、葡萄糖1%(质量分数)、蛋白胨1%(质量分数)。
2.4 Box-Behnken 中心组合试验
根据Plackett-Burman 试验选出的显著因素,对X1、X2和X3采用3 因素3 水平的响应面分析方法进行发酵条件的优化。为使拟合方程具有旋转型和通用性,中心点重复5 次。实验设计及结果见表5。利用Design Expert 7.1 统计软件对表5 实验数据进行回归拟合,二次回归模型的方差分析见表6。
通过Design Expert 7.1 软件对表5 的实验数据进行二次多项回归拟合,获得Y 对X1(培养基含水量)、X2(装瓶量)和X3(接种量)3 个因素的二次多项式回归方程为:
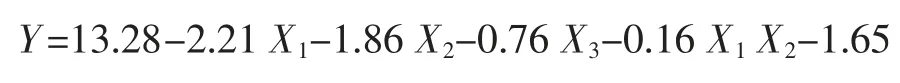
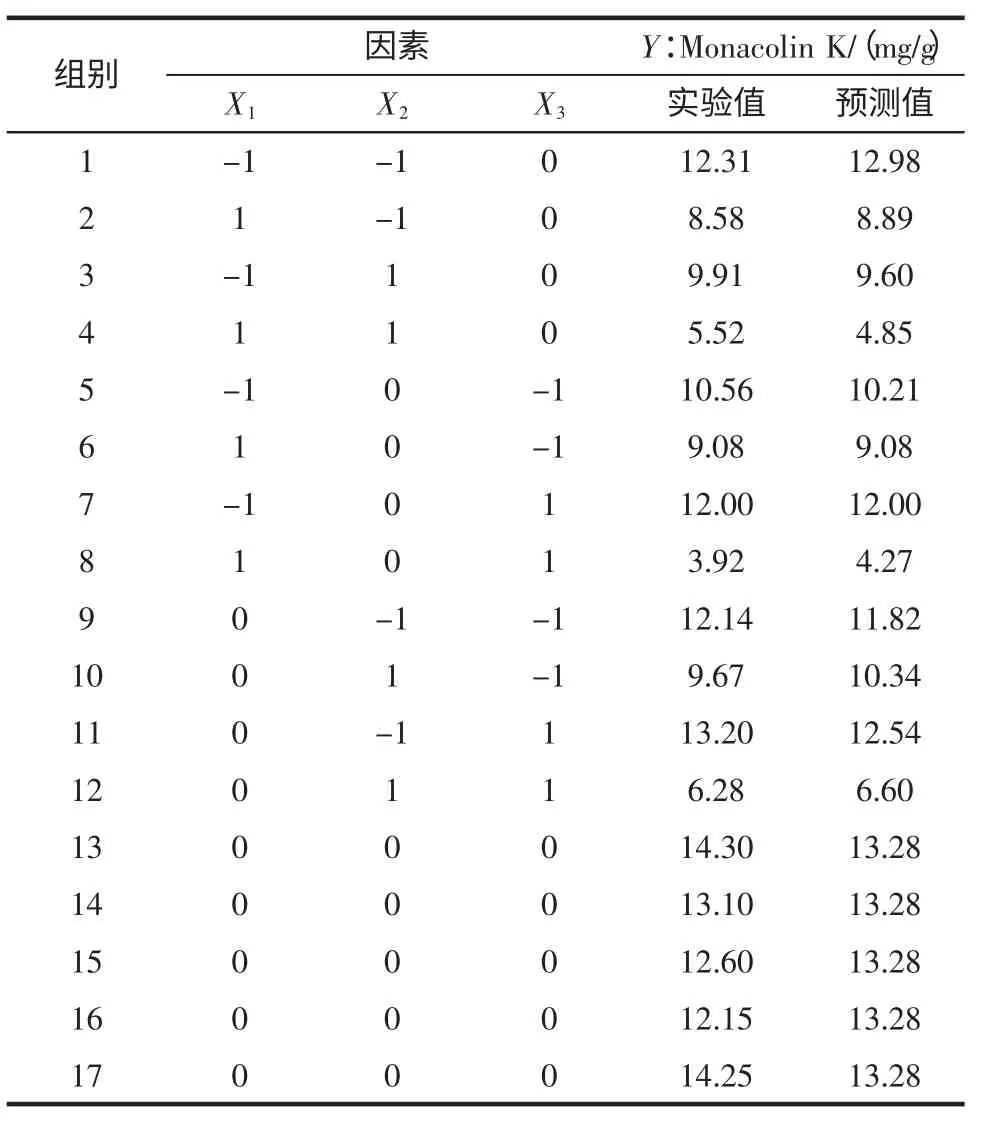
表5 响应面分析实验设计和结果Table 5 Experimental design and results of Box-Behnken designed experiments for the production of Monacolin K
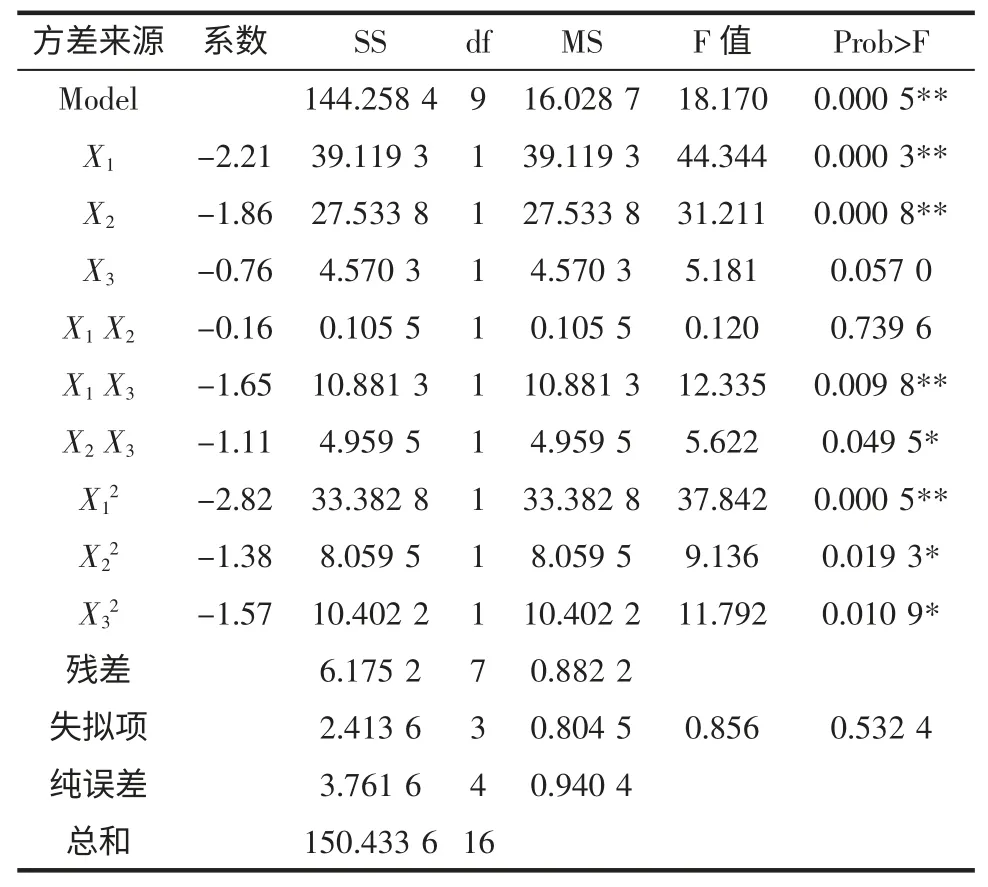
表6 二次回归模型的回归分析结果Table 6 Regression results from the data of Box-Behnken designed experiments
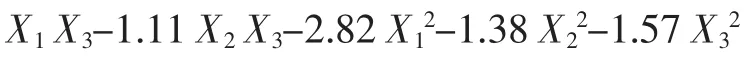
式中:Y 为Monacolin K,(mg/g);X1、X2与X3为自变量的编码值。
由表6 方差分析可知,回归模型极显著(P<0.01)、失拟项不显著(P >0.05)、模型相关系数R2=0.959 0,可知回归方程拟合度和可信度均很高,能够很好的对Monacolin K 的发酵工艺进行预测。由回归模型系数显著性检验结果可知,模型的一次项(X1、X2)、交互项(X1X3、X2X3)与二次项对Monacolin K 产量的影响显著(P<0.05),而一次项X3与交互项X1X2影响不显著(P>0.05)。表明各影响因素对产Monacolin K 的影响不是简单的线性关系。由二次回归方程可知,二次项系数为负,说明抛物面开口向下,有最大值。求解二次回归方程,可求出各因素的最佳水平(编码值):X1=-0.45、X2=-0.75、X3=0.26,解码后可得其真实值,即:培养基含水量42.77%(mL/g)、装瓶量46.26 g/(250 mL 三角瓶)、接种量8.52%(mL/g)。在此最佳条件下,模型预测的Monacolin K 的最大值为14.37 mg/g。为验证模型预测结果的准确性,采用上述最佳条件进行了3 次验证实验,实测值为(14.03±0.53)mg/g,与预测值十分接近,这说明该模型是准确有效的。
为了更直观地描述X1、X2和X33 个因素对响应值的影响,利用Design Expert 7.1 软件绘制各因子对Monacolin K 的响应面图,如图5 所示,响应面存在最大值,即为模型所预测的最佳水平点。
2.5 发酵时间对干重减重和Monacolin K 产量的影响
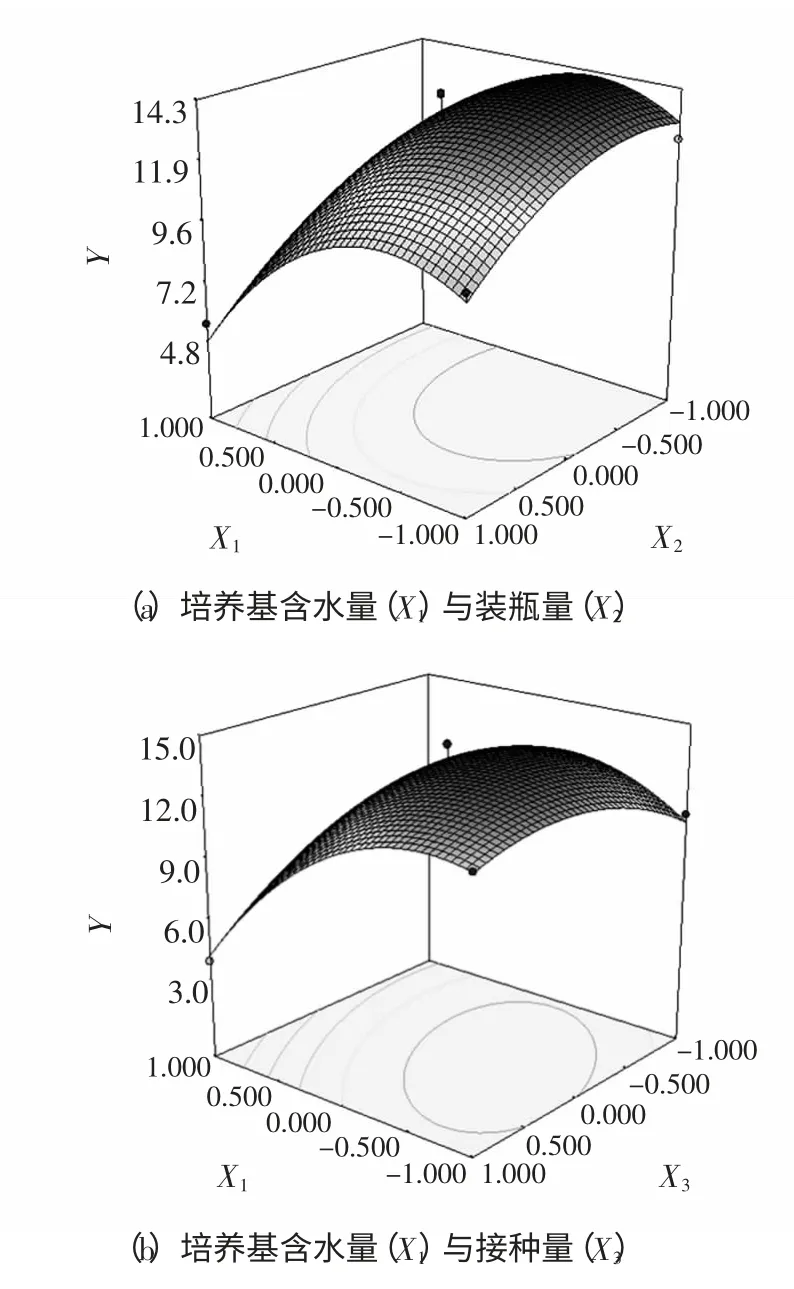
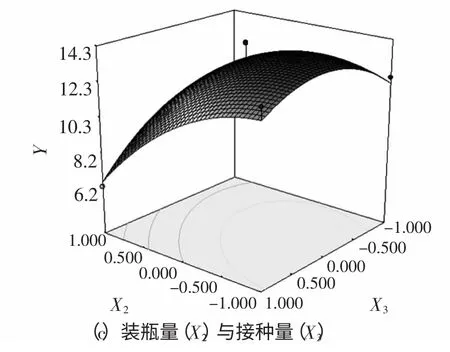
图5 培养基含水量、装瓶量与接种量影响Monacolin K 产量的响应面图Fig.5 Response surface plot for the production of Monacolin K in terms of the effects of initial moisture content,bottle load and inoculation
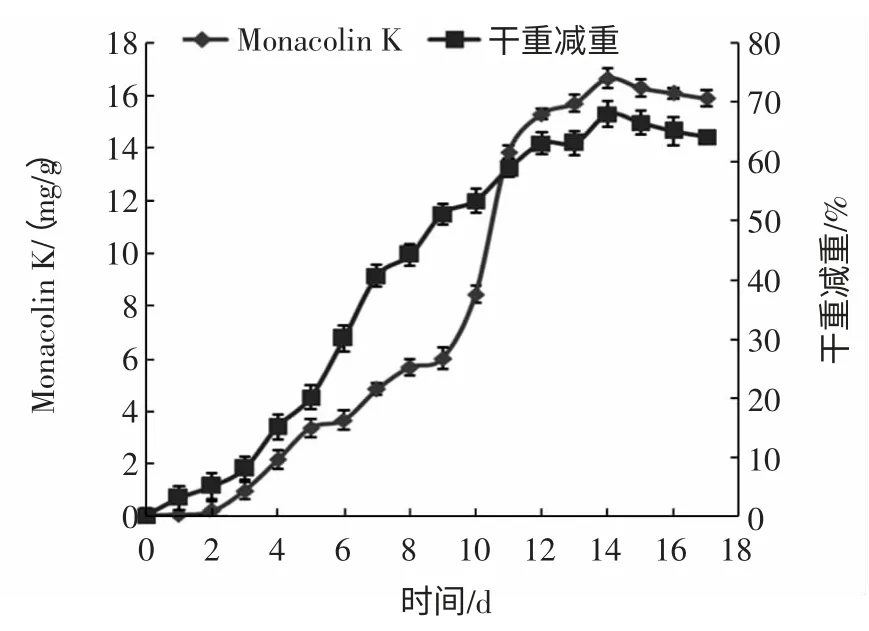
图6 发酵时间对干重减重和Monacolin K 产量的影响Fig.6 Effect of incubation time on the dry matter weight loss and production of Monacolin K
发酵时间对干重减重和Monacolin K 产量的影响如图6 所示,前3 天菌体生长处于延迟期,基质干重减重很小,几乎没有Monacolin K 产生;3 d~12 d 菌体生长进入对数期,干重减重迅速增加。发酵前期(0 d~3 d)Monacolin K 仅有少许产生,但在发酵中后期(5 d~12 d)Monacolin K 大量产生。12 d 后,基质的干重减重和Monacolin K 的增长速度均逐渐减慢,在第14 天时,Monacolin K 的产量达到最高,为(16.67±0.36)mg/g。
3 结论
本文通过单因素试验、Plackett-Burman 与Box-Behnken 试验设计对红曲霉MY-01 固态发酵生产Monacolin K 的工艺条件进行了系统优化,确定了其最佳生产工艺:培养基含水量42.77%(mL/g)、装瓶量46.26 g/(250 mL 三角瓶)、接种量8.52%(mL/g)、pH 5、葡萄糖1%(质量分数)、蛋白胨1%(质量分数),于28 ℃恒温培养14 d,Monacolin K 含量可达(16.67±0.36)mg/g,比基础培养基提高了47.7%。此发酵水平远高于目前文献报道的Moancolin K 固态发酵的生产水平[9,16-18],对Moancolin K 的工业生产具有一定的指导意义。
[1]Hsin-Ping Ou,Chiun-C R Wang,Lih-Shiuh Lai.Thermal degradation kinetics analysis of Monacolin K in Monascus-fermented products[J].LWT-Food science and technology,2009,42(1):292-96
[2]Valera HR,Gomes J,Lakshmib S,et al.Lovastatin production by solid state fermentation using Aspergillus flavipes[J].Enzyme and microbial technology,2005,37(5):521-26
[3]Seraman S,Rajendran A,Thangavelu V.Statistical optimization of anticholesterolemic drug lovastatin production by the red mold Monascus purpureus[J].Food and bioproducts processing,2010,88(2/3):266-76
[4]Chang Y N,Huang J C,Lee C C,et al.Use of response surface methodology to optimize culture medium for production of lovastatin by Monascus rubber[J].Enzyme and microbial technology,2002,30(7):889-894
[5]Jones K D,Couldwell W T,Hinton D R,et al.Lovastatin induces growth inhibition and apoptosis in human malignant glioma cells[J].Biochem Biophys Res Commum,1994,205(3):1681-1687
[6]张萍,糜漫天,韦娜,等.洛伐他汀对MCF-7 细胞pRb 蛋白表达及增殖功能的影响[J].中国公共卫生,2002,18(10):1198-1200
[7]丘振宇,王亚琴,许喜林.红曲霉中Monacolin K 的应用研究[J].中国酿造,2007(5):4-6
[8]徐伟,王金凤,易曼.红曲霉玉米发酵产Monacolin K 最佳条件研究[J].哈尔滨商业大学学报:自然科学版,2008,24(2):207-209
[9]董文宾,陶璐,张建华,等.红曲霉菌固体发酵产Monacolin K 工艺的优化[J].现代食品科技,2007,23(8):32-35
[10]季宏飞,许杨,李燕萍.采用响应面法优化红曲霉固态发酵产红曲色素培养条件的研究[J].食品科技,2008,33(8):9-13
[11]童振宇,周立平,陈旭峰.响应面法优化红曲霉菌株Monacus purpureus WX 液态发酵产Monacolin 工艺条件[J].浙江工业大学学报,2007,35(1):35-40
[12]邱源,周立平,嘉晓勤.红色红曲菌液态发酵产Monacolin K 重要影响因素的研究[J].酿酒科技,2010(5):47-50
[13]甘锋,唐建忠,王轩,等.响应面法优化红曲霉固态发酵产Monacolin K 工艺条件的研究[J].中国食品添加剂,2011(1):131-136
[14]李钟庆,杨晓暾,郭芳.综观红曲与红曲菌[M].北京:中国轻工业出版社,2009:9-10
[15]Terebiznik MR,Pilosof AMR.Biomass estimation in solid state fermentation by modeling dry matter weight loss[J].Biotechnology techniques,1999,13(3):215-219
[16]魏培莲,周立平,岑沛霖.红曲霉固态发酵产Lovastatin 的培养条件[J].食品与发酵工业,2004,30(4):32-35
[17]熊晓辉,张李阳,韦策,等.红曲霉菌产Monacolin K 固体发酵条件的优化[J].无锡轻工大学学报,2004,23(1):9-13
[18]董永胜,刘同军,贾士儒.红曲霉固态发酵生产Monacolin K 工艺条件的研究[J].食品研究与开发,2007,28(6):27-30
