胡萝卜MADS-box基因的克隆及表达分析
2013-07-12刘雪莹李景富徐启江张洪伟
梁 毅,刘雪莹,2,李景富,徐启江,张洪伟
(1.北京市农林科学院蔬菜研究中心,北京 100097;2.东北农业大学园艺学院,哈尔滨 150030;3.东北林业大学生命科学院,哈尔滨 150040)
MADS-box基因是一类广泛存在于植物中的序列特异同源异型基因。由保守程度不同的MADS-box、I、K和C结构组成[1]。通过对MADS-box基因家族的深入研究,在不同物种中克隆大量MADS-box基因,这些结果表明MADS-box基因在被子植物中的功能是保守的,大部分都参与花发育调控过程,并且在根、叶、胚珠及果实的发育中均起作用[2]。
近年来,植物花发育分子机制研究取得较大进展,其中双子叶植物拟南芥、矮牵牛、金鱼草的花同源异型突变体研究确定ABCDE模型[3-4],初步揭开植物花发育的奥秘。该模型认为,A和E功能基因调控萼片发育,A、B和E功能基因调控花瓣发育,B、C和E功能基因调控雄蕊发育,C和E功能基因调控心皮发育,C、D和E功能基因调控胚珠发育,A和C功能基因相互拮抗。当A基因发生突变时,C基因表达便会扩展,导致萼片异化为心皮,花瓣变为雄蕊;B基因发生突变则会使花瓣变成萼片,雄蕊变成心皮;若C基因突变,则致使A基因表达扩展,雄蕊和心皮分别被花瓣和萼片代替。除APETALA2基因外,所有的花器官特征属性基因均编码MADS-box转录因子,具有典型的MIKC结构域模型[5-6]。研究表明,许多心皮型CMS系统中,B类MADS-box转录因子的表达量都趋于下降[7-8];根据ABCDE模型,若A基因被扩展到雄蕊,同时C基因被限制在心皮,则可产生雄蕊瓣化型的突变体[9]。
胡萝卜(Daucus carrot),又称甘荀,是伞形科野生胡萝卜变种的一、二年生异花授粉草本植物,栽培历史在2 000年以上。胡萝卜花是复伞形花序顶生、花极小、白色或淡粉色[10]。胡萝卜雄性不育的花有别与野生型而出现雄蕊瓣化现象,为进一步探究胡萝卜花发育有关机制,采用RACE原理,克隆胡萝卜相关MADS-box基因的全长cDNA,为胡萝卜采用基因工程进行辅助育种提供一定的理论基础。
1 材料与方法
1.1 试验材料
胡萝卜品种由北京市农林科学院蔬菜研究中心洋葱与胡萝卜课题组提供。采集花蕾及成花的各部分器官萼片、心皮、雄蕊,以及营养器官根、茎、叶。采集后用锡箔纸包装后放入液氮中,存于-80℃冰箱中,用于总RNA提取。
1.2 cDNA的合成和cDNA全长的获得
RNA提取采用TRIZOL试剂盒,具体步骤参见操作手册。以RNA为模板,利用引物5'GACTCGA GTGCACATCGA(T)173'合成cDNA的第一条链。进行3'-RACE时,以第一链cDNA为模板,利用MADS-box基因简并引物AD、SP3分别与P18E配对进行PCR扩增,扩增片段经溶胶回收克隆到pGEM®-T载体(TaKaRa)。根据测序结果,设计引物GSP1、GSP2并进行巢式PCR,具体试验步骤根据5'-full RACE kit(TaKaRa)试剂盒进行操作。获得5'-序列后,将5'-与3'-序列进行拼接,从而获得cDNA全长。试验中使用的引物见表1。
1.3 胡萝卜MADS-box基因表达RT-PCR分析
分别提取胡萝卜的根、茎、叶、萼片、雄蕊、和心皮等器官的总RNA,选用cDNA合成试剂盒(TaKaRa),分别以各样品总RNA为模板、Oligo(dt)20为引物合成第一链cDNA。以cDNA为模板进行 RT-PCR。总体系为 25 μL,包括 2.5 μL 10×缓冲液(加Mg2+),2.0 μL dNTP上下游特异引物(2.0 mmoL·L-1)各0.8 μL,模板cDNA 1.0 μL,0.4 μL ExTaq酶(5 U·mL-1,TaKaRa),加灭菌蒸馏水至总体积25 μL。在反应液上覆盖一薄层液体石蜡油,保证PCR反应时体系的稳定性。扩增产物经1.0%琼脂糖凝胶电泳后在紫外灯下进行检测。使用肌动蛋白ACTIN作为内参,试验中使用的引物见表1。
2 结果与分析
2.1 胡萝卜MADS-box基因序列的分析
将胡萝卜花芽总RNA(见图1A)反转为cDNA,以cDNA第一条链为模板进行3'-RACE时PCR扩增产物的大小约为900 bp(见图1B),5'-RACE的PCR扩增产物大小约为400 bp(见图1C)。将上述两片段拼接,获得其全长cDNA序列。在NCBI上对该cDNA序列进行Blast分析,并将其推导的氨基酸序列与已知的MADS-box蛋白在DNAMAN中进行同源性比对,构建系统进化树。经上述分析可知,所得序列中有两个序列具有MADS-box的保守区域和K区,其核苷酸序列分别与金鱼草的DEFH49和拟南芥的AGL6同源性很高,故将两个基因分别命名为DcSEP1和DcAGL6。

表1 试验过程中涉及的引物Table 1 Primers used in the experiment
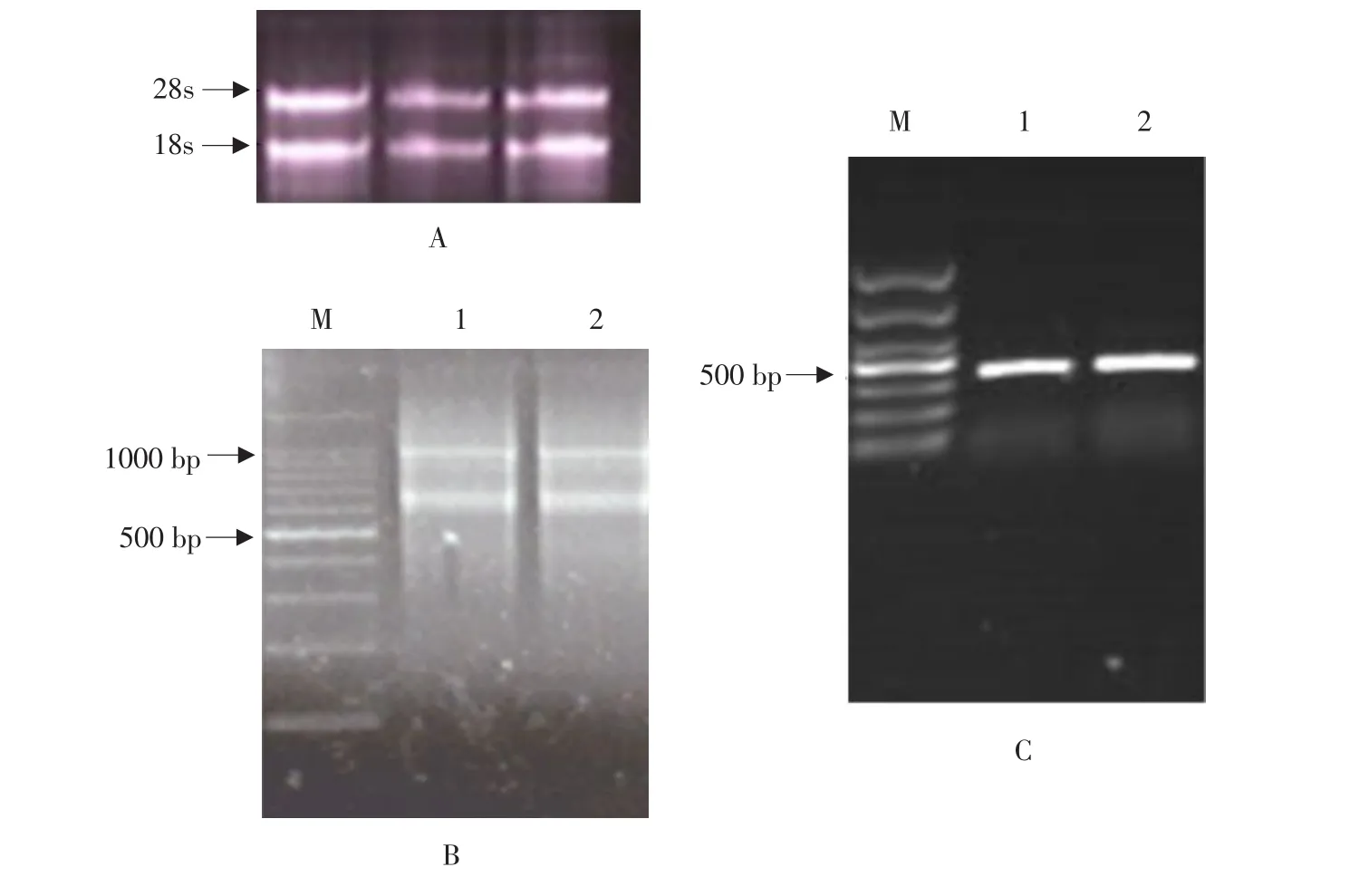
图1 胡萝卜花芽总RNA(A)、3'-RACE PCR产物(B)和5'-RACE PCR产物(C)电泳Fig.1 Electrophoresis of total RNA extracted from carrot flower bud(A),3'-RACE PCR products(B)and 5'-RACE PCR products(C)
DcSEP1(见图2)的cDNA全长1 084 bp,3'-端非翻译区为180 bp,poly(A)尾长19个腺苷酸,编码区753 bp,对应编码251个氨基酸,编码的蛋白质含有59个氨基酸的MADS区域,34个氨基酸的I区,65个氨基酸的K区,与拟南芥的SEPALLATA 3、杧果的SEPALLATA1-like、葡萄的SEPALLATA 1、矮牵牛的MADS-box同源性分别为60.23%、56.52%、70.24%和74.31%。

图2 DcSEP1的核苷酸序列、推导的氨基酸序列及其与其他SEP-like蛋白的同源比对Fig.2 Nucleotide sequence and its deduced amino acid sequence of DcSEP1,and homologous comparison among DcSEP1 and other SEP-like proteins
DcAGL6(见图3)的cDNA全长为1 061 bp,3'-端非翻译区为273 bp,poly(A)尾长20个腺苷酸,编码区747 bp,对应编码249个氨基酸,编码的蛋白质含有57个氨基酸的MADS区、32个氨基酸的I区、77个氨基酸的K区。与拟南芥的AGL6、大麻槿的HcMADS、风信子的HoMADS、矮牵牛的pMADS4同源性分别为58.98%、64.03%、59.36%和61.24%。

图3 DcAGL6的核苷酸序列、推导的氨基酸序列及其与其他AGL6蛋白的同源比对Fig.Nucleotide sequence and its deduced amino acid sequence of DcAGL6,and homologous comparison among DcAGL6 and other AGL6 proteins
2.2 DcSEP1和DcAGL6的系统进化树分析
为进一步弄清DcSEP1和DcAGL6的进化地位,在GenBank中获得大量的SEP-like和AGL6基因,并以其推导的氨基酸序列构建系统进化树。系统进化分析显示克隆的两个基因DcSEP1与SEP-like基因归为同一分支,DcAGL6与AGL6基因聚为同一分支,均属于E类基因(见图4)。
2.3 基因特异性RT-PCR分析
为分析胡萝卜花发育相关MADS-box基因在野生型花器官中的表达空间特异性,以胡萝卜的根、茎、叶、萼片、雄蕊和心皮等器官的总RNA为模板,进行基因特异性RT-PCR检测。
结果见图5。
由图5可知,克隆的两个E类基因DcSEP1和DcAGL6都在营养器官根、茎、叶中无表达。在花器官萼片中也同样未检测到,而在心皮和雄蕊中都有微量表达。DcSEP1和DcAGL6在心皮的表达量均高于雄蕊。

图4 DcSEP1和DcAGL6与其他同类蛋白的进化树Fig.4 Phylogenetic tree constructed by DcSEP1,DcAGL6 and their homogeneous proteins
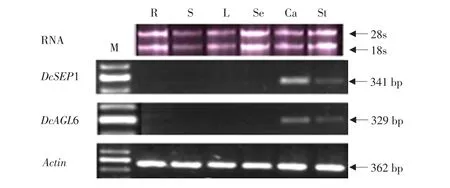
图5 胡萝卜MADS-box基因器官特异性表达分析Fig.5 Organ-specific expression analysis of carrot MADS-box genes
3 讨论与结论
为了解MADS-box基因在调节花发育中的作用,利用RACE方法从胡萝卜中克隆出两个MADS-box基因DcSEP1和DcAGL6。将两个基因与其他种类植物的MAD-box基因进行比较分析后结果显示:DcSEP1与双子叶植物矮牵牛的MADS12和金鱼草的DEFH49的亲缘性最高,而DcAGL6与双子叶十字花科羽衣甘蓝的BoAGL6和拟南芥的ATHAGL6的亲缘性最高。由此可见胡萝卜作为双子叶植物的进化地位。DcSEP1和DcAGL6与其他物种类基因序列的相似性预示着它们具有相似功能。在过去的10年中,Martin Yanofsky及其同事一直在系统研究拟南芥MADS-box基因[11-12]。开始时,MADS-box基因均通过与AG的同源性来确定。因此,它们都被称为AGAMOUS-LIKE(AGL)基因。近年来,他们发现三个序列高度同源且时空表达模式类似的MADS-box基因SEP1(原名AGL2)、SEP2(原名AGL4)和SEP3(AGL9)在花器官的形成中具有极其重要的作用。在花发育的早期和中期,SEP1和SEP2在所有四轮花器官中都表达[13],这个研究结果与胡萝卜所克隆的这两个基因只在心皮与雄蕊中表达存在差异。SEP作为花器官同源异型基因ABCD的共因子(cofactor)在各轮花器官决定中发挥作用[14]。各进化系表达模式存在差异。加州婴粟(Eschscholzia californica)中EScaAGL9在萼片原基起始后开始表达,主要集中在花瓣、雄蕊和心皮原基中,在花的发育过程中持续表达,该基因在发育的种子中有很高表达水平[15]。虽然E类基因的表达模式在被子植物不同物种中有差异,但该基因对所有花器官的发育都是必需的,这一功能十分保守[6]。
本试验克隆的DcSEP1和DcAGL6均属于E类基因,通过序列分析和进化树构建进一步了解该类基因在不同物种中的表达,为胡萝卜花器官研究奠定基础。但有关其时空表达模式和功能,有待于利用Northern杂交和基因敲除等方法进行深入研究。
[1]Ma H,Yanofsky M F,Meyerowitz E M.AGL1-AGL6,anArabido-psisgene family with similarity to floral homeotic and transcription factor genes[J].Genes Dev,1991,5(3):484-495.
[2]吕山花,孟征.MADS-box基因家族基因重复及其功能的多样性[J].植物学通报,2007,24(1):60-70.
[3]Jack T.Molecular and genetic mechanisms of floral control[J].Plant Cell,2004,16:s1-s17.
[4]李云.稻花器官突变体fort(t)和spp1的形态发、遗传分析及相关基因的分子标记定位[D].成都:四川农业大学,2006.
[5]Adam H,Jouannic S,Orieux Y,et al.Functional characterization of MADS-box genes involved in the determination of oil palm flower structure[J].J Exp Bot,2007,58(6):1245-1259.
[6]徐启江,关录飞,吴笑女,等.草原龙胆MADS-box基因的克隆及表达分析[J].植物学通报,2008,25(4):415-429.
[7]Murai K,Takumi S,Koga H,et al.Pistilloidy,homeotic transformation of stamens into pistil-like structures,caused by nuclearcytoplasm interaction in wheat[J].Plant J,2002,29:169-181.
[8]Linke B,Nothnagel T,Bǒrner T.Flower development in carrot CMS plants:Mitochondria affect the expression MADS-box genes homologous toGLOBOSAandDEFICIENS[J].Plant J,2003,34(1):27-37.
[9]Carlsson J,Leino M,Sohlberg J,et al.Mitochondrial regulation of flower development[J].Mitochondrion,2008,8(1):74-86.
[10]张振贤.蔬菜栽培学[M].北京:中国农业大学出版社,2003:324-329.
[11]Ng M,Yanofsky M F.Function and evolution of the plant MADS-box gene family[J].Nat Rev Genet,2001(2):186-195.
[12]Alvarez-Buylla E R,Liljegren S J,Pelaz S,et al.MADS-box gene evolution beyond flowers:Expression in pollen,endosperm,guard cells,roots and trichomes[J].Plant J,2000,24(4):457-466.
[13]Savidge B,Rounsley S D,Yanofsky M F.Temporal relationship between the transcription of twoArabidopsisMADS box genes and the floral organ identity genes[J].Plant Cell,1995,7(6):721-733.
[14]Pelaz S,Ditta G S,Baumann E,et al.B and C floral organ identity functions require SEPALLATA MADS-box genes[J].Nature,2000,405:200-203.
[15]Zahn L M,Leebens-Mack J H,Arrington J M,et al.Conservation and divergence in the AGAMOUS subfamily of MADS-box genes:Evidence of independent sub-and neofunctionalization events[J].Evol Dev,2006,8(1):30-45.
