类芽胞杆菌碱性果胶裂解酶的纯化与酶学性质表征
2013-07-07应向贤陈丽娜谢丽萍
熊 斌,应向贤,陈丽娜,谢丽萍,魏 春,汪 钊
(浙江工业大学生物与环境工程学院,杭州310014)
类芽胞杆菌碱性果胶裂解酶的纯化与酶学性质表征
熊 斌,应向贤,陈丽娜,谢丽萍,魏 春,汪 钊
(浙江工业大学生物与环境工程学院,杭州310014)
从类芽胞杆菌Paenibacillus sp.WZ008的发酵上清液中纯化得到一个高活力碱性果胶裂解酶,经SDS⁃PAGE电泳估算其亚基相对分子质量为4.5×104。通过对该酶进行酶学性质研究发现:该酶能催化裂解果胶酸、低酯果胶和高酯果胶;酶催化反应最适温度范围为55~60℃,最适pH为9.6,在最适条件下以低酯果胶为底物酶的比酶活达3 021.6 U/mg;Ca2+能增强该酶的活力,而Mn2+,Ba2+和EDTA强烈抑制该酶活力;当没有Ca2+存在时,高度酯化的果胶是该酶的最适底物,在4mmol/LCa2+存在时,该酶以果胶酸为底物比酶活最高(25 467 U/mg)。该酶N端序列比对分析发现与类芽胞杆菌Paenibacillus amylolyticus strain 27c64果胶裂解酶高度同源。
酶学性质;酯化果胶;碱性果胶酶;纯化
果胶裂解酶(PEL,EC 4.2.2.2)能通过β-消除断裂聚半乳糖醛酸(PGA)的α-1,4糖苷键得到4,5位不饱和产物[1]。碱性果胶酶通常在pH 8~10的环境中催化效率较高,是对棉织物精炼效果最好的酶[2],可以从未加工棉中去除非纤维素物质从而提高棉的吸收能力和洁白度[3]。与化学加工过程相比,纺织原料的酶法生物精炼对环境更友好。除此之外,碱性果胶酶还可用于麻类生物脱胶、生物制浆、果胶低聚糖制备等方面,同时它也是一种重要的饲料用酶[4]。最新的研究表明碱性果胶酶在植物抗病中具有良好的诱导效果[56]。
碱性果胶酶的嗜碱性是其基本特征,细菌碱性果胶裂解酶最适作用pH一般在8~10,有报道果胶裂解酶最适pH可高达11.5[7]。由于许多细菌在偏碱性的环境生长良好,因而细菌是碱性果胶裂解酶的主要微生物来源。许多微生物碱性果胶裂解酶的酶学性质已被表征,其微生物来源包括Bacillus、Paenibacillus、Pseudomonas、Erwinia和Xanthomonas等[4]。尽管碱性果胶酶的相关研究已有较多报道,但发现并研究新型高活力的碱性果胶裂解酶对其工业应用仍具有重要的意义。
碱性果胶裂解酶产生菌Paenibacillus sp. WZ008是从腐烂的水果表皮筛选到的,笔者所在课题组吴茜等[8]前期研究已表明其在生物精炼上具有应用潜力。在此基础上,笔者对类芽胞杆菌Paenibacillus sp.WZ008碱性果胶裂解酶进行分离纯化,并对其酶学性质进行了详细表征,以期为其工业应用提供基础数据。
1 材料与方法
1.1 材料
1.1.1 菌种
类芽胞杆菌Paenibacillus sp.WZ008是浙江工业大学生物细胞培养实验室筛选并保存的菌种。
1.1.2 试剂与药品
层析填料Ceramic Hydroxyapatite TYPEⅠ,Bio⁃Rad公司;层析填料SuperdexTM200 prep grad,GE Healthcare公司;果胶酸、低酯及高酯果胶均由衢州果胶公司提供。其他试剂和药品均为国产分析纯。
1.1.3 仪器
蛋白质电泳仪、低压层析仪(BioLogic LP,Bio⁃Rad公司),AKTA蛋白层析系统、紫外可见分光光度计(Amersham公司)。
1.2 方法
1.2.1 类芽胞杆菌Paenibacillus sp.WZ008的培养
用于类芽胞杆菌Paenibacillus sp.WZ008生长的液体培养基组成:1 L的培养基中蛋白胨10 g;酵母膏10 g;酯化果胶6 g。固体培养基在上述液体培养基中加入20 g/L的琼脂。类芽胞杆菌Paenibacillus sp.WZ008在该液体培养基中于30℃、200 r/min下培养46 h。所得的发酵液于6 000 g下离心15 min,收集上清液用作后续实验。
1.2.2 类芽胞杆菌Paenibacillus sp.WZ008果胶裂解酶的纯化
将离心得到的500 mL上清液先用50%的饱和(NH4)2SO4沉淀去除杂质,然后用80%的饱和(NH4)2SO4沉淀果胶酶。将用80%的饱和(NH4)2SO4得到的沉淀重新悬浮于含有5 mmol/L K3PO4的50 mmol/L Tris⁃HCl缓冲液(pH 8.0)中。悬浮好的酶液以0.5 mL/min的流速上样到预先平衡好的羟基磷灰石柱中(1.5 cm×20 cm),上样量为10 mL,用含有5~250 mmol/L K3PO4的Tris⁃HCl(50 mmol/L,pH 8.0)线性梯度洗脱果胶酶,洗脱流速为1 mL/min。将含有果胶酶活力的洗脱组分合并到一起,并通过PM-30的超滤膜浓缩。浓缩好的试样(0.5 mL)用于后续Superdex 200凝胶过滤色谱(1.0 cm×30 cm),该柱的平衡和洗脱都以50 mmol/L Tris⁃HCl(pH 8.0)为缓冲液,流速为0.5 mL/min。在分离过程中,果胶裂解酶试样通过SDS⁃PAGE电泳来验证其纯度。纯化后的果胶裂解酶N-端序列测定由上海基康生物技术公司完成。
1.2.3 果胶裂解酶活力测定
果胶裂解酶活力的测定是通过测定其在235 nm处的吸光度增值来实现的[9]。反应的具体流程如下:先将400μL的底物溶液(50 mmol/L pH 9.6的Gly⁃NaOH缓冲液中含有0.33%的聚半乳糖醛酸或果胶)于55℃下预热,然后加入200μL的酶液,于55℃下保温10 min。取出200μL的反应液加入1.8 mL HCl(0.01 mol/L)终止反应,最后测定波长235 nm的吸光值。一个酶活力单位定义为每分钟产生1μmol不饱和半乳糖醛酸所需的酶量,计算所使用的摩尔消光系数为4 600 cm2/mol[10]。文中所有相对活力的100%均指以20%酯化果胶为底物测得的比酶活。
1.2.4 果胶裂解酶的性质表征
用于果胶裂解酶最适pH测定的缓冲液为50 mmol/L Tris⁃HCl(pH 7.9~8.8)和Gly⁃NaOH(pH 8.8~11.1)。酶的pH稳定性测定是将酶置于pH 9.3或9.6的缓冲液中于4℃下保留一段时间,然后测定残留活力。温度对酶活力影响是在pH 9.6的Gly⁃NaOH中进行,温度变化范围40~70℃。0.33 mmol/L不同金属离子加入到反应体系中,然后检测活力,从而确定不同金属离子对酶的影响。为了测定酶的热稳定性,先将酶液分别于50、55和60℃孵育,然后按照常规的活力测定方法测定其残留活力。酶动力学参数测定反应体系如下,底物质量浓度范围为0.2~8 mg/mL,温度为55℃,缓冲液为pH 9.6的50 mmol/L Gly⁃NaOH,利用双倒数作图法计算Vmax和Km值。
1.2.5 蛋白质浓度和果胶裂解酶亚基相对分子质量的测定
蛋白质浓度的测定采用Bradford检测法[11],果胶酶亚基相对分子质量通过SDS⁃PAGE电泳测定。
2 结果与讨论
2.1 类芽胞杆菌Paenibacillus sp.WZ008果胶裂解酶的分离纯化
通过(NH4)2SO4沉淀、羟基磷灰石和凝胶过滤色谱等步骤对类芽胞杆菌Paenibacillus sp.WZ008果胶酶进行分离纯化,结果见表1。由表1可知:总纯化倍数为53.5倍,酶活力总收率为27%,纯酶的比酶活达到3 021.6 U/mg,高于已报道的果胶裂解酶活力[1,12-13],属于高活力果胶裂解酶。SDS⁃PAGE电泳鉴定结果见图1。由图1可知,纯化后的酶只有单一条带,估算其亚基相对分子质量为4.5×104。

表1 类芽胞杆菌Paenibacillus sp.W Z008果胶裂解酶的分离纯化Table 1 Purification of pectate lyase from Paenibacillus sp.WZ008

图1 Paenibacillus sp.WZ008果胶裂解酶的SDS⁃PAGE分析结果Fig.1 SDS⁃PAGE analysis of purified pectate lyase from Paenibacillus sp.WZ008
2.2 类芽胞杆菌Paenibacillus sp.WZ008果胶裂
解酶的酶学性质
2.2.1 pH对酶活力影响
考察pH对Paenibacillus sp.WZ008果胶裂解酶的催化活力的影响,结果见图2。由图2可知:在pH 7.8~11.1范围内该酶都有活力,当pH为9.6时酶活力最高,因此该果胶酶属于碱性果胶酶家族。对其pH稳定性的分析表明,当酶在4℃下于pH 9.3和9.6缓冲液中孵育4 h后,酶的残留活力分别为初始活力的96.5%和74.7%,表明该酶在碱性条件下具有良好的稳定性。

图2 pH对Paenibacillus sp.WZ008果胶裂解酶的催化活力影响Fig.2 Effects of pH on activity of purified pectate lyase from Paenibacillus sp.WZ008
2.2.2 温度对酶活力影响
由于细菌碱性果胶裂解酶的最适作用温度一般为40~70℃[14],所以笔者考察不同温度(40~70℃)下,温度对Paenibacillus sp.WZ008果胶裂解酶活力的影响,结果见图3。由图3可知:酶的最适温度范围为55~60℃。纯酶在低于50℃的条件下活力相对比较稳定,同时,该酶在50℃下活力半衰期为15 h。当温度增加到55℃时,酶的半衰期降至3 h,而温度高于60℃时,酶则会很快失活(图4)。

图3 温度对Paenibacillus sp.WZ008果胶裂解酶活力的影响Fig.3 Effects of tem perature on activity of pectate lyase from Paenibacillus sp.WZ008
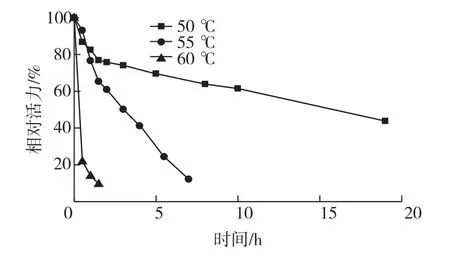
图4 Paenibacillus sp.WZ008果胶裂解酶的热稳定性Fig.4 Thermostability of pectate lyase from Paenibacillus sp.WZ008
2.2.3 金属离子和EDTA对酶活力影响
考察不同金属离子对酶活力影响,结果见图5。由图5可知:0.33 mmol/L的Ca2+极大增强了酶的活力,与不加Ca2+对照相比,活力提高了1.7倍,同时,其他二价金属离子,如Mg2+、Cu2+、Co2+、Ni2+和Zn2+对酶活力影响不明显,酶活力范围为不加Ca2+对照的95%~109%(图5)。Ba2+能强烈地抑制该果胶裂解酶的活力,其酶活力仅为不加Ca2+对照的7%,这一性质与报道的来自芽胞杆菌Bacillus sp. BP-23果胶裂解酶相似[15]。另外,Mn2+和EDTA也对酶有明显的抑制作用,其酶活力分别为不加Ca2+对照的66%和53%。在没有外加Ca2+的情况下该酶仍有较高活力,这可能是由于底物中微量的残留Ca2+引起的。当PGA、20%酯化果胶和70%酯化果胶分别用作底物时,最适Ca2+添加浓度分别为2、4和4 mmol/L(图6)。

图5 金属离子和EDTA对酶活力的影响Fig.5 Effects ofmetal ions on activity of pectate lyase from Paenibacillus sp.WZ008
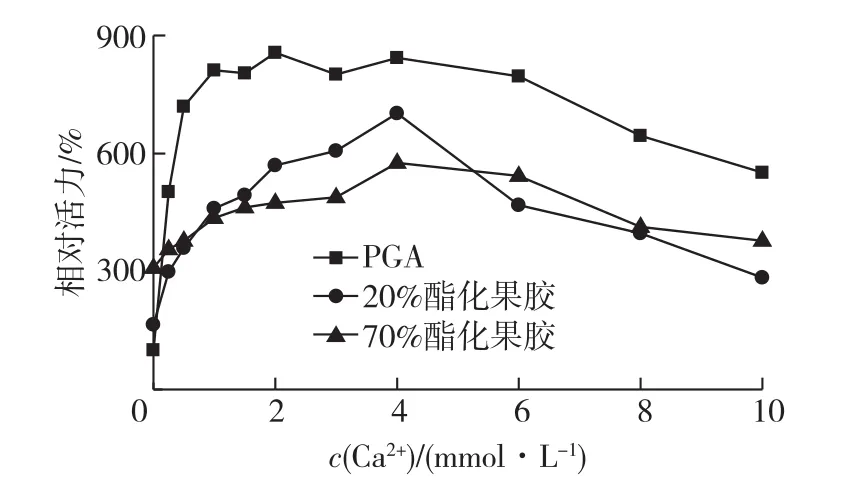
图6 Paenibacillus sp.WZ008果胶裂解酶的底物特异性Fig.6 Substrate specificity of purified pectate lyase from Paenibacillus sp.WZ008
2.2.4 底物特异性
分别考察该果胶裂解酶对PGA、20%酯化果胶和70%酯化果胶的特异性,催化反应中Ca2+添加量范围是0~10 mg/mL。当不向反应中外加Ca2+时,该果胶酶对70%酯化果胶活力最高(25 467 U/mg),分别是PGA和20%酯化果胶活力的3.09和1.88倍。当反应混合体系中加入4 mmol/L CaCl2时,酶对PGA活力最高,分别是20%和70%酯化果胶活力的1.25和1.46倍(图6)。
2.2.5 动力学参数
分别以PGA,20%酯化果胶和70%酯化果胶为底物,在0.2~8 mg/mL底物质量浓度范围内测定酶的比酶活,结果见图7。由图7可知:在不同底物下,该果胶裂解酶的酶促反应动力学均符合Michaelis⁃Menten动力学,因而经Lineweaver⁃Burk双倒数作图法计算酶动力学参数Km和Vmax值。当所用底物为20%酯化果胶时,酶的Km值为3.77 mg/mL,酶促反应的Vmax为8 560 U/mg,而底物变为70%酯化果胶时,酶的Km值增加到4.17 mg/mL,酶促反应Vmax则变为10 800 U/mg。该果胶裂解酶对PGA的Km值为3.39 mg/mL,同时酶促反应Vmax为9 400 U/mg。
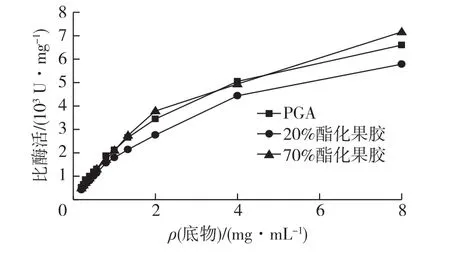
图7 酶在不同底物浓度下的比酶活Fig.7 Effects of substrate concentrations on activity of pectate lyase from Paenibacillus sp.WZ008
2.2.6 N-端序列结果
经测定得到该果胶裂解酶的N-端序列为AGNADYNLTGFSQGN,通过Blast序列比对发现,该序列与来自类芽胞杆菌Paenibacillus amylolyticus strain 27c64果胶裂解酶PelB的同源序列具有很高的相似度(14/15的相似度)。与Paenibacillus sp. WZ008果胶裂解酶类似,该类芽胞杆菌果胶裂解酶也表现出对酯化果胶和聚半乳糖醛酸均有活力[15],但其活力却远远低于本文所报道的果胶裂解酶。另外,作为胞外酶,Paenibacillus sp.WZ008果胶裂解酶的N-端序列以丙氨酸而不是以甲硫氨酸为起始氨基酸,这也意味着该酶的信号肽在翻译后已被切除。
3 结 论
通过(NH4)2SO4沉淀、羟基磷灰石柱层析及凝胶过滤柱层析从类芽胞杆菌发酵液中纯化得到一个果胶裂解酶。该酶底物谱广,以果胶酸、低酯果胶或高酯果胶为裂解底物时该酶均表现出高活力。该酶最适作用pH为9.6,属于碱性果胶裂解酶,在碱性条件下具有良好的稳定性。最适作用温度范围为55~60℃,在50℃下热稳定性较好。Ca2+对酶的活力具有显著促进作用。该酶N-端序列比对分析表明与一个解淀粉类芽胞杆菌果胶酶高度同源,而其活力远高于解淀粉类芽胞杆菌果胶酶,以高酯果胶为底物时酶动力参数Vmax可高达10 800 U/mg。
[1] Payasi A,Sanwal R,Sanwal G G.Microbial pectate lyases:characterization and enzymological properties[J].World J Microbiol Biotechnol,2009,25(1):1⁃14.
[2] Kalantzi S,Mamma D,Christakopoulos P,et al.Effect of pectate lyase bioscouring on physical,chemical and low⁃stressmechanical properties of cotton fabrics[J].Bioresour Technol,2008,99(17):8185⁃8192.
[3] Tzanov T,Calafell M,Guebitz G M,et al.Bio⁃preparation of cotton fabrics[J].Enzyme Microb Technol,2001,29(6):357⁃362.
[4] Hoondal G S,Tiwari R P,Tewari R,et al.Microbial alkaline pectinases and their industrial applications:a review[J].Appl Microbiol Biotechnol,2002,59(4/5):409⁃418.
[5] Esquerré⁃TugayéM T,Boudart G,Dumas B.Cell wall degrading enzymes,inhibitory proteins,and oligosaccharides particip ate in themolecular dialogue between plants and pathogens[J].Plant Physiol Biochem,2000,38(1/2):157⁃163.
[6] 李祖明,李鸿玉,白志辉,等.碱性果胶酶诱导黄瓜抗病机理的初步研究[J].植物保护,2008,34(5):52⁃57.
[7] Hatada Y,Kobayashi T,Ito S.Enzymatic properties of the highly thermophilic and alkaline pectate lyase Pel⁃4B from alkaliphilic Bacillus sp.strain P⁃4⁃N and the entire nucleotide and amino acid sequences[J].Extremophiles,2001,5(2):127⁃133.
[8] 吴茜,沈雪亮,汪钊.碱性果胶酶菌种选育及在纺织前处理中的应用研究[J].印染助剂,2008,25(2):25⁃27.
[9] Albersheim P.Pectin lyase from fungi[J].Methods Enzymol,1966,8:628⁃631.
[10] Collmer A,Ried J L,Mount M S.Assay⁃methods for pectic enzymes[J].Methods Enzymol,1988,161:329⁃335.
[11] Bradford M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein⁃dye binding[J].Anal Biochem,1976,72:248⁃254.
[12] Yuan P,Meng K,Wang Y,et al.A low⁃temperature⁃active alkaline pectate lyase from Xanthomonas campestris ACCC 10048 with high activity over a wide pH Range[J].Appl Biochem Biotechnol,2012,168(6):1489⁃1500.
[13] Boland W E,Henriksen E D,Doran⁃Peterson J.Characterization of two Paenibacillusamylolyticus strain 27c64 pectate lyaseswith activity on highlymethylated pectin[J].Appl Environ Microbiol,2010,76(17):6006⁃6009.
[14] 陈丽娜,应向贤,薛群,等.细菌碱性果胶酶的酶学特性及其应用研究[J].中国生物工程杂志,2010,30(4):125⁃130.
[15] Soriano M,Blanco A,Díaz P,et al.An unusual pectate lyase from a Bacillus sp.with high activity on pectin:cloning and characterization[J].Microbiology,2000,146(part1):89⁃95.
Purification and characterization of alkaline pectate lyase from Paenibacillus sp.WZ008
XIONG Bin,YING Xiangxian,CHEN Lina,XIE Liping,WEIChun,WANG Zhao
(College of Biological and Environmental Engineering,Zhejiang University of Technology,Hangzhou 310014,China)
An extracellular pectate lyase was purified from the culture supernatant of Paenibacillus sp. WZ008 grown in the pectin⁃containingmedium.The subunitmolecular weight of the purified enzyme was determined to be around 4.5×104by SDS⁃PAGE analysis.It showed activity on both polygalacturonic acid and methylated pectins.The optimum activity of the purified enzyme was demonstrated in a temperature range of 55℃to 60℃and at pH 9.6.The specific activity of pectate lyase was up to 3 021.6 U/mg using 20%methylated pectin as substrate under the optimized conditions.The Ca2+enhanced the enzyme activity but Mn2+,Ba2+,and EDTA strongly inhibited it.Highlymethylated pectin was the optimum substratewithout Ca2+addition while the enzyme exhibited themaximal activity(25 467 U/mg)on polygalacturonic acid in the presence of 4 mmol/L Ca2+.The amino⁃terminal sequence of the enzyme was highly identical to that of a pectate lyase from Paenibacillus amylolyticus strain 27c64.
characterization;methylated pectin;alkaline pectate lyase;purification
Q814
A
1672-3678(2013)06-0042-05
10.3969/j.issn.1672-3678.2013.06.009
2013-01-30
浙江省自然科学基金(LY12B06010);教育部留学回国人员科研启动基金(第40批)
熊 斌(1988—),男,湖北荆州人,硕士研究生,研究方向:生物催化与转化;汪 钊(联系人),教授,E⁃mail:hzwangzhao@163.com
