一株乙二醇氧化酶菌株的筛选及催化特性的初步研究
2013-07-07何玉财徐晓锋潘雪鹤巫淼鑫
何玉财,徐晓锋,潘雪鹤,巫淼鑫
(1.常州大学制药与生命科学学院生物工程研究室,常州213164;2.华东理工大学生物反应器工程国家重点实验室,上海200237)
一株乙二醇氧化酶菌株的筛选及催化特性的初步研究
何玉财1,2,徐晓锋1,潘雪鹤1,巫淼鑫1
(1.常州大学制药与生命科学学院生物工程研究室,常州213164;2.华东理工大学生物反应器工程国家重点实验室,上海200237)
利用富集培养技术从土壤中筛选获得1株高活性二醇氧化活性菌株Brevibacterium sp.CCZU12-1。以Brevibacterium sp.CCZU12-1静息细胞为催化剂,最适催化反应温度、反应pH和金属离子添加量分别为30℃、6.5和Mn2+0.1 mmol/L。在最佳条件下,转化200 mmol/L乙二醇24 h,羟基乙酸的产率为94.6%,分批补料乙二醇5批,羟基乙酸的累积浓度为972 mmol/L。
氧化;乙二醇;羟基乙酸;Brevibacterium
α-羟基酸是一类重要的化合物[1-9],其中羟基乙酸(HOCH2COOH)是最简单的α-羟基酸,被广泛地应用于日化、纺织和医药等行业,不仅可以作为家用和工业用的清洗剂,还可以用作黏结剂、焊接剂、破乳剂和涂料的配料及合成多种农药、医药和化学助剂,市场需求量大[2-4]。工业上,生产羟基乙酸主要通过化学方法(包括氯乙酸氧化法、甲醛羰基化法和甲醛氰化法等),通常需要在强酸或强碱、高温、高压等反应条件下进行[6]。而生物催化合成羟基乙酸具有反应条件温和、副产物少等优点[5-7],符合绿色化学发展的要求。生物氧化法可实现二醇的选择性氧化,实现羟基羧酸的合成,然而报道的酶源较少[8-9]。另外,乙二醇是一种便宜的原料[8],可经生物氧化法实现羟基乙酸低成本合成。因此,扩大筛选新的酶源催化氧化乙二醇实现羟基乙酸的高效合成具有重要的现实意义。
笔者利用改进的羟肟酸铁比色法[10-11]建立了二醇氧化酶的高通量筛选方法,并以此从土壤中获得具有乙二醇氧化酶活性的菌株Brevibacterium sp. CCZU12-1,同时考察反应温度、反应pH和金属离子添加剂等对酶催化活性的影响,以期为该菌的应用奠定基础。
1 材料与方法
1.1 仪器
UV-2100型紫外-可见分光光度计(上海精密科学仪器有限公司);HH-2XSZ-G型恒温水浴锅(金坛市虹盛仪器厂);TGL-16G高速台式离心机(上海安亭科学仪器厂);LC-10AT VP高效液相色谱仪(日本岛津公司)。
1.2 试剂
乙二醇(分析纯)购于国药集团化学试剂有限公司,蛋白胨、酵母膏为生物级,其他试剂为市售分析纯。
高氯酸羟胺(HAP)、N,N-二环己基碳二亚胺(DCC)和高氯酸铁溶液(0.070 mol/L)参照文献[10]方法配制。
1.3 土样
土样在常州大学白云校区化工楼周围采集。
1.4 培养基
富集培养基1:苯乙二醇5 mmol/L,(NH4)2SO42 g/L,KH2PO42 g/L,NaCl 1 g/L,MgSO40.2 g/L。
富集培养基2:乙二醇5 mmol/L,(NH4)2SO42 g/L,KH2PO42 g/L,NaCl 1 g/L,MgSO40.2 g/L。
基础产酶培养基:葡萄糖15 g/L,蛋白胨10 g/L,酵母膏5 g/L,KH2PO42 g/L,NaCl 1 g/L,MgSO40.2 g/L。
以上培养基调pH至6.5,121℃灭菌15 min后,待用。
1.5 目标菌株的筛选
将采集的土样0.1 g分别制备成2 mL土壤悬液,取0.1 mL土壤悬液加入到3 mL富集培养基1或富集培养基2中,30℃、160 r/min摇床上培养48 h后,取200μL培养液,进行离心(10 000 g,5 min),然后取上清液40μL至24孔板中,利用羟肟酸铁比色法[10]进行有机羧酸的检测。
1.6 菌株的培养及转化反应
利用发酵培养基对Brevibacterium sp.CCZU12-1在30℃、160 r/min恒温摇床中振荡培养48 h后,离心(10 000 g,5min)培养液得到静息细胞,利用生理盐水将静息细胞洗涤3次,然后将1.0 g湿细胞重新悬浮于10 mL H3PO4缓冲溶液(pH 6.5,100 mmol/L)中,加入终浓度为200 mmol/L乙二醇,在30℃和160 r/min的恒温摇床振荡反应。反应过程中不同反应时间取样150μL,立即加入50μL的2 mol/L HCl终止反应,充分振荡混匀,离心取上清液,进行产物分析。
1.7 检测方法
离心后的反应液经微孔滤膜(0.22μm)过滤后,利用HPLC(LC-10AT VP,日本Shimadzu公司)分析。C18柱(Shim⁃pack VP-ODS,日本Shimadzu公司)用于检测羟基乙酸的浓度,流动相为20 mmol/L KH2PO4(pH 2.5),流速为0.5 mL/min,检测波长为215 nm。
酶活单位的定义:在30℃、pH为6.5条件下,1 min转化乙二醇生成1μmol羟基乙酸所需要的催化剂的量(DCW,细胞干质量)。实验结果均为3次平行实验的平均值。
1.8 16S rDNA序列分析法
采用16S rDNA序列分析法进行菌种鉴定[4,12]。将测定的16S rDNA序列用BLASTN与GenBank中已知的16S rDNA序列进行同源性比较。
2 结果与讨论
2.1 活性菌株筛选
二醇氧化酶转化的产物羟基乙酸是一种羧酸,可根据文献[10-11]报道的显色法测定。因此,可利用羟肟酸铁比色法建立二醇氧化酶催化合成羧酸的高通量筛选策略。显色反应是在24孔板中进行的,取40μL反应上清液加入1 mL 0.070 mol/L的高氯酸羟胺(HAP)和500μL 0.60 mol/L的DCC溶液,然后室温反应15 min再加入700μL的高氯酸铁溶液混匀。若反应液中存在羧酸,则加入显色剂后立即出现紫红色,说明具有降解二醇合成羧酸的能力。分别以乙二醇和苯乙二醇为唯一C源,利用富集培养技术[11]从土壤中筛选二醇氧化酶产生菌。经过初筛和复筛后,从960份土壤中筛选获得一株乙二醇氧化活力较高的菌株CCZU12-1。以5′-CAGAGTTTGATCCTGGCT-3′和5′-AGGAGG⁃TGATCCAGCCGCA-3′分别为上下游引物对目的基因进行PCR扩增和测序,并用16S rDNA序列分析法进行同源性比较。测序序列(1 519 bp)进行Blast比对后,CCZU12-1与Brevibacterium lutescens CF87T(序列号:AJ488509.2)有99%的相似度。利用MEGA5.1软件采用N⁃J法构建系统进化树,结果如图1所示。由图1可以初步断定CCZU12-1为短杆菌属(Brevibacterium sp.),命名该菌株为Brevibacterium sp.CCZU12-1。值得注意的是,这是第一次报道利用短杆菌属(Brevibacterium sp.)催化乙二醇进行羟基乙酸的合成。
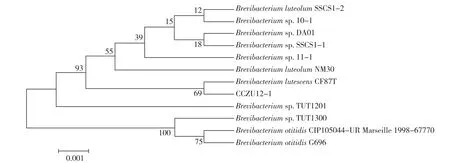
图1 CCZU12-1菌株的系统进化树Fig.1 Phylogenetic tree of CCZU12⁃1
2.2 Brevibacterium sp.CCZU12-1催化乙二醇反应特性初步研究
2.2.1 催化反应温度和pH对酶活力的影响
反应温度及pH对催化剂的活性有显著的影响[2,12]。考察不同反应温度(20~40℃)及反应pH(6.0~8.0)对Brevibacterium sp.CCZU12-1催化氧化乙二醇活性的影响,结果见图2。由图2(a)可知:随着温度的升高,催化活性也随之增大,在30℃时达到最大值,继续提高反应温度,催化活性快速下降。由此可见,最适反应温度为30℃。由图2(b)可知:在反应条件过酸或过碱时,催化活性明显降低,pH为6.5时,酶活达到最大值,由此可见,最适反应pH为6.5,催化剂比活力为14.8 U/g。而Su等[13]报道的Gluconobacter oxydans DSM2003最适反应温度和反应pH分别为28℃和6.0。
2.2.2 金属离子对酶活力的影响

图2 反应温度和pH对乙二醇酶氧化活性的影响Fig.2 Effects of reaction temperature and reaction pH on ethylene glycol⁃oxidizing activity
金属离子对催化剂的活性是有影响的[4,12]。因此,考察不同金属离子(CaCl2、CoC12、CuCl2、FeCl2、MgCl2、MnCl2·2H2O、NiCl2·7H2O和ZnCl2等)及其浓度分别为0.1和0.5 mmol/L时对酶活活力的影响,并以不加任何金属离子的空白为对照,结果见表1。由表1可知:当金属离子的浓度分别为0.1 mmol/L时,Co2+、Cu2+和Ni2+等对催化活性具有明显的抑制,而Ca2+、Mg2+、Fe2+、Zn2+和Mn2+等对催化活性则具有较明显的促进作用。Mn2+(0.1 mmol/L)的促进作用较明显。当金属离子的浓度分别为0.5 mmol/L时,Ca2+、Mg2+、Fe2+、Zn2+和Mn2+等对催化活性促进作用减弱。可见,最适的金属离子添加剂为Mn2+(0.1 mmol/L)。王嘉乐等[14]报道了Ca2+对氧化葡萄糖酸杆菌胞内脱氢酶Gox0525活性有显著的促进作用,而Mn2+对其活性影响不明显。Malaoui等[15]报道Mn2+对Clostridium butyricum E5突变菌1,3-丙二醇脱氢酶活性有明显的促进作用。Mn2+可能与Brevibacterium sp.CCZU12-1乙二醇氧化酶活性中心关键残基相互作用,导致活性提高。

表1 金属离子对乙二醇氧化活性的影响Table 1 Effects of variousmetal ions on ethylene glycol⁃oxidizing activity
2.2.3 底物浓度对催化反应的影响
不同底物浓度对催化反应有影响的[12]。考察加入不同的底物乙二醇,终浓度为50~400 mmol/L,在30℃、160 r/min的恒温摇床中振荡反应,取样分析测定,结果见图3。由图3可知:在底物浓度小于200 mmol/L时,催化活性随着底物浓度的增加而加快,当底物浓度为200 mmol/L时,催化活性达到最大值,继续增大底物浓度,则催化活性减小,可见底物乙二醇对Brevibacterium sp.CCZU12-1催化有一定的抑制作用。因此,确定最适底物浓度为200 mmol/L时,催化剂比酶活为18.9 U/g。底物耐受性与文献[8]报道的结果相似,说明Brevibacterium sp.CCZU12-1具有良好的催化氧化乙二醇活性。

图3 底物浓度对乙二醇氧化酶活性的影响Fig.3 Effects of substrate concentration on ethylene glycol⁃oxidizing activity
2.2.4 CCZU12-1静息细胞催化乙二醇的反应进程
在最适反应条件下,考察Brevibacterium sp. CCZU12-1催化氧化乙二醇的反应进程。称取1.0 g Brevibacterium sp.CCZU12-1静息细胞,加入底物乙二醇于100 mL磷酸盐缓冲溶液体系(pH 6.5,100 mmol/L),底物终浓度为200 mmol/L,氧化转化反应在30℃、160 r/min条件下进行,反应进程如图4所示。由图4可知:反应4 h内,氧化速度较快,4 h羟基乙酸产率为33.7%。12 h后,羟基乙酸产率为70.1%。进一步延长反应时间到24 h后,羟基乙酸产率达到94.6%。并且在反应过程中未发现醛基化合物及其他副产物的生成。而文献[4]报道Alcaligenes sp.ECU0401腈水解酶可催化50 mmol/L羟基乙腈合成羟基乙酸,反应36 h产率为73.6%。很明显,利用Brevibacterium sp.CCZU12-1催化合成羟基乙酸具有潜在的应用前景。如何提高Brevibacterium sp.CCZU12-1催化活性及羟基乙酸产量的相关研究仍在进行中。

图4 CCZU12-1静息细胞催化乙二醇的反应进程Fig.4 Time course for the oxidation of ethylene glycol by resting cells of CCZU12⁃1
2.3 分批补料对合成羟基乙酸的影响
采用分批补料的方法可以缓解底物的抑制作用[12]。因此,考察分批补料对CCZU12-1静息细胞合成羟基乙酸的影响,每反应24 h补料200 mmol/L乙二醇,结果见图5。由图5可知:进行补料5批,反应至第132 h,产物的累计浓度为972 mmol/L。生物催化剂时空产率为0.56 g/(L·h)。
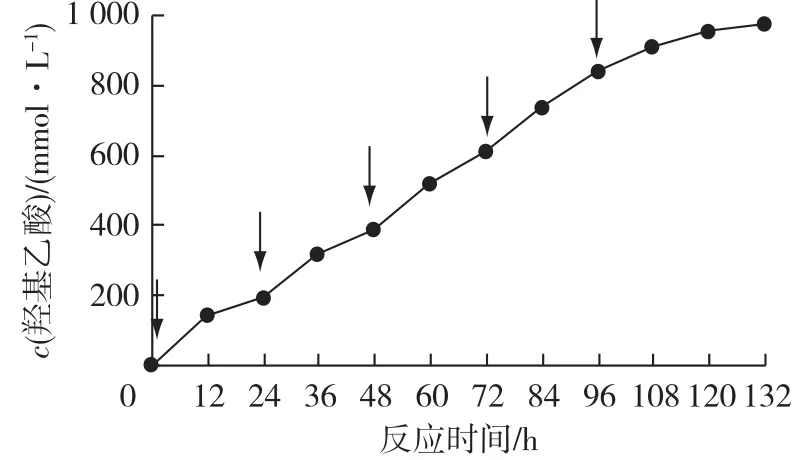
图5 分批补料进行乙二醇催化氧化合成羟基乙酸的反应进程Fig.5 Time course for oxidation of ethylene glycol to glycolic acid using fed⁃batch method
3 结 论
从土壤中筛选获得1株乙二醇氧酶菌株Brevibacterium sp.CCZU12-1,同时对其催化特性进行了初步考察,得到最适反应温度为30℃,反应pH为6.5,金属离子添加剂为Mn2+(0.1 mmol/L)。在最适催化反应条件下,催化200 mmol/L的乙二醇,羟基乙酸的产率可达到94.6%。分批补料乙二醇5批(累计132 h),羟基乙酸的累计浓度为972 mmol/L。本研究为高效生物氧化乙二醇制备重要中间体羟基乙酸提供了可行途径,同时也为生物催化氧化二醇合成具有重要应用前景的羟基羧酸类手性中间体提供了理论指导。
[1] 何玉财,许建和.腈水解酶在羧酸合成中的研究进展[J].生物加工过程,2009,7(1):7⁃12.
[2] 何玉财,许建和.产碱杆菌ECU0401催化拆分扁桃酸及其衍生物的研究[J].生物加工过程,2009,7(4):65⁃71.
[3] 王翔,穆晓清,徐岩,等.葡萄酒酵母不对称还原苯甲酰甲酸合成(R)-扁桃酸[J].生物加工过程,2009,7(5):34⁃38.
[4] He Y C,Xu JH,Su JH,etal.Bioproduction of glycolic acid from glycolonitrile with a new bacterial isolate of Alcaligenes sp. ECU0401[J].Appl Biochem Biotechnol,2010,160(5):1428⁃1440.
[5] He Y C,Liu Y Y,Ma C L,et al.Modified ferric hydroxamate spectrophotometry for assaying glycolic acid from the hydrolysis of glycolonitrile by Rhodococcus sp.CCZU10⁃1[J].Biotechnol Bioprocess Eng,2011,16:901⁃907.
[6] 李艳云,尹振晏,宫彩红,等.羟基乙酸的研究进展[J].北京石油化工学院学报,2006,14(1):59⁃64.
[7] 许建和,何玉财,张志钧.一种产碱杆菌的培养及其于腈水解制备羟基乙酸的方法:中国,101186933A[P].2008⁃05⁃08.
[8] Wei G,Yang X,Zhou W,et al.Adsorptive bioconversion of ethylene glycol to glycolic acid by Gluconobacter oxydans DSM2003[J].Biochem Eng J,2009,47:127⁃131.
[9] Shinobu O,Yutaka K,Yasushi N.Synthesis of optically active mandelic acid via microbial oxidation of racemic 1⁃phenyl⁃1,2⁃ethanediol[J].Biosci Biotech Biochem,1992,56:1216⁃1220.
[10] He Y C,Ma C L,Xu J H,et al.A high⁃throughput screening strategy for nitrile⁃hydrolyzing enzymes based on ferric hydroxamate spectrophotometry[J].Appl Microbiol Biotechnol,2011,89(3):817⁃823.
[11] 周琼,林春昕,蔡志强,等.一种3-氰基吡啶水解酶产生菌的高通量筛选策略及应用[J].生物加工过程,2011,9(1):30⁃34.
[12] He Y C,Zhou Q,Ma C L,etal.Biosynthesisofbenzyolformic acid from benzyol cyanide by a newly isolated Rhodococcus sp. CCZU10⁃1 in toluene⁃water biphasic system[J].Bioresour Technol,2012,115:88⁃95.
[13] Su W,Chang Z,Gao K,et al.Enantioselective oxidation of racemic 1,2⁃propanediol to D⁃(-)⁃lacticacid by Gluconobacter oxydans[J].Tetrahedron:Asymmetry,2004,15:1275⁃1277.
[14] 王嘉乐,魏东芝,林金萍.氧化葡萄糖酸杆菌胞内脱氢酶Gox0525的酶学性质研究[J].中国医药工业杂志,2011,42(10):742⁃746.
[15] Malaoui H,Marczak R.Separation and characterization of the 1,3⁃propanediol and glycerol dehydrogenase activities from Clostridium butyricum E5 wild⁃type and mutant D[J].J Appl Microb,2001,90:1006⁃1014.
Isolation and catalytic characteristics of ethylene glycol⁃oxidizing strain
HE Yucai1,2,XU Xiaofeng1,PAN Xuehe1,WU Miaoxin1
(1.Laboratory of Biochemical Engineering,College of Pharmaceutical and Life Sciences,Changzhou University,Changzhou 213164,China;2.State Key Laboratory of Bioreactor Engineering,East China University of Science and Technology,Shanghai200237,China)
Brevibacterium sp.CCZU12⁃1 had been isolated from soil samples with high diol⁃oxidizing activity against ethylene glycol using the enrichment culture technique.Using the resting cells of Brevibacterium sp.CCZU12⁃1 as catalysts,the optimal reaction temperature,pH and metal ion additive for diol⁃oxidizing activity were 30℃,6.5 and Mn2+(0.1 mmol/L),respectively.After 24 h of biotransformation,the yield of glycolic acid from 200 mmol/L ethylene glycol was 94.6%.Using fed⁃batch method,a total of 972 mmol/L of glycolic acid had been accumulated in the reaction mixture after the 5th feed.
oxidation;ethylene glycol;glycolic acid;Brevibacterium
Q93;X703
A
1672-3678(2013)06-0029-05
10.3969/j.issn.1672-3678.2013.06.006
2013-02-18
国家自然科学基金(21102011);常州市生物医药科技专项(CE20115051)
何玉财(1979—),男,辽宁开原人,副教授,博士,研究方向:生物催化,E⁃mail:heyucai2001@163.com
