海带发酵制取生物乙醇的影响因素与优化条件
2013-07-07夏天虹翁焕新
夏天虹,翁焕新
(浙江大学环境与生物地球化学研究所,杭州310027)
海带发酵制取生物乙醇的影响因素与优化条件
夏天虹,翁焕新
(浙江大学环境与生物地球化学研究所,杭州310027)
针对海带的碳水化合物不易被单一菌株发酵转化为乙醇的难题,通过酸化、匀浆和消化等预处理和正交试验,利用多酶系多菌种微生物复合发酵剂的酿酒曲,研究海带发酵制取生物乙醇的影响因素与优化条件。结果表明:在预处理试验中,加入一定量的Na2CO3,可以提高海带液中还原性糖和总糖的含量;消化温度对总糖影响相对较大,而对还原性糖的影响较小;过滤不利于得到较高浓度的乙醇;在优化条件中,发酵液的初始酸碱度是最重要的,其次是发酵温度和基质浓度,发酵液体积的影响程度相对较小。在基质(海带)质量浓度为0.15 g/L、温度34℃、起始pH 6.5和发酵液体积200 mL时,可以获得最大的乙醇产量4.09 g(以100 g海带计)。
生物乙醇;发酵;海带
生物乙醇是一种理想的可再生生物能源,它可以从不同的生物质原料中制取。海带生长不依靠土地资源,也不使用化肥和淡水资源,且产量高。在众多的生物能源原料中,海带具有明显优势,被认为是典型的第三代生物能源原料[1]。利用海带制备生物乙醇不仅可以避免能源与粮食的冲突,而且海带不含木质素[2],有利于海带制取乙醇的预处理。另外,规模化种植海带一方面有利于沿海污染海域生态环境的修复,另一方面藻类植物的光合作用可以固定空气中的CO2,减少温室气体的净排放。因此,大型海藻(海带)是提取生物乙醇最理想的原料之一。
海带中的碳水化合物含量可达30%~50%[3-4],但其组成较复杂,多以多聚糖的形式存在,如褐藻酸和纤维素等,难以通过单一菌株使海带进行糖化同时发酵。因而依靠单一菌株发酵海带具有很大的局限性[4-5]。Lee等[6]研究发现,这个局限性可由不同微生物,即多种菌共同发酵来克服,也可通过基因工程的方法[7]以达到高效制取生物乙醇的目的。Wargacki等[7]通过基因工程手段建立了一个可同时降解、摄取以及代谢海藻酸钠的微生物平台,利用此系统,海带糖分转化为乙醇可达最大理论产值的80%。但是,这是一个非常复杂的综合工艺,工业化实施过程存在较大困难。我国的酿酒历史悠久,酿酒曲能够提供丰富的发酵菌种和酶系[8],有利于海带的糖化和发酵同时进行。
为了探索相对简便且可行的海带制取生物乙醇的工艺路径,笔者对比了几种预处理方法,选择消化法作为后续发酵的前处理,并通过正交试验,分析各种影响因素,确定能够获得生物乙醇产量较高的优化条件,以期为开发大型褐藻(海带)生物能源提供科学依据和技术支撑。
1 材料与方法
1.1 材料
海带(Laminaria japonica)购于市场。将海带试样剪碎成小块,放入60℃的烘箱中干燥,至恒质量后取出,经粉碎机粉碎至0.177~0.841 mm,密封在试样袋中待用。
酿酒曲:安琪酵母股份有限公司,属于多酶系多菌种微生物复合发酵剂,主要含有酿酒酵母和根霉菌。
1.2 方法
1.2.1 预处理试验
海带的碳水化合物组成测定见表1。从表1可知:6种碳水化合物占被试海带干质量的51.32%,其中褐藻酸所占比例最大,达到30.52%,其次是甘露醇和粗纤维,分别为12.27%和5.43%,能被发酵菌直接利用的淀粉和还原性糖不到2%。由此可见,海带不利于直接发酵,通过预处理可以提高初始发酵液中的还原性糖和总糖含量。为了确定合适的预处理方式,进行方法的选择试验和影响因素试验。

表1 海带的碳水化合物组成[3,9-10]Table 1 Com ponents of carbohydrate in the kelp
1)预处理方法的选择试验。称取1.5 g粉碎海带于250mL烧杯中,加100mL去离子水,在不同条件下进行预处理试验:①将试样直接放入65℃恒温水浴中加温消化;②用2 mmol/L HCl调海带液pH至2,在65℃恒温水浴中加温消化;③海带液经搅拌机1 min处理后制备为匀浆,放入65℃恒温水浴中加温消化;④匀浆后直接放置于常温消化;⑤加入0.6 g Na2CO3后放置于室温下消化;⑥海带液经匀浆后加0.6 g Na2CO3,在65℃恒温水浴中加温消化。以上每种处理的消化时间均为1 h,然后分别测定还原性糖和总糖的含量。
2)Na2CO3含量对消化反应的影响试验。称取1.5 g粉碎海带于搅拌机中,加去离子水100 mL,经1 min处理后制备为匀浆,分别加入Na2CO30.3、0.6、0.9、1.2和1.5 g,放置于65℃的恒温水浴中加温1 h,分别测定还原性糖和总糖含量。
3)消化时间和温度的影响试验。称取1.5 g粉碎海带于搅拌机中,加去离子水100 mL,1 min匀浆,再加入0.6 g Na2CO3制备成一个取样时间的试样,一组(6个试样)放入65℃恒温水浴中加温消化,另一组(6个试样)放置于室温消化,分别消化0、15、30、45、60和90 min后取样,测定还原性糖和总糖的含量。
4)过滤对发酵的影响试验。称量15 g粉碎海带,加1 500 mL去离子水,制备为匀浆,放入3 g Na2CO3后于65℃恒温水浴1 h。预处理后的海带液分成2组,一组为原始海带液,另一组海带液经4层纱布过滤,两者分别调pH至6.5后,量取150 mL于250 mL锥形瓶中,121℃下灭菌20 min,冷却至常温后加入0.2 g酿酒曲,用厌氧塞封口,在30℃下,100 r/min恒温振荡器中培养,在不同的时间内取液,分别测定还原性糖、总糖和乙醇的含量。
1.2.2 发酵试验
将海带经过匀浆后,每克添加0.2 g Na2CO3于65℃恒温水浴中进行预处理1 h。然后用2 mol/L HCl调节海带液pH,量取至250 mL锥形瓶中,放入121℃灭菌锅中灭菌20 min,取出后放置于无菌操作台,待冷却,每150 mL海带液中加入0.2 g酿酒曲,用厌氧塞密封锥形瓶,于100 r/min恒温振荡器中培养。选择基质(预处理后的海带)质量浓度、发酵温度、灭菌前起始pH和发酵液体积4个因子,进行正交试验L16(44),因子水平见表2。发酵160 h,测定乙醇的浓度值。
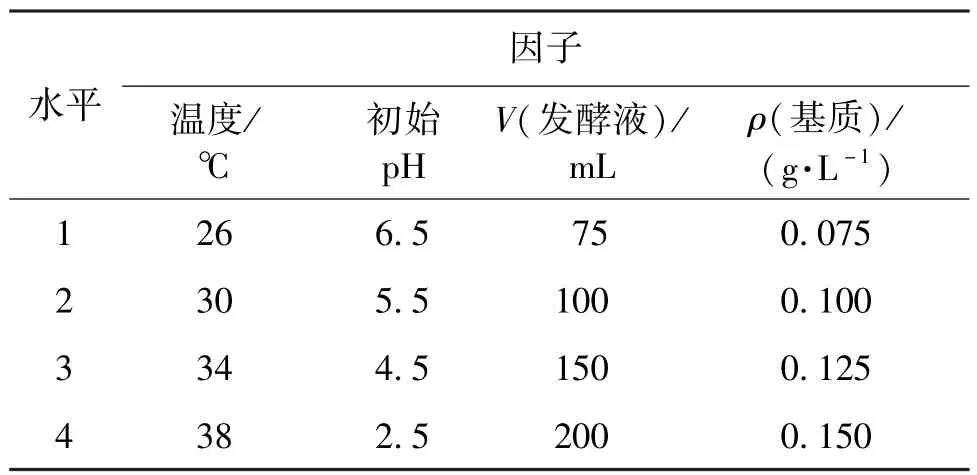
表2 L16(44)正交设计因子水平Table 2 Factors and levels of L16(44)orthogonal design
1.2.3 试样分析
1)还原性糖和总糖测定。反应液的pH调至6~9后,取10 mL于离心管中,4 000 r/min离心15 min,取上清液。还原性糖用3,5-二硝基水杨酸比色法测定[10];总糖用苯酚-H2SO4比色法测定[11]。
2)乙醇测定。取50 mL发酵液于250 mL圆底烧瓶中,加入50mL去离子水和几颗玻璃珠,装好蒸馏装置,用50 mL容量瓶接收(外用冰水浴),小火加热蒸馏至接近刻度50 mL,定容、摇匀。取10 mL H2SO4和10 mL K2Cr2O7(1∶1)于50 mL容量瓶中,冷却后加入25 mL蒸馏液,定容后混匀,放置10 min,在594 nm下测定吸光度[12-13]。重复试样的分析误差小于5%。
2 结果与讨论
2.1 Na2CO3提高还原性糖和总糖的作用
图1显示了经过不同预处理后海带液中总糖和还原性糖的含量变化。从图1可知:将海带颗粒在65℃恒温水浴中进行加温1 h或经过酸处理,溶出的还原性糖和总糖虽然都略有增加,但不如直接将试样制备成匀浆效果明显,这表明通过匀浆处理可以破坏海带组织结构,使部分糖分溶出。在匀浆中加入Na2CO3,并在65℃下恒温加热消化,可以获得较高的还原性糖和总糖,分别为6.68和136.67 mg(以1 g海带计)。这是由于褐藻胶是海带细胞壁的重要组成部分,且Na2CO3可以与褐藻酸钙盐(褐藻胶在海带中的主要存在状态)发生消化反应[14],使海带细胞膨胀而破坏,结果导致海带中的糖分溶出,从而使溶液中还原性糖和总糖浓度提高。

图1 不同处理海带液中还原性糖和总糖含量Fig.1 Content of reducing sugar and total sugar in the extract after different treatments
图1左上角小图显示了消化液中还原性糖和总糖含量随Na2CO3添加量的变化。可以看到,当Na2CO3的添加量逐渐增大时(0~0.3 g),消化液中还原性糖和总糖浓度快速上升,当添加量为0.3 g时,还原性糖和总糖质量浓度分别达到0.093和2.08 mg/mL。当Na2CO3的添加量从0.3 g增加到0.6 g时,消化液中的还原性糖和总糖浓度略有增加,然后随着Na2CO3添加量继续增加,消化液中的还原性糖和总糖浓度不再增加,这表明了此时消化反应破坏海带细胞壁已饱和。季仲强[4]研究发现,增加Na2CO3会加大消化液中的盐度,尽管酿酒酵母能耐受一定的盐度,对乙醇产率影响不大[4],然而高盐溶液对微生物具有毒害和抑制作用[15]。因此,选择Na2CO3的添加量为0.3 g(相当于0.2 g/g干海带)时,可以较大限度地破坏海带细胞壁,从而获得较大的还原性糖和总糖含量,同时盐度相对较低。
2.2 时间和温度对消化反应的影响
图2显示了海带液中还原性糖和总糖含量随消化时间的变化。由图2可知:消化液中还原性糖和总糖的含量开始时随时间的增加而逐渐增加,而后随着消化时间的延长有下降的趋势。如常温下消化反应的总糖在30 min时达到最大值1.44 mg/mL,而还原性糖在45 min时达到0.099 mg/mL的最大值,随着反应的进行,总糖和还原性糖的含量均开始下降;65℃下消化时,还原性糖和总糖的增加速率比常温下消化要快,在30 min时达到还原性糖的最大值,之后缓慢下降,总糖在60 min时达到最大值后下降。消化温度对还原性糖浓度影响相对较小,在45 min时,65℃和常温下的还原性糖浓度值相差较小;温度对总糖浓度影响比对还原性糖浓度影响大,65℃下的消化效果明显优于常温消化,在65℃下消化60 min时,总糖量达到最大值(2.058 mg/mL)。

图2 消化时间对还原性糖和总糖含量的影响Fig.2 Effects of digesting time on reducing sugar and total sugar contents w ith digesting time
2.3 过滤对发酵影响
图3显示了海带液过滤前后发酵情况。从图3(a)可以看到,经灭菌后的未过滤海带液总糖比过滤的总糖质量浓度大0.2 mg/mL,在之后的发酵过程中,总糖含量下降,到24 h后,由于酿酒曲中多种微生物共同作用,与褐藻胶紧密结合的碳水化合物溶于溶液中,总糖含量明显增加,而后持续下降。经灭菌后,过滤海带液和未过滤海带液的还原性糖含量无明显差别,这表明过滤对还原性糖的初始值影响不大。由于根霉菌具有较强的糖化力和液化力[16],当发酵一段时间后,其转化的还原性糖大于发酵消耗的还原性糖,还原性糖浓度开始上升,随着发酵的进行,还原性糖浓度持续下降。

图3 海带液过滤与未过滤处理后的发酵情况Fig.3 Results of fermentation after kelp liquid w ith and w ithout filtration and no treatment
发酵初期主要由酿酒酵母直接利用易发酵的原始还原性糖作为发酵底物,因此过滤海带液和未过滤海带液发酵产生的乙醇含量接近(图3(b))。但随着发酵的进行,乙醇的产生需要根据根霉的水解和糖化能力。酿酒曲中微生物的作用与底料浓度有密切关系,在一定范围内,微生物生长量和酶反应速度均随着底料浓度的增加而成正比的增大。由于未过滤的海带液底料浓度比过滤的高,因此,未过滤海带液中的微生物生长量大,酶浓度高,代谢快,还原性糖消耗快,产生更多乙醇。在40 h时后,过滤的海带液的乙醇含量几乎保持不变,而未经过过滤的海带液发酵的乙醇浓度则继续增加,并在160 h达到最大值0.232 mL/L。
褐藻胶黏性较大,4层纱布过滤海带液可将大多褐藻胶及相应的纤维素去除。酿酒曲中含多种酶及微生物,在发酵的过程中,主要成分的微生物根霉可产纤维素酶,能利用转化海带中的纤维素。因此,未过滤的海带液能进一步利用纤维素发酵得到较高的乙醇浓度。这个实验结果表明,过滤不利于发酵得到较高的乙醇浓度。
2.4 最佳发酵条件的确定
采取添加0.2 g Na2CO3于65℃恒温水浴中1 h的预处理,不过滤直接进入优化条件试验。为了确定最优化的发酵条件,选择发酵温度、初始pH、发酵液体积和基质浓度4个基本参数,作为控制因子进行海带发酵的正交试验。表3列出了各正交试验的乙醇含量。
从表3可以看出,各正交试验组乙醇含量随时间呈现出不同的变化趋势,其中,9号试验产生的乙醇体积浓度最大,在160 h时达0.728 5 mL/L,相当于100 g干海带产3.84 g乙醇;其次是试验10,在24 h时乙醇体积浓度为0.630 8 mL/L(100 g干海带产3.99 g乙醇),特别是试验13,虽然在112 h时达到的最大乙醇体积浓度为0.537 2 mL/L,没有试验9和试验10那样高,但是却获得了全部试验的最大产率:100 g干海带可产4.25 g乙醇。
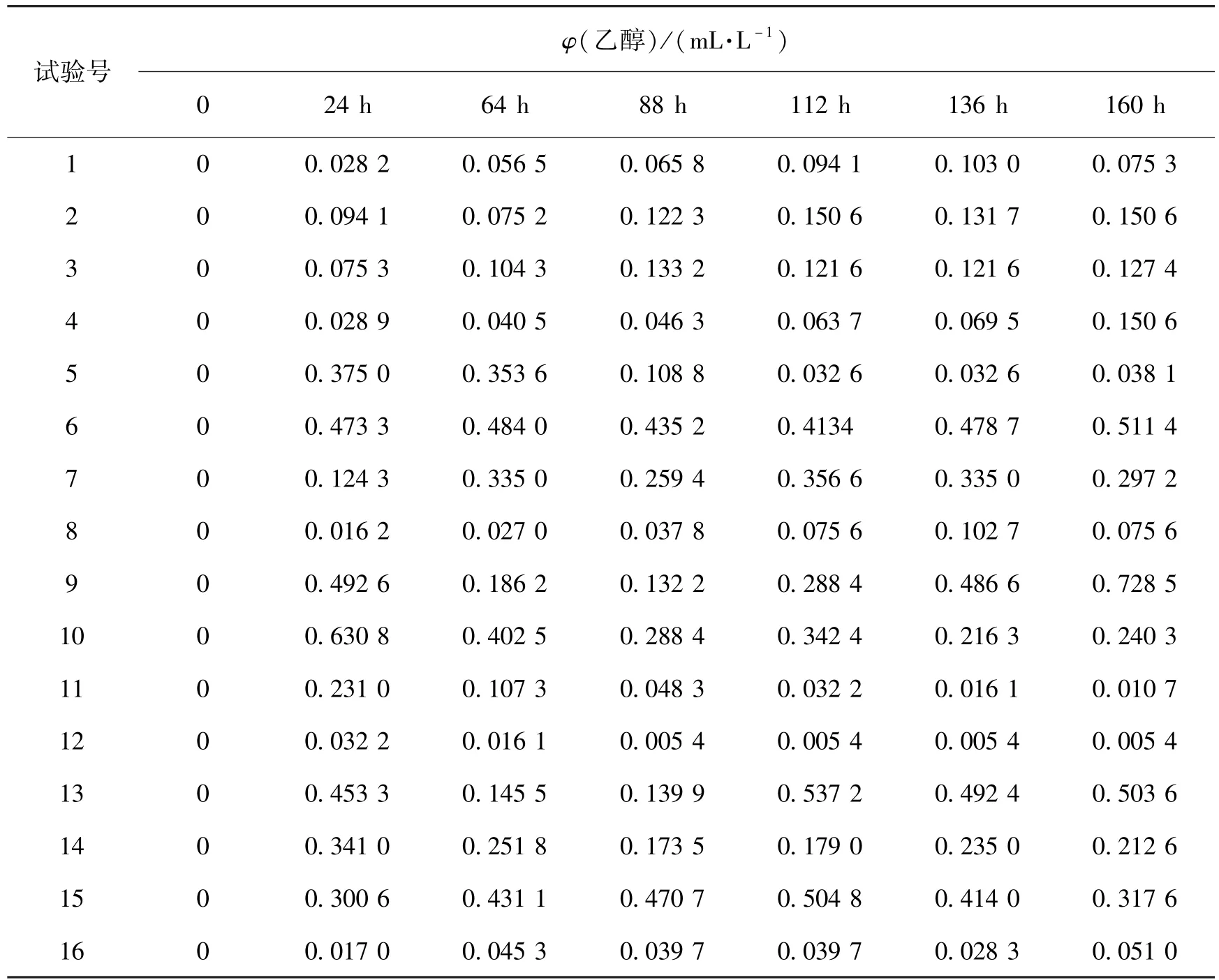
表3 正交试验结果Table 3 Results of orthogonal experiment
表4列出了各正交试验乙醇最大含量的极差分析结果,表4给出的数据显示,对于温度因素,第3水平34℃的T3值为1.622 5,明显大于该因素的其他水平值;对比初始pH一列的各Ti值大小,可以确定该因素的最佳水平为初始pH=6.5(T1=1.743 7);同理,分别对比发酵液和基质浓度的Ti值,可得到发酵液为第4水平200 mL时(T4=1.675 4)以及基质浓度为第4水平的0.15 g/L时(T4=1.895 3)效果最佳。这表明,在此试验范围内,最优的发酵条件:34℃、初始pH 6.5、发酵液体积200 mL和基质质量浓度0.15 g/L。
在温度、初始pH、发酵液和基质浓度4个因子中,极差(R)大小的排序:初始pH(R=0.351 9)、温度(R=0.271 2)、基质浓度(R=0.265 6)、发酵液(R=0.194 7)。从R值的这个排序可知:在海带制取乙醇发酵过程的各影响因素中,发酵液的初始酸碱度是最重要的,其次是发酵温度和基质浓度,来自发酵液体积的影响程度相对较小。

表4 酿酒曲正交试验各组乙醇最大含量的极差分析Table 4 Range analysis of themaximum ethanol content by Angel Distiller′s yeast in different groups of orthogonal experiments
F检验结果也表明(表5),在显著水平为0.025时,初始pH、温度及基质浓度对乙醇含量影响显著,而发酵液体积对乙醇含量影响不显著;当显著性水平为0.05时,这4个因子对乙醇生产浓度的影响都比较显著。
根据正交试验确定的最佳条件,进行海带发酵制取乙醇试验,图4显示了用基质质量浓度为0.15 g/L的发酵液200 mL,以初始pH为6.5和34℃下进行发酵制取乙醇的情况,从图4可知:发酵进行24 h时,乙醇体积浓度达到最大值,为0.787 3 mL/L。如果除去酿酒曲自身产出的乙醇,这时,乙醇的产率相当于4.09 g乙醇(以100 g海带计)。以海带批发价3元/kg,乙醇7 500元/t[17]计算,本文的乙醇产值仍低于生产成本,但可结合褐藻胶和生物碘的提取共同开发以降低成本和增加产值。随着发酵时间的延长,乙醇的浓度迅速降低,当60 h后,乙醇体积浓度在0.1~0.2 mL/L之间波动。乙醇浓度在发酵24 h达到峰值后开始下降,说明酵母开始消耗乙醇,一般只有当糖类质量浓度下降至4 mg/L时才出现这种情况,但此临界浓度随酵母菌种、培养条件等不同而有所不同[18]。实验中海带基质浓度很低是峰值乙醇浓度值不高的最主要原因,可考虑液化降黏和补料措施提高乙醇浓度,并维持较高浓度。

表5 发酵正交试验方差分析Table 5 Analysis of variance of orthogonal experiments
图4右上角小图显示了酿酒曲与海带+酿酒曲的总糖和还原性糖随发酵时间的变化。从图4右上角小图中可以看到,发酵剂酿酒曲中的还原性糖和总糖的起始质量浓度分别为0.017 7和0.176 4 mg/mL,随着发酵的进行,还原性糖和总糖浓度快速下降到较低水平,对海带制取乙醇的贡献值不大。在海带+酿酒曲中,还原性糖和总糖的起始质量浓度分别为0.075和2.3 mg/mL,在0~24 h的发酵时间内,总糖浓度上升,随着发酵时间的延长,总糖浓度逐渐减少,但发酵进行到64~112 h时,总糖浓度再次上升,此时,发酵液从原来的稠黏状转变为了半流体状液体,pH也明显下降,这可能是随着发酵的进行,原黏附在褐藻胶上的糖分进入发酵液中,反映了发酵液的环境因素对总糖浓度产生的影响。在发酵0~24 h时,还原性糖浓度明显上升,这一方面是由于酿酒曲中含有还原性糖,在加菌的同时增加了发酵液的还原性糖,另一方面是酿酒曲中根霉菌的糖化作用,将溶液中的多糖转化为单糖,从而使还原性糖大于其发酵的消耗量。随着发酵时间的延长,还原性糖浓度逐渐下降。

图4 优化条件的发酵情况Fig.4 Ferm entation under the optimum conditions
3 结 论
在预处理试验中,向海带液中加入一定量的Na2CO3,可明显地提高消化液中的还原性糖和总糖浓度,且适宜的Na2CO3剂量为0.3 g。预处理时间和温度会影响海带的消化反应,影响总糖和还原糖的溶出。消化温度对还原性糖的含量影响较小,而对总糖含量的影响较大,65℃条件下的消化效果明显优于常温消化。65℃条件下,预处理60 min时,还原性糖和总糖相对较高。海带液经过滤后总糖含量相应降低,未过滤的海带液发酵产生的乙醇浓度明显高于过滤液产生的乙醇浓度。
对于消化预处理,酿酒曲发酵海带制取生物乙醇的最佳条件:温度34℃、初始pH 6.5、发酵液体积为200 mL和基质质量浓度0.15 g/L。在显著性水平为0.05时,发酵基质浓度、发酵恒温培养温度、灭菌前起始pH和发酵液体积4个因子对乙醇含量的影响都比较显著,其中,发酵液的初始酸碱度是最重要的,其次是发酵温度和基质浓度,发酵液体积的影响程度相对较小。在优化条件下,海带发酵24 h时可得到最大乙醇含量产量4.09 g(以100 g海带计)。
[1] Goh C S,Lee K T.A visionary and conceptual macroalge⁃based third⁃generation bioethanol(TGB)biorefinery in Sabah,Malaysia as an underlay for renewable and sustainable development[J]. Renew Sustain Energy Rev,2010,14(2):842⁃848.
[2] Park J I,Lee JW,Sim S J,et al.Production of hydrogen from marine macro⁃algae biomass using anaerobic sewage sludge microflora[J].Biotechnol Bioprocess Eng,2009,14(3):307⁃315.
[3] 纪明侯,张燕霞.我国经济褐藻的化学成分研究:各种经济褐藻的主要成分[J].海洋与湖沼,1962,4(3/4):161⁃168.
[4] 季仲强.近岸海域氮磷污染生态修复与大型海藻生物能源提取研究[D].杭州:浙江大学,2011.
[5] 张志奇,翁焕新.海带发酵生产乙醇及其影响因素的控制研究[J].能源工程,2006(6):9⁃15.
[6] Lee S M,Lee J H.The isolation and characterization of simultaneous saccharification and fermentation microorganism for Laminaria japonica utilization[J].Bioresour Technol,2011,102:5962⁃5967.
[7] Wargacki A J,Leonard E,Win M N,et al.An engineered microbial platform for direct biofuel production from brown macroalgae[J].Science,2012,335(6066):308⁃313.
[8] 徐颖宣,徐尔尼,冯乃宪,等.微生物混菌发酵应用研究进展[J].中国酿造,2008(9):1⁃4.
[9] 纪明侯.海藻化学[M].北京:科学出版社,1997:208⁃354.
[10] 张彩莹,肖连冬.生物化学实验[M].北京:化学工业出版社,2009:21⁃23.
[11] 邵雪岭,毛歆,郭一清.生物化学与分子生物学实验指导[M].武汉:武汉大学出版社,2003:159⁃160.
[12] 魏冬梅,张艳芳,张予林.利用比色法测定葡萄酒的酒精度[J].食品工业,2001(4):45⁃46.
[13] 马美范,王君高.比色法测定酱油中乙醇含量[J].中国调味品,1994(7):26⁃27.
[14] 陈正霖,高金诚,王学良.褐藻胶[M].青岛:中国海洋大学出版社,1989:70⁃71.
[15] Vyrides I,Stuckey D C.Effect of fluctuations in salinity on anaerobic biomass and production of soluble microbial products(SMPs)[J].Biodegradation,2009,20(2):165⁃175.
[16] 谢邦祥.农家小曲酒酿造实用技术[M].北京:金盾出版社,2003:21.
[17] 中国化工网.乙醇市场价格保持坚挺走势[EB/OL].[2012⁃09⁃23].http:∥news.chemnet.com/item/2011⁃02⁃23/1506887.html.
[18] 于景芝,陈尧燊,俞学锋.酵母生产与应用手册[M].北京:中国轻工业出版社,2005:45.
The influencing factors and optim ization of ethanol production from kelp fermentation
XIA Tianhong,WENG Huanxin
(Institute of Environment&Biogeochemistry,Zhejiang University,Hangzhou 310027,China)
Kelp(Laminaria japonica)was acidified,homogenized,or digested,and then added into broth of Angel Distiller′s yeast for further fermentation.The influencing factorswere determined and optimized. The results showed that,the content of reducing sugar and total sugar could be increased by adding Na2CO3during pretreatment.The digestion temperature had more effect to the total sugar content than the reducing sugar content.Filtration raised concentration of ethanol.Among the factors affecting the ethanol production,the initial pH of fermentation was themost remarkable one,and fermentation temperature and initial kelp concentration came second.When the initial kelp concentration was 0.15 g/L,the fermentation temperature 34℃,the initial pH 6.5 and the volume of fermentation was 200 mL,the maximum ethanol concentration was reached,with the equivalent of 4.09 g ethanol per 100 g kelp.This work provides scientific basis and technical support for finding an operational path in ethanol production from kelp fermentation.
ethanol;fermentation;kelp
TQ517
A
1672-3678(2013)06-0001-08
10.3969/j.issn.1672-3678.2013.06.001
2012-10-20
国家自然科学基金(40873058)
夏天虹(1987—),女,四川宜宾人,硕士研究生,研究方向:生物质乙醇;翁焕新(联系人),教授,E⁃mail:gswenghx@zju.edu.cn
