同型半胱氨酸测定试剂性能评价
2013-07-07林广民
林广民
(漯河市中心医院检验科,河南 漯河 462000)
同型半胱氨酸测定试剂性能评价
林广民
(漯河市中心医院检验科,河南 漯河 462000)
目的对利德曼同型半胱氨酸测定试剂盒进行性能评价。方法用日立7600-110全自动生化分析仪P模块检测血清中同型半胱氨酸含量,对试剂的准确度,精密度,线性,灵敏度,特异性,稳定性,系统比对等对试剂性能验证和系统评估。结果试剂准确度。批内精密度,批间精密度,线性范围,灵敏度,特异性,稳定性,系统比对均达到要求标准。结论利德曼同型半胱氨酸试剂符合临床诊断试剂标准要求,可以用于临床诊断。
同型半胱氨酸;性能评价;试剂
高同型半胱氨酸是心脑血管疾病重要,独立的危险因素,同型半胱氨酸浓度升高与心脑血管疾病的发生密切相关,同型半胱氨酸升高还可引起神经管畸形及先天性畸形等出生缺陷类疾病[1-10]。具有较高的临床应用价值。本文参照厂家试剂说明书和美国国家实验室标准化委员会(NCCLS)EP10-A2文件要求,对利德曼同型半胱氨酸测定试剂盒进行初步评价。
1 材料与方法
1.1 材料
1.1.1 仪器和试剂
日立7600-110全自动生化分析仪。北京利德曼生物工程有限公司同型半胱氨酸测定试剂盒 批号012263K
1.1.2 校准液和质控血清
北京利德曼生物工程有限公司校准液 北京利德曼生物工程有限公司质控血清。伯乐质控品低值,中,高值。
1.1.3 样本
体检无溶血,黄疸,脂血混和血清20mL。高值同型半胱氨酸样本一份。
1.2 方法
1.2.1 准确度评价
按实验室常规操作程序,进行同型半胱氨酸项目定标,测定利德曼高,中,低三个水平质控品,每份质控品重复测定3次,计算3次重复测定的均值。计算每份质控品均值与靶值的偏差,将每份样本的偏差与企业标准(偏差<±5%)进行比较。
1.2.2 精密度评价
批内精密度将伯乐质控品高,中,低三个浓度水平分为20份同批连续测定,计算标准差(sd)和变异系数(cv),与企业标准cv<5%进行比较批间精密度,连续20d测定伯乐高,低两个个浓度水平质控品,每天测定一次。收集20d测定的数据,计算sd 和cv,与卫生部室间质量评价活动的最大允许误差cv<6%比较。
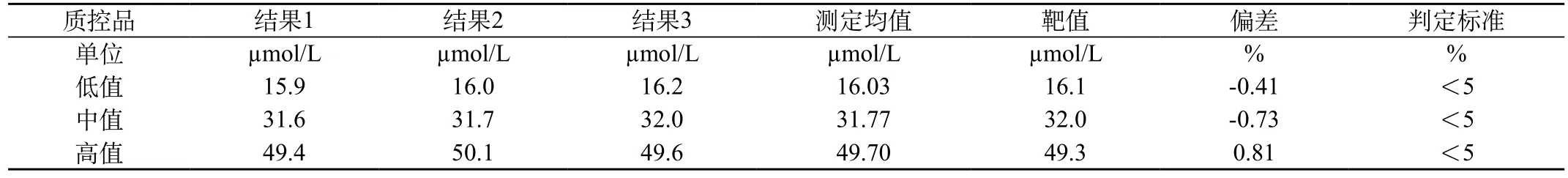
表1 准确度评价实验结果

表2 精密度评价实验结果
1.2.3 线性范围评价
将高值样本血清进行倍比稀释,比例分别为1/2,1/4,1/8,1/16,1/32,1/64,每个样本测定两次,测定顺序为原液,1/2,1/4,1/8,1/16,1/32,1/64.0,和0,1/64,1/32,1/16,1/8,1/4,1/2,原液。求理论浓度与实测均值之间的线性关系,满足线性相关系数r>0.975,斜率在0.97~1.03之间。
1.2.4 分析灵敏度
取空白样本(生理盐水),重复测定20次。计算均值(χ—±s)和标准差(sd),则分析灵敏度等于 ±2sd,当检测系统给出小于分析灵敏度的值,即可报告为无分析物检出。
1.2.5 特异性评价,在混合血清中分别添加胆红素,血红蛋白,三酰甘油,红细胞,等干扰物质,分析添加干扰物质样本和对照样本的测值偏差。判定标准:测定结果偏差>10%判定存在干扰
1.2.6 系统比对将利德曼试剂和和光试剂分别按照试剂说明书在日立7600-110全自动生化分析仪上设定参数,试剂盒定标后,同时检测血清样本40例,样本浓度包含高值及正常值,浓度要求有梯度分布,测定在2h内完成。结果数据以利德曼试剂测定值为X,和光试剂测定值为Y,计算回归方程及相关系数r,要求相关系数r>0.975.
1.2.7 稳定性
开瓶上机稳定性,在第一次校准后,开瓶置于仪器试剂仓内,以后不再校准,每天检测质控品,记录失控时试剂在机器内放置天数,
1.3 统计学处理
实验数据采用SPSS 13.0统计软件处理。
2 结 果
2.1 准确度评价测定结果
见表1。表1说明质控品三个浓度水平偏差均小于厂家声明标准5%符合要求。
2.2 精密度评价结果
见表2。表2说明 质控品三个浓度水平批内测定变异系数小于厂家说明书要求的5%,批间测定20日,变异系数小于卫生部室间质量评价6%,符合要求。
2.3 线性评价
测试数据,经过计算,在浓度0-70µmol/L范围内理论浓度Y与实测数值X之间的线性方程为Y=0.984X-0.2096 相关系数r=1.000 符合厂家说明书声明标准。
2.4 灵敏度评价
分析灵敏度的计算值为0.1µmol/L,符合厂家说明书要求。
2.5 分析测定当胆红素<20mg/dL,血红蛋白<500mg/dL,三酰甘油<500mg/dL,抗坏血酸<50mg/dL,红细胞<0.4%时,测定结果偏差<10%,对检测结果未产生显著干扰。符合厂家说明书性能要求。
2.6 系统比对
在日立7600-110生化分析仪P模块上,利德曼试剂和和光试剂测定数据相关系数r为0.998,相关性良好,符合要求。
2.7 稳定性
试剂在仪器试剂仓内贮存可稳定不失控天数>30d,符合厂家说明书声明。
3 讨 论
同型半胱氨酸是心脑血管疾病的独立危险因子。同型半胱氨酸的测定越来越受到临床医师的重视,评价结果表明,豪迈公司的同型半胱氨酸试剂盒(双试剂循环酶法),各项性能指标能达到临床诊断试剂性能要求。适合在全自动生化分析仪上使用。
[1] 杨振华,王治国.临床实验室质量管理[M].北京:人民卫生出版社, 2004:155-160.
[2] 赵世巧,陈忠余,梁华,等.以国际通用标准评价五种胱抑素C试剂的方法学性能[J].国际检验医学杂志,2012,33(13):15814-1589.
[3] 齐长福.载脂蛋白A1与载脂蛋白B液体双试剂性能评价[J].检验医学与临床,2009,6(2):10-111.
[4] 徐国宾,蒋琳.临床生物化学常规定量方法的分析性能评价[J].中华检验医学杂志,2007,30(6):718-720.
[5] 冯仁峰.临床检验质量管理技术基础[M].上海:上海科学技术文献出版社,2007:37-42.
[6] 陈忠余,赵世巧,梁华,等.应用NCCLS EP10-A2文件对五种半胱氨酸蛋白酶抑制剂C试剂进行初步评价[J].国际检验医学杂志, 2012,33(2):157-159.
[7] 张秀明,温冬梅,袁勇.临床生物化学检验质量管理与标准操作程序[M].北京:人民军医出版社,2007:103.
[8] 孙宏华,石凌波,康红,等.应用NCCLS EP10-A2文件分别对自建和配套生化检测系统进行初步性能评价[J].检验医学,2010,25 (5):345-348.
[9] National Committee for Clinical Laboratory Standards. Preliminary Evaluation of Quantitative Clinical Laboratory Methods; Approved Guideline[S].EP10-A2.NCCLS,2002.
[10] 钟兰,林瑜,蔡玉玲.Dia Say公司抗链球菌溶血素O与类风湿因子试剂性能评价[J].临床检验杂志,2007,25(6):412.
R446;R54
B
1671-8194(2013)18-0103-02
