3种方法对板栗壳多糖提取的比较
2013-07-06张丛兰杨登想
刘 齐, 杨 芳, 杜 萍, 张丛兰, 杨登想,*
(1.湖北大学知行学院,湖北武汉 430011;2.昆明理工大学分析测试研究中心,云南昆明 650093;3.云南省分析测试中心,云南昆明 650093)
板栗俗称栗子,有“干果之王”的美称.对板栗入药的使用在历代的医药古籍中都有记载,栗壳为板栗的外果皮,药性甘、涩、平,具有降逆、止血的功效,主治反胃、鼻衄、便血等症[1].
多糖(polysaccharide)也称聚(合)糖是能被水解生成许多单糖的糖类,为单糖的缩聚物,一般为非晶体物质.多糖不是一种纯粹的化学物质,而是聚合程度不同的物质的混合物[2].不均一多糖通过共价键与蛋白质构成蛋白聚糖发挥生物学功能[3-4],如作为机体润滑剂、血型物质的基本成分等.20世纪80年代以来,科学家对植物多糖,特别是对中药中的多糖研究产生了浓厚兴趣[5],近年来,有学者对于板栗多糖功能活性进行研究,发现板栗多糖具有清除自由基,抗氧化等多种功能活性[6].
正因为板栗的实用以及药用价值,所以现在对板栗的各部分都进行了一定的基础理论研究和探讨[6-7]。本实验主要以板栗壳中多糖为研究对象,分别利用超声波提取法、水提法和碱提法对板栗壳中多糖进行提取,以提取率作为评价指标,比较出更加适合板栗壳多糖提取的方法,为后续板栗壳多糖功能性研究提供技术支持.
1 材料和方法
1.1 材料、试剂及设备
板栗是壳斗科栗属中国板栗(Castanea mollissima),采自湖北省罗田县,板栗在4℃条件下贮藏,实验前取壳做待测材料.乙醚、乙醇、丙酮、硫酸、三氯甲烷、正丁醇、蒽酮、NaOH均为分析纯.
722型分光光度计,上海天普分析仪器制造厂;超声波萃取仪,上海比朗仪器有限公司.
1.2 方法
1.2.1 样品预处理
参照文献[7-9]的方法对样品预处理:研磨成粉→乙醚去脂→乙醇去蛋白→活性炭脱色→干燥.
板栗壳用粉碎机粉碎,过筛40目,利用无水乙醚索氏抽提6~12 h,取粉末,弃脂肪.然后利用无水乙醇,以1 mg/mL的质量浓度浸泡提取4 h,去除蛋白.最后分别用少量95%乙醇和丙酮洗涤.所得粉末样品经活性炭粉脱色、干燥备用.
1.2.2 多糖提取和除杂
准确称取经预处理的样品2 g于锥形瓶中,分别进行超声波提取、水提取和碱提取.提取后的混合液用真空泵抽滤,取20 mL,移入分液漏斗中分离滤液,加入三氯甲烷和正丁醇(V(三氯甲烷)∶V(正丁醇)=4∶1)混合萃取液10 mL[10],剧烈振荡20 min使其充分混匀提取上清液,除去蛋白质[11].反复多次,至不再出现灰白色黏液为止.并将上清液取5.0 mL移入50 mL容量瓶中定容,得到上清稀释液[12].
1.2.3 多糖标准曲线的绘制
参照文献[13]进行多糖标准曲线的绘制.分别吸取葡萄糖标准溶液(100 mg/L)0,0.2,0.4,0.6,0.8,1.0 mL依次置于6个试管中,再分别加入去离子水至1.0 mL.摇匀后,按顺序向试管中加入新配置的0.5 mL蒽酮的乙酸乙酯试剂和5 mL浓硫酸,立即将试管放入沸水浴中,准确保温10 min,取出后自然冷却至室温,以空白作对照,在620 nm波长下测其吸光度,以吸光度为纵坐标,以质量浓度为横坐标,绘制标准曲线,并求出标准线性方程.
1.2.4 多糖含量测定
取经提纯除杂后的样品提取液1 mL于比色管中,加入0.5 mL蒽酮乙酸乙酯试剂和5 mL浓硫酸,充分振荡,立即将试管放入沸水浴中,准确保温10 min,取出后自然冷却至室温,并在620 nm波长处测定吸光值(A)[14],以1 mL蒸馏水作空白对照.根据标准曲线计算多糖含量,并计算多糖的提取率.
1.2.5 产品提取率的计算

所有数据均利用SPSS Statistics 20软件分析.
2 结果与分析
2.1 标准曲线线性方程
建立的多糖测定标准曲线线性回归方程为y=0.005x;R2=0.996 5,标准曲线如图1,其中纵轴为吸光度;横轴为质量浓度,μg/mL.
2.2 超声波提取法
2.2.1 功率的影响

图1 葡萄糖的标准曲线Fig.1 Standard curve of glucose
板栗壳经预处理之后,以蒸馏水为提取溶剂,在料液比(样品质量浓度)为1∶90(g/mL),作用时间为20 min条件不变的情况下,研究不同功率下对板栗壳多糖提取率的影响,其结果如图2.由图2可以看出,当超声波功率为150 W时,多糖得率较高,故取150 W进行正交试验.
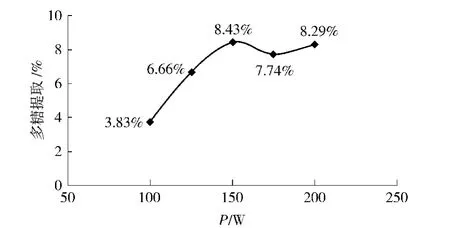
图2 不同超声波功率对板栗壳多糖提取率的影响Fig.2 Effects of different powers of ultrasonic extraction on yield of chestnut shells polysaccharides
2.2.2 时间的影响
在超声波功率150 W,料液比为1∶90(g/mL)的条件下,研究不同提取时间对板栗壳多糖提取率的影响,结果如图3.由图3可以看出,当超声波提取时间为25 min的时候,提取率较高.因此取25 min进行正交试验.
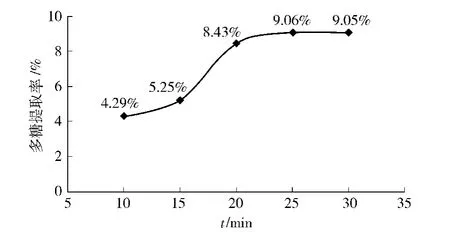
图3 不同超声波作用时间对板栗壳多糖提取率的影响Fig.3 Effects of different time of ultrasonic extraction on yield of chestnut shells polysaccharides
2.2.3 料液比的影响
在选定功率为150 W,时间25 min的条件不变的情况下,研究不同料液比对板栗壳多糖提取率的影响,其结果如图4.由图4可以看出,料液比为1∶70(g/mL)时提取率较大,故取料液比为1∶70(g/mL)做正交试验.
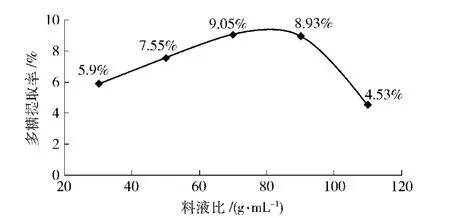
图4 超声波提取中不同料液比对板栗壳多糖提取率的影响Fig.4 Effects of different liquid ratio of ultrasonic extraction on yield of chestnut shells polysaccharides
2.2.4 正交试验结果
以料液比、提取时间、提取功率为影响因素,采用正交试验确定各因素对板栗壳多糖提取率的影响,选用L9(33)正交设计表安排实验,以多糖得率为指标优选较佳提取工艺.正交试验及结果见表1.
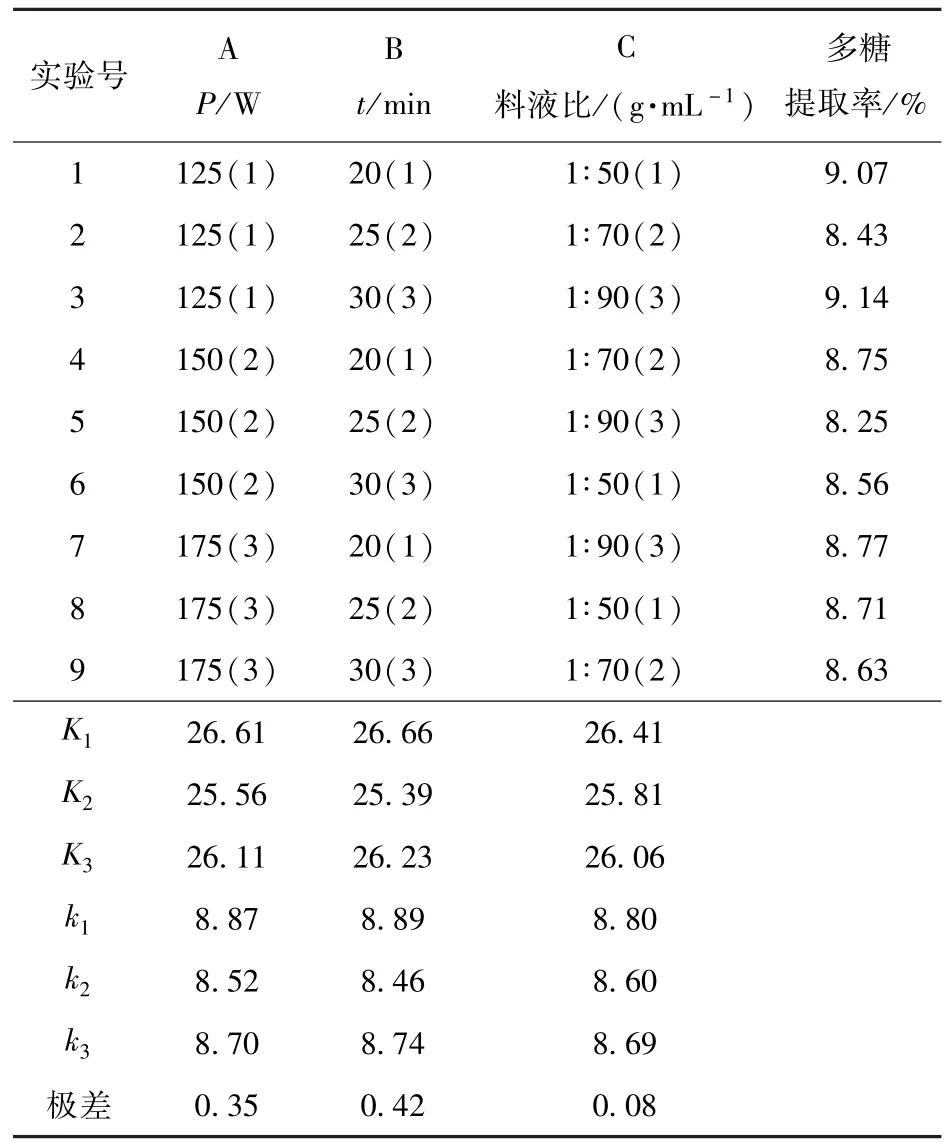
表1 超声波提取法正交试验及结果Tab.1 Results of orthogonal design for yield of chestnut shells polysaccharides by ultrasonic extraction
由表1可知,在超声波提取板栗壳多糖的实验中,各因素对多糖提取率的影响依次为:作用时间>功率>料液比.其实验的较佳组合为A1B3C3.进行3次重复实验得到多糖提取率的平均值为9.15%.
2.3 水提取法
2.3.1 温度的影响
在料液比1∶80(g/mL),时间3 h,次数1次的条件下,研究不同提取温度对于板栗壳多糖提取率影响,结果见图5.从图5可以看出,在80℃时提取率较大,故取80℃做正交试验.

图5 水提法中不同提取温度对板栗壳多糖提取率的影响Fig.5 Effects of different temperature of water extraction on yield of chestnut shells polysaccharides
2.3.2 料液比的影响
在温度为80℃,提取时间为3 h,提取次数为1次的条件下,研究不同料液比对于板栗壳多糖提取率的影响,其结果如图6.由图6可以看出,随着料液比加大,吸光度的变化呈W型,在料液比为1∶90(g/mL)时达到较大,之后还有上升趋势,鉴于在工业生产中加大料液比会增加生产成本,因此料液比设计在 1∶90(g/mL).

图6 水提法中不同料液比对板栗壳多糖提取率的影响Fig.6 Effects of different liquid ratio of water extraction on yield of chestnut shells polysaccharides
2.3.3 时间的影响
在温度为80℃,提取次数为1次,料液比1∶80(g/mL)条件下,研究不同提取时间对于板栗壳多糖提取率的影响,其结果如图7.由图7可知,提取时间为2.5 h时提取率较大,随后开始减小,故取2.5 h做正交试验.
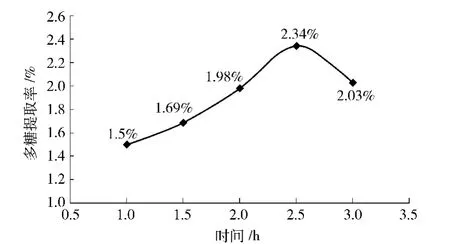
图7 水提法中不同提取时间对板栗壳多糖提取率的影响Fig.7 Effects of different hours of water extraction on yield of chestnut shells polysaccharides
2.3.4 提取次数的影响
在其他相同条件下提取不同次数,测定结果如图8.从图8可以看出,提取次数越大,吸光度越小,即提取一次时提取率较大,因此在实际生产中,应选择提取一次.
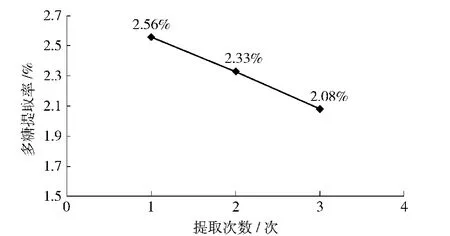
图8 水提法中提取次数对板栗壳提取率的影响Fig.8 Effects of different times of water extraction on yield of chestnut shells polysaccharides
2.3.5 水提取法正交试验
水提取法对板栗壳多糖正交试验及结果见表2.由表2可以看出水提法提取板栗壳多糖的实验中提取温度、提取次数、提取时间、料液比的影响顺序为:提取温度>提取时间>料液比>提取次数,也就是说提取温度影响较大.确定较佳组合为A2B2C1D3,即提取的较优水平为:提取温度90℃,提取时间2 h,料液比为1∶90(g/mL),提取2次.按照该条件做重复实验3次计算提取率平均值为5.99%.
2.4 碱提取法
2.4.1 料液比的影响
在温度70℃,0.5 mol/L的NaOH溶液提取2 h,提取1次的条件不变的情况下,研究不同料液比对板栗壳多糖提取率的影响,结果如图9.

表2 水提法正交试验及结果Tab.2 Results of orthogonal design for yield of chestnut shells polysaccharides by water extraction

图9 碱提法中不同料液比对板栗壳多糖得率的影响Fig.9 Effects of different liquid ratio of alkali extraction on yield of chestnut shells polysaccharides
由图9知,当料液比处于1∶45(g/mL)时提取率较大,故取料液比为1∶45(g/mL)做正交试验.
2.4.2 温度的影响
在0.5 mol/L的NaOH溶液提取2 h,料液比为1∶40(g/mL),提取1次条件不变的情况下,研究不同提取温度对于板栗壳多糖提取率的影响,结果如图10.由图10可知应当选用80℃做正交试验.
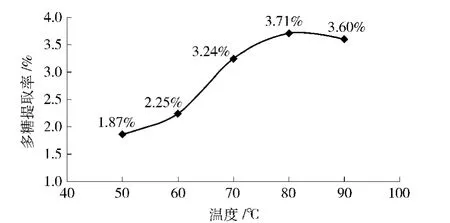
图10 碱提法中不同提取温度对板栗壳多糖得率的影响Fig.10 Effects of different temperature of alkali extraction on yield of chestnut shells polysaccharides
2.4.3 碱浓度的影响
在温度为70℃,提取2 h,料液比为1∶40(g/mL),提取1次条件不变的情况下,研究不同碱浓度对提取率的影响,其结果如图11.由图11知,应当选用0.6 mol/L氢氧化钠做正交实验.
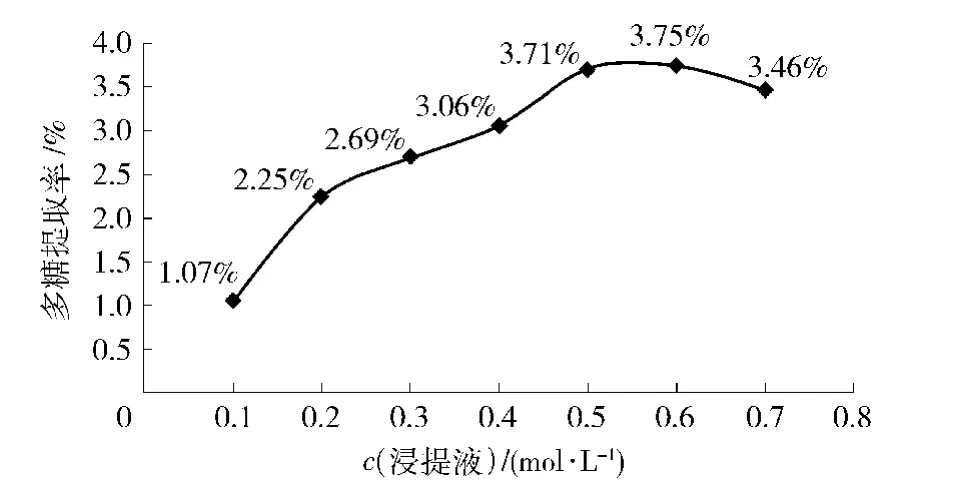
图11 碱提法中不同碱浓度对板栗壳多糖得率的影响Fig.11 Effects of different concentration of alkali extraction on yield of chestnut shells polysaccharides
2.4.4 时间的影响
在温度为70℃,0.5 mol/L的NaOH溶液,料液比为1∶40(g/mL),提取1次条件不变的情况下,分别提取20,30,60,90,120,150 min,多糖的提取率变化如图12.由图12知,提取时间为90 min较佳,此时提取率最大.应当选用提取90 min做正交试验.
2.4.5 碱液提取法正交试验结果
在碱液提取法板栗壳多糖时,料液比,提取温度,提取时间和碱浓度均对提取效果产生影响(见表3),其中最为显著的是提取温度,其次是料液比,影响较小的是提取时间和提取液浓度,即各因素对提取率影响的主次顺序为B>A>C>D.较优水平组合为A3B3C1D1,即较佳提取条件为:用0.5 mol/L的氢氧化钠,在1∶50(g/mL)的料液比下,于90℃水浴中提取60 min,在此条件下提取板栗壳中的多糖三次,多糖的提取率为4.72%.
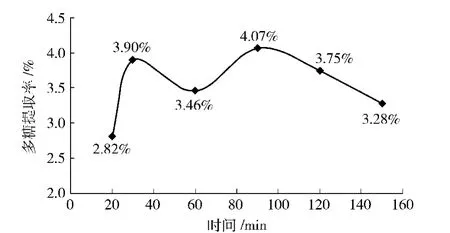
图12 碱提法中不同提取时间对板栗壳得率的影响Fig.12 Effect of different hours of alkali extraction on yield of chestnut shells polysaccharides
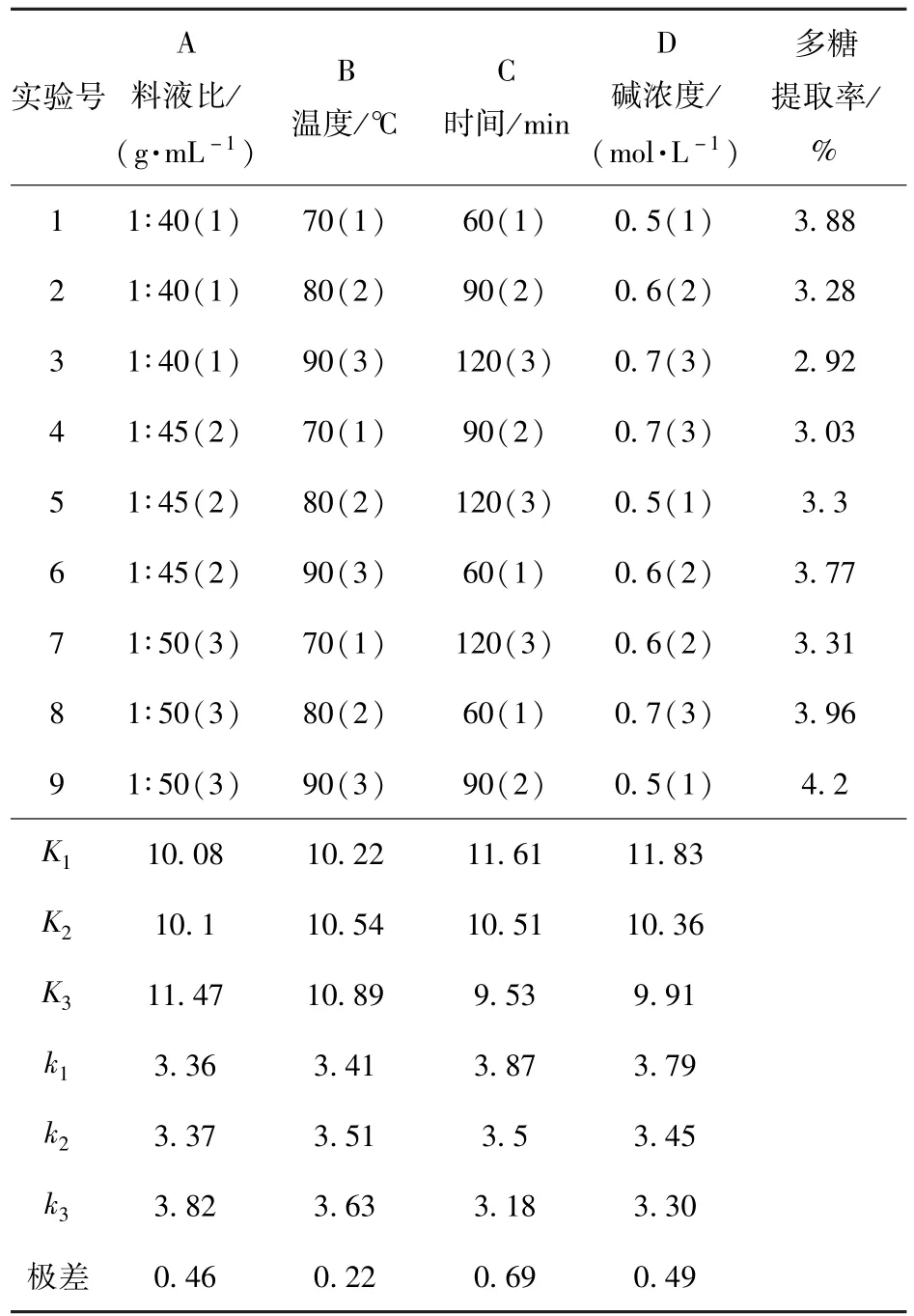
表3 碱提法正交试验因素水平表Tab.3 Results of orthogonal design for yield of chestnut shells polysaccharides by alkali extraction
2.5 提取方法结果比较
对超声波提取法、水提取法、碱提取法提取法3种方法优化结果进行数据分析发现,3种方法提取率之间均呈现显著性差异(p<0.01).超声波提取率最高,能够达到9.15%.同时相比于其他2种提取方式而言其提取时间只需要30 min,远少于其他2种方法,且在室温下便可进行,提取条件相对温和.碱提法虽然在多数文献中运用较多[15-22],但本实验数据显示该方法中碱液消耗较大且提取率最差.因此,在板栗壳多糖提取的过程中,应当首要考虑超声波提取的方法而放弃碱提法.
3 结 论
经比较在通过正交试验优化工艺之后,超声波提取法的提取率为9.15%,水提取法的提取率为5.99%,碱提取法的提取率为4.72%.由此看出超声波提取法的提取效果较好,超声波提取法的较佳工艺的功率为125 W,超声波时间为30 min,料液比为1∶90(g/mL).同时,相对于碱提取法和水提取法而言,超声波提取法不会产生大量的废水,其环保、节能的优点亦不容忽视.
参考文献:
[1] 罗凤莲.板栗淀粉的理化特性与板栗产品开发研究[D].长沙:湖南农业大学,2004(6):34-36.
[2] 孙丽芹,董新伟,刘玉鹏,等.脂类的自动氧化机理[J].中国油脂,1998,23(5):56-57.
[3] 李小平,陈锦屏,阎雅岚.红枣多糖提取方法研究进展[J].江西农业学报,2007,19(10):102-104.
[4] 刘齐,刘爱红,孙美玲,等.嗜酸乳杆菌胞外多糖提取工艺优化[J].食品与发酵工业,2011,37(2):200-204.
[5] 谷绒.超声波和微波法对木耳多糖提取量的比较[J].食品研究与开发,2010,31(3):23--25.
[6] 李润丰,刁华娟,彭友舜,等.板栗多糖的提取及抗氧化活性研究[J].食品研究与开发,2011,32(8):21-25.
[7] 郭雷,郝倩,孙颖,等.板栗壳活性成分的提取工艺条件研究[J].江苏农业科学,2010,145(3):21-24.
[8] 熊俐,黄治国,罗惠波,等.枸杞多糖提取工艺优化研究[J].四川食品与发酵,2008,44(1):58-60.
[9] 施翠娥,蒋立科,李苗苗.大豆多糖提取分离工艺的优化研究[J].安徽农学通报,2009,15(3):148-150.
[10] 褚立军,但飞君,鄢文芳,等.超声波提取白根独活多糖工艺研究[J].安徽农业科学,2010,38(12):6216-6217,6230.
[11] 陈吉生,吕剑豪.枸杞多糖提取工艺研究[J].医药导报,2010,29(5):649-652.
[12] 高宛莉,王丽,杜瑞卿.仙人掌多糖提取工艺优化[J].农技服务,2009,26(11):133-134.
[13] 刘齐,刘爱红,孙美玲.嗜酸乳杆菌胞外多糖提取工艺优化[J].食品与发酵工业,2011,37(2):200-206
[14] 王浩然,魏福祥,马晓珍,等.板栗壳棕色素提取方法的比较研究[J].河北工业科技,2010,27(6):20-24.
[15] 刘海英,范永山,张运峰,等.白灵菇菌丝多糖碱溶液浸提法提取工艺的改进[J].北京农学院学报,2009,24(3):55-58.
[16] 朱建飞,杨嗦啦,陈岗,等.碱提苏紫饼粕多糖的工艺优化[J].食品研究与开发,2011,32(2):69-71.
[17] 刘培勋,高小荣,徐文清,等.银耳碱提多糖抗氧化活性的研究[J].中国生化药物杂志,2005(3):169-170.
[18] Wang Xinmin,Li Yuwei,Lian Ruili,et al.Preliminary study on the liquid fermentation and polysaccharide production of Ganoderma[J].Agricultural Science&Technology,2007,8(3-4):15--19.
[19] Cao Lizhen,Lin Zhibin.Regulatory effect of ganodermalucidum polysaccharides on cytotoxic T-lym phoeytes induced by dendritic cell in virto[J].Acta Pharmacol Sin,2003,24(4):321-326.
[20] Borges O,Goncalves B,de Carvalho J S,et al.Nutritional quality of chestnut(Castanea sativa Mill)cultivars from Portugal[J].Food Chemistry,2008,106(3):976-984.
[21] Pereira-Lorenzo S,Ramos-Cabrer A M,Diaz-Hernandez M B,et al.Chemical composition of chestnut cultivars from Spain[J].Scientia Horticulturae,2006,107:306-314.
[22] Poritosh R,Hitomi U,Nobutaka N,et al.Determination of physicochemical properties of chestnuts[J].Journal of Food Engineering,2008,87(4):601-604.
