猪流行性腹泻病毒N蛋白的原核表达及生物学活性鉴定
2013-07-04陈如敬吴学敏车勇良王隆柏庄向生刘玉涛周伦江
陈如敬,吴学敏,车勇良,王隆柏,魏 宏,庄向生,刘玉涛,严 山,周伦江
(福建省农业科学院畜牧兽医研究所 福建省畜禽疫病防治工程技术研究中心,福州 350013)
猪流行性腹泻是由猪流行性腹泻病毒引起的以腹泻、呕吐和脱水为典型特征的急性高度接触性肠道传染病。该病多发生在冬春寒冷季节,以10日龄以内哺乳仔猪发病和高死亡率为特征,多见于和猪传染性胃肠炎病毒(Porcine transmissible gastroenteritis virus,TGEV)、轮状病毒(Porcine rotavirus,RV)等其他肠道病毒混合感染,对养猪业危害极大[1-4]。
PEDV属于尼多病毒目(Nidovirales)冠状病毒科(Coronaviridae)冠状病毒属(Coronavirus),为不分节段的线性单股正链RNA,目前仅见有一个血清型[5]。基因组靠近3′端5 kb区域内有5个主要的开放阅读框,编码有典型的冠状病毒结构蛋白:N蛋白、M蛋白、sM蛋白和S蛋白[6]。其中N蛋白是由441个氨基酸组成的,分子量为55~58 kDa之间的磷酸化的核衣壳蛋白[7]。在感染PEDV的早期,就能产生较高水平抗N蛋白抗体,而且N蛋白的保守性高,所以利用PEDV的N蛋白为基础来建立PEDV的分子生物学诊断技术具有很好的应用前景[8-11]。本研究旨在对PEDV-FJ11A株N基因进行克隆并原核表达,并对表达的目的蛋白进行生物学鉴定,为建立一种以N蛋白为抗原的PEDV血清学诊断方法奠定基础。
1 材料与方法
1.1 主要试剂和工程菌AMV反转录酶、dNTP Mixture、RNA酶抑制剂、BamH I限制性内切酶、SacI限制性内切酶、T4 DNA连接酶、DNA回收试剂盒购自宝生物工程(大连)有限公司,GoTaqMaster Green Mix 购自 Promega,Plasmid Mini Kit质粒提取试剂盒购自OMEGA,IPTG、兔抗猪IgG/辣根酶(HRP)标记购自sigma,蛋白质Marker购自Fermentas,DH5α 大 肠 杆 菌(Escherichia coli)、BL21大肠杆菌(Escherichia coli)感受态细胞均购自北京全式金生物技术有限公司,pET-32a载体由福建省畜禽疫病防治工程技术研究中心保存。
1.2 病毒和血清猪流行性腹泻病毒PEDV-FJ11A株、猪流行性腹泻病毒阳性血清、伪狂犬病毒阳性血清、猪繁殖与呼吸综合征病毒阳性血清和猪标准阴性血清均由福建省畜禽疫病防治工程技术研究中心保存。
1.3 原核表达阳性重组质粒的构建
1.3.1 引物设计 参照GenBank中登录的PEDV的 N蛋白基因序列信息,设计合成N蛋白基因片段的特异性上下游引物,在上下游引物5'端分别引入BamHI、SacI酶切位点,预期扩增片段为1100 bp左右。具体引物序列如下:PEDV-N-F:5'-ATTGGAT CCTTCTACTACCTCGGAA-3'; PEDV-N -R:5'-TTAGAGCTCAGATCTCGTTGATAAT-3'。所有引物均由宝生物工程有限公司合成。
1.3.2 目的基因的扩增 参考文献[4]提取RNA并反转录成cDNA,用设计的特异性引物进PCR扩增,扩增体系为 50 μL,其中 2×GoTaqMaster Green Mix 25 μL、上下游引物各1 μL、cDNA模板1 μL,补充灭菌ddH2O至终体积50 μL。反应条件:94℃预变性5 min后进入循环;94℃变性1 min,52℃退火35 s,72℃延伸 1 min,30个循环;72℃终延伸10 min。反应结束,取5μL PCR产物进行核酸电泳鉴定后用胶回收试剂盒进行回收。
1.3.3 阳性重组质粒pET32a-PEDV-N-DH5α的构建 将胶回收产物与原核表达载体后pET32a分别用BamHI、SacI进行双酶切并对双酶切产物进行胶回收。用T4 DNA连接酶进行连接过夜,转化DH5α感受态细胞后,挑菌摇菌后提取质粒进行双酶切鉴定,将阳性重组质粒送宝生物工程有限公司进行序列测定。测序鉴定为阳性的重组质粒即为阳性重组质粒pET32a-PEDV-N-DH5α。
1.3.4 原核表达pET32a-PEDV-N的鉴定 将鉴定的阳性重组质粒pET32a-PEDV-N转化BL21大肠杆菌感受态细胞中,方法同1.3.3进行鉴定,筛选出原核表达阳性重组质粒pET32a-PEDV-N,同时设pET-32a空载体对照。
1.4 目的蛋白的表达将1.3中构建好的原核表达阳性重组质粒pET32a-PEDV-N菌液100 μL加入到5 mL LB培养基中震荡培养至OD值为0.5时,加入IPTG至终浓度0.5 mmol/L,取不同时间段(诱导表达 1、2、3、4 h)表达产物 1 mL,超声裂解后进行SDS-PAGE。
1.5 重组表达蛋白的生物学活性鉴定
1.5.1 SDS-PAGE和Western blot鉴定 将超声裂解产物在12%蛋白胶进行SDS-PAGE电泳,电泳结束后一块胶进行考马斯亮蓝染色,脱色后观察电泳结果。将另一块胶转印到硝酸纤维素膜,Western blot用的一抗为自制的PEDV阳性血清(1:100),酶标二抗为兔抗猪IgG/辣根过氧化物酶(HRP)(1:10 000),以空载体诱导的菌液和猪PEDV抗体阴性的血清作为阴性对照,按常规步骤做Western blot,用DAB显色观察结果。
1.5.2 ELISA方法鉴定 用超声裂解产物包被ELISA板,分别以PEDV阳性血清、PRV阳性血清和猪标准阴性血清为一抗(1:100稀释),以兔抗猪IgG/辣根过氧化物酶(HRP)为酶标二抗(1:5000),进行间接ELISA检测。
2 结果与讨论
2.1 N重组质粒PET-32a-PEDV-N的双酶切鉴定利用BamHI和SacI对原核表达重组阳性质粒PET-32a-PEDV-N进行双酶切,酶切结果经1%的琼脂糖凝胶电泳分析与预期的目的片段大小相符(见图1)。

图1 PET-32a-PEDV-N的双酶切鉴定Fig.1 The restriction enzyme digestion of recombinant plasmid PET-32a-PEDV-N
2.2 表达产物的SDS-PAGE检测和Western blot鉴定将原核表达阳性重组质粒PET-32a-PEDV-N的菌液经IPTG在37℃条件下诱导4 h后,表达产物经12%的SDS-PAGE检测,可见在60 kDa左右处有一条明显的蛋白带,与预期结果相符,而未诱导的对照菌以及诱导后的空载体细菌没有明显特征条带(图 2)。Western blot检测结果在约 60 kDa处出现特异性免疫印迹,而阴性对照未发现特异性印迹(见图 3)。

图2 目的蛋白的SDS-PAGE鉴定Fig.2 SDS-PAGE analysis of the target protein
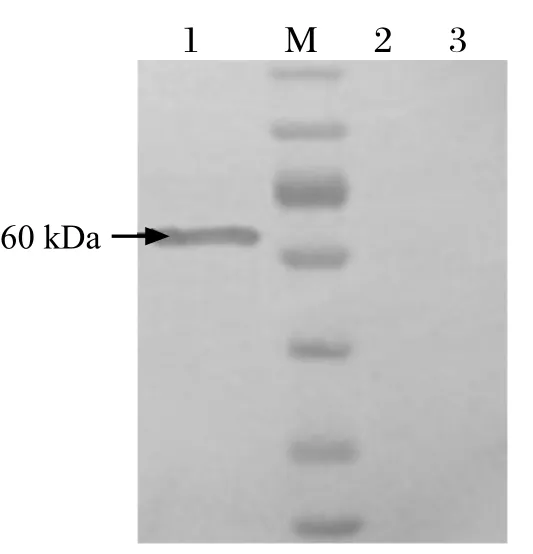
图3 目的蛋白的Western blot分析Fig.3 Western blot analysis of the target protein

图4 目的蛋白间接ELISA检测Fig.4 The indirect-ELISA test for the target protein
2.3 ELISA鉴定经初步建立的ELISA结果表明,所表达的目的蛋白与猪伪狂犬病毒(Pseudorabies virus,PRV)阳性血清、猪繁殖与呼吸综合征病毒阳性血清和猪PEDV抗体阴性血清OD值均小于0.15,与猪流行性腹泻病毒(Porcine epidemic diarrhea virus,PEDV)阳性血清OD值为0.825(图4)。
2.4 由于PEDV的严重危害性,国内外学者在针对PEDV疫苗上做了大量工作,并广泛使用[12-14],但是这并未从根本上控制PEDV的流行。PEDV的免疫机理和侵入机制的研究报道较少,在一定程度上制约了对PEDV的诊断和控制。
PEDV的N蛋白是由441个氨基酸组成一种磷酸化RNA结合蛋白,在病毒RNA合成过程中发挥着重要的作用。它能与细胞膜和磷脂结合,借助核(或核仁)定位信号转移到细胞核(核仁),参与细胞核仁的功能调节,干扰宿主细胞的周期,促进病毒的组装和RNA复制体的形成。并且N蛋白在PEDV的结构蛋白中所占的比例最大,在感染的细胞中能得到大量表达,而且猪在感染PEDV早期体内就能产生抗N蛋白的高水平抗体[7,11]。
N蛋白是感染细胞中表达量最为丰富的结构蛋白,其大小在 45 ~ 60 kDa[15]。研究表明:PEDV 感染细胞中病毒粒子N蛋白大小是58 kDa[16],重组杆状病毒表达的N蛋白大小是56 kDa[17];而且这两种形式的N蛋白都是磷酸化产物。本研究利用RTPCR技术成功扩增PEDV FJ11A株的N基因片段,并将其和原核表达载体pET-32a连接,构建原核表达重组质粒pET-32a-PEDV-N,建立了高效表达N蛋白的原核表达体系,SDS-PAGE、Western blot和间接ELISA结果均表明,所表达的重组N蛋白的实际大小约为60 kDa,有较好的生物学活性,又鉴于PEDV的N蛋白高度保守,可用于PEDV感染的血清学诊断,可作为病原学诊断有效补充[18-20],为PEDV的防控奠定基础。
[1]Sergeev O V.Porcine epidemic diarrhea [J].Vopr Virusol, 2009, 54(2): 4-8.
[2]Puranveja S, Poolperm P, Lertwatcharasasakul P,et al.Chinese-like strain of porcine epidemic diarrhea virus,Thailand [J].Emerg Infect Dis, 2009, 15(7): 1112-1115.
[3]Pensaert M and Deebouck P.A new Coronavirus like particle associated with diarrhea in Swine [J].Arch Virol,1978, 58: 243-247.
[4]陈如敬, 吴学敏, 车勇良, 等.猪流行性腹泻病毒FJ-11A株的分离与ORF3基因序列分析[J].福建农业学报,2011, 26(6): 947-951.
[5]Brian D A, Baric R S.Coronavirus genome structure and replication[J].Curr Top Microbiol Immunol, 2005, 287:1-30.
[6]张强敏, 郭福生, 尹燕博, 等.猪流行性腹泻病毒分子生物学特征[J].中国病毒学, 2002, 17(4):381-384.
[7]吕茂杰, 陈建飞, 时红艳, 等.猪流行性腹泻病毒核衣壳蛋白与感染细胞核磷蛋白的共定位分析[J].微生物学报 , 2011, 51(5): 643-647.
[8]Sun D, Shi H, Chen J,et al.Generation of a mouse scFv library specific for porcine aminopeptidase N using the T7 phage display system[J].J Virol Methods, 2012, 182(1-2): 99-103.
[9]Li G, Ren X.Differentiation of porcine reproductive and respiratory syndrome virus N protein using a virus-based ELISA[J].Hybridoma (Larchmt), 2011, 30(2): 195-198.
[10]Li B X, Ge J W and Li Y J.Porcine aminopeptidase N is a functional receptor for the PEDV coronavirus[J].Virology, 2007, 365(1): 166-172.
[11]孙东波 , 冯力 , 时洪艳 , 等 .猪流行性腹泻病毒分子生物学研究进展 [J].动物医学进展 , 2006, 27(10):11-14.
[12]Liu D Q, Ge J W, Qiao X Y,et al.High-level mucosal and systemic immune responses induced by oral administration with Lactobacillus-expressed porcine epidemic diarrhea virus (PEDV) S1 region combined with Lactobacillus-expressed N protein[J].Appl Microbiol Biotechnol, 2012, 93(6): 2437-2446.
[13]Bernasconi C, Guscetti F, Utiger A,et al.Experimental infection of gnotobiotic piglets with a cell culture adapted porcine epidemic diarrhoea virus: clinical,histopathological and immunohistochemical findings[J].Proceedings of the 3rd ESVV Congress, Interlaken,Switzerland, 1995, 542-546.
[14]马思奇, 王明, 周金法, 等.猪流行性腹泻病毒适应Vero细胞培养及传代细胞毒氢氧化铝灭活疫苗免疫效力试验[J].中国畜禽传染病, 1994, (2): 15-19.
[15]Master P S.The molecular biology of coronaviruses [J].Adv Virus Res, 2006, 66: 193-198.
[16]Egberink H F, Ederveen J, Callebaut P,et al.Characterization of the structural proteins of porcine epidemic diarrhea virus, strain CV777[J].Am J Vet Res,1988, 49(8): 1320-1324.
[17]Singh M.A novel internal open reading frame product expressed from a polycistronic of porcine epidemic diarrhea virus may not contribute to virus attenuation [J].J Gen Virol, 1999, 80 ( Pt 8): 1959-1963.
[18]佟有恩, 冯力, 李伟杰, 等.猪流行性腹泻弱毒疫苗株的培育[J].中国畜禽传染病, 1998, 20(6): 329-332.
[19]Kim S, Kim I, Pyo H,et al.Multiplex real-time RTPCR for the simultaneous detection and quantification of transmissible gastroenteritis virus and porcine epidemic diarrhea virus [J].J Virol Methods, 2007, 146(1-2):172-177.
[20]刘邓, 袁秀芳, 冉多良, 等.TaqMan荧光定量PCR检测猪流行性腹泻病毒方法的建立与初步应用[J].中国动物传染病学报, 2010, 18(1): 28-33.
