2012年上海地区发病鸡群H9N2亚型禽流感病毒的变异分析
2013-07-04葛菲菲杨德全鞠厚斌周锦萍
葛菲菲,刘 健,杨德全,鞠厚斌,周锦萍
(上海市动物疫病预防控制中心,上海 201103)
禽流感病毒(Avian influenza virus,AIV)是危害养禽业和人类健康的重要病原,已发现有16个血凝素(hemagglutinin,HA)亚型[1]和10个神经氨酸酶(neurominidase,NA)亚型。H9N2亚型禽流感病毒最早于1966年从火鸡体内分离到[2],虽然表现低致病性,但由于传播广泛、能造成免疫抑制并使宿主容易发生继发感染,特别是可导致鸡群产蛋下降或完全停止,对养禽业造成巨大经济损失,其危害不容忽视。H9N2亚型禽流感病毒的进化与变异不仅会给目前禽流感的防制带来困难,而且还有传染给人的潜在威胁,因此,加强H9N2亚型禽流感病毒变异株的监测和防控措施研究具有重要的现实意义。近年来,H9N2亚型禽流感的流行变得日益频繁,病毒也进入了一个快速进化阶段,有可能进一步发生遗传变异而进化出致病力更强的毒株,或是受体结合位点的突变导致出现具有能结合人和哺乳动物流感病毒受体的特性,或者抗原性变异后导致免疫失败现象发生[3-5]。本研究对2012年分离自上海地区三个发病鸡群的3株H9N2亚型AIV进行了全基因测序,以阐明发病鸡群中H9N2亚型禽流感病毒分离株的遗传变异及分子特征。为更好地了解近年来中国H9N2亚型禽流感病毒毒力变化和抗原性变异的特点及可能的机理,并为该病的防控提供参考依据。
1 材料与方法
1.1 试剂 引物和鸡胚A型禽流感病毒通用荧光RT-PCR检测试剂盒,H5亚型和H9亚型禽流感病毒荧光RT-PCR检测试剂盒,以及新城疫病毒荧光RT-PCR检测试剂盒均购自深圳匹基生物工程有限公司;鸡传染性支气管炎病毒引物序列根据国标GB/T 23197-2008鸡传染性支气管炎诊断技术合成;SPF鸡胚购自北京梅里亚维通实验动物技术有限公司;新城疫阳性血清、禽流感血凝素分型血清(H5、H9)由哈尔滨兽医研究所提供;AMV反转录酶等试剂均购自宝生物(大连)工程公司;针对H9亚型禽流感病毒8个基因片段HA、NA、M、NS、NP、PA、PB1、PB2基因分别设计了相关引物,由于PA、PB1和PB2基因片段较长,所以分成两段进行扩增,引物由上海英骏生物技术有限公司合成,具体见表1。
1.2 发病鸡群2012年1月和2月上海地区三个发病鸡群临床症状主要为咳嗽,张口呼吸,眼睑肿胀,部分鸡有下痢现象,已用抗生素治疗,未见明显效果;病变部位也主要集中在呼吸道器官:气管充血、出血,气囊炎,肺实变、淤血、坏死;部分病死鸡脚鳞出血,肌胃、腺胃交界处有出血点,脾脏出血,其他脏器、消化道等未见明显异常。
1.3 病毒的初步鉴定采集病死鸡的气管、肺、脑和肾脏等内脏研磨,提取核酸,进行了禽流感病毒、新城疫病毒以及鸡传染性支气管炎病毒的检测,并同时进行了细菌分离。结果为H9亚型禽流感病毒阳性。将H9阳性样品处理后接种鸡胚尿囊腔,将分离毒尿囊液应用β-微量法进行HA试验,以检测其血凝性及HA效价。根据HA试验中所测得的HA效价,将分离毒尿囊液配制成4单位的溶液,分别用新城疫阳性血清,禽流感H5和H9阳性血清进行HI试验,以检测该分离物的血凝性是否能被禽流感H9阳性血清所抑制,详细步骤按照GB/T 18936-2003 高致病性禽流感诊断技术。
1.4 病毒全基因的RT-PCR扩增用病毒RNA提取试剂盒提取病毒基因组RNA,具体步骤按照说明书进行。RT-PCR产物电泳经凝胶回收后,按pMD18-T载体说明书进行连接、转化,用EcoRI和HindIII进行双酶切鉴定;鉴定为阳性克隆后送英骏生物有限公司测序。
1.5 基因cDNA核苷酸序列及推导的氨基酸序列分析比较借助 DNAStar 4.0 分析软件 ,通过 Jotun Hein方法分析比较所得序列的同源性以及一些关键位点的变化情况。
1.6 遗传进化分析借助MEGA3.1分析软件,确定8个基因片段的遗传分类情况。

表1 引物序列和目的片段长度Table 1 The primers sequences and the length of PCR products
2 结果
2.1 病毒的初步鉴定结果经实验室检查、细菌分离阴性,结果鉴定为H9亚型禽流感病毒阳性。从上述三个发病鸡群分离、鉴定的禽流感病毒分别命名为A/chicken/ Shanghai / C1 /2012、A/chicken/ Shanghai/C2/2012、A/chicken/ Shanghai/C3/ 2012, 所 分 离 的3株病毒感染的鸡胚尿囊液血凝性能够被H9型阳性血清所抑制,而不能被H5型阳性血清所抑制,表明这3株病毒均为H9亚型,NA基因经测序后,表明这3株病毒为H9N2亚型。
2.2 cDNA全序列同源性比较以及关键位点的分析这3株H9N2亚型禽流感病毒的全基因序列在GenBank的登录号为KC417046~KC417069。3株H9亚型AIV的HA基因cDNA全序列,均为1683 bp,没有核苷酸的插入和缺失,核苷酸序列同源性为99.1%~99.2%,推导的氨基酸序列同源性为99.1%~99.3%。裂解位点序列分析发现,所有毒株均为RSSR↓GLF,对禽类为低致病力。对3株毒株的一些关键位点进行分析并与以往从上海地区健康鸡群中分离的4株H9N2毒株进行了比较[6],这4株H9N2病毒分别是Ck/SH /Y1/02(Genbank NO.GQ335466)、Ck/SH /Y1/06 (Genbank NO.GQ335474)、Ck/SH /Y2/07 (Genbank NO.GQ335498)、Ck/SH /Y1/08 (Genbank NO.GQ335506),上述所有毒株受体结合位点的右缘均相同,为GTSKA(位于HA的aa146~aa150);与以往分离的4株毒株相比,本研究中3株毒株的HA基因因220位氨基酸的的变异而缺失一个糖基化位点,受体结合位点的左缘235位发生了变异,由Q突变成了M。此外,对公认的抗原位点进行了分析[7],表2所示:从HA基因抗原位点的分析,与疫苗株Ck/SD/6/96相比,这3株H9N2亚型禽流感病毒7个抗原位点中已有4个发生了改变;与2002年~2008年期间分离的4株H9N2毒株相比,这3株病毒和07年的分离株抗原位点相同。
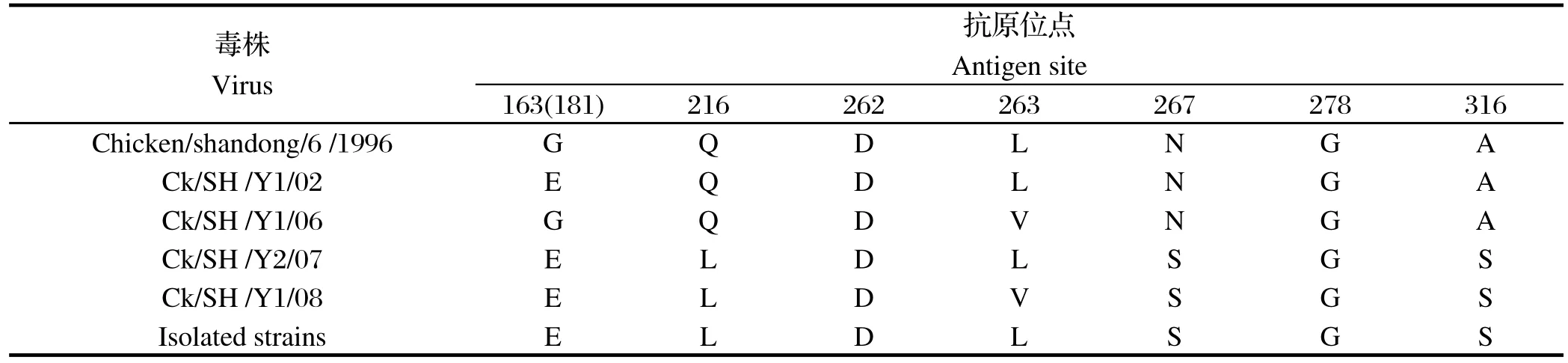
表2 抗原位点的分析Table 2 The analysis of antigenic sites
2.3 株分离株的8个基因片段的遗传发生关系从本研究建立的H9N2亚型禽流感病毒8个基因系统发育树发现(图1),上海地区分离的这3个毒株均属于Ck/Bei/1/94系,与目前在上海使用的疫苗株Ck/SD/6/96同属于一个谱系。各片段所属基因型如表3所示。这3株毒株的8个基因片段所属基因型相同,他们与08年的分离株Ck/SH /Y1/08 8个基因片段所属基因型相同。
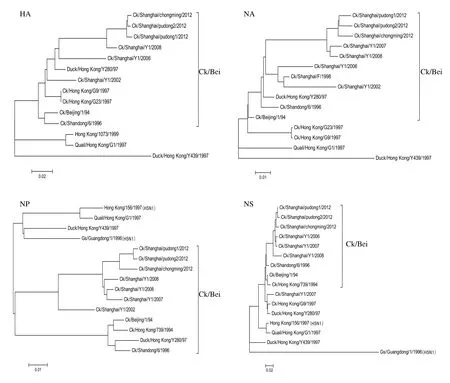
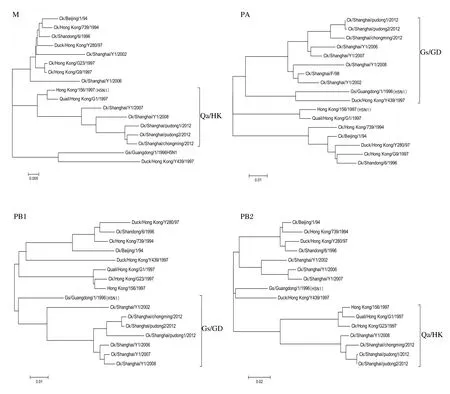
图1 2012年上海地区发病鸡群中H9N2亚型AIV HA、NA、NP、NS、M、PA、PB1、PB2基因进化树Fig.1 Phylogenetic tree of the HA, NA, NP, NS, M, PA, PB1, PB2 genes of the H9N2 subtype Avian infl uenza viruses from diseased chicken fl ocks in Shanghai area in 2012
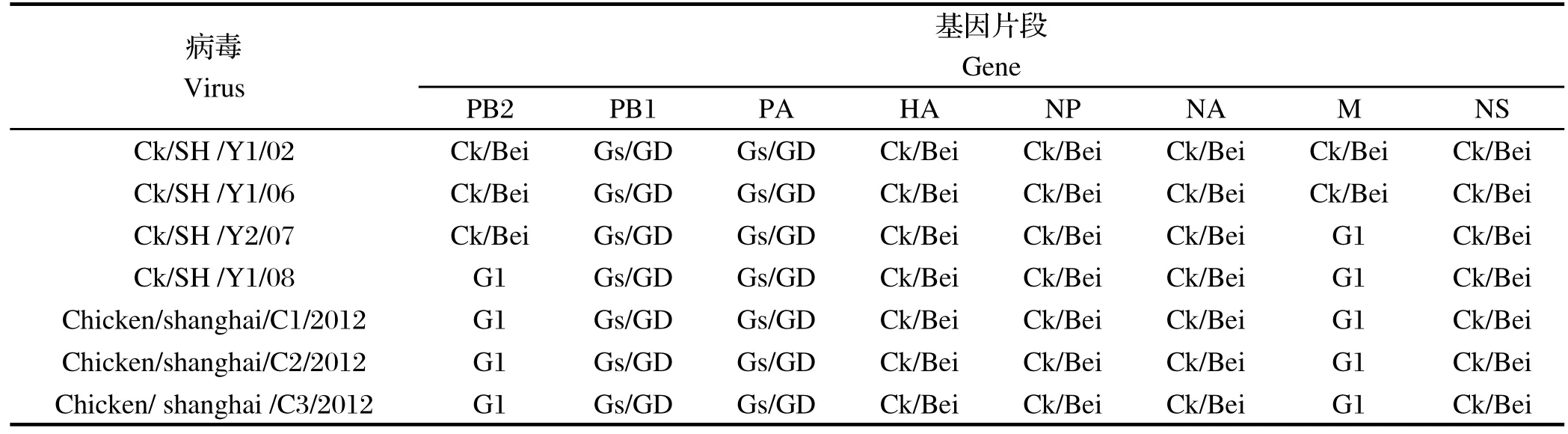
表3 H9亚型不同基因的基因分型结果比较Table 3 Comparison of the genotypes of different segments from H9 subtype Avian infl uenza virus
3 讨论
本研究主要针对发病鸡群中分离的H9N2亚型禽流感病毒进行基因进化研究,从分子水平了解其抗原变异和致病力。HA糖蛋白是A 型流感病毒主要表面抗原和保护性抗原,HA糖蛋白的抗原特性直接影响病毒的感染性、致病性、宿主特异性及组织嗜性。但HA基因变异频率很高,不同位点,尤其是重要氨基酸位点的变异能导致禽流感病毒的抗原性和致病性变异。HA蛋白潜在的糖基化位点也是影响禽流感病毒致病力的重要因素,受体结合位点附近的糖基会影响病毒和宿主细胞的结合水平,裂解位点附近的糖基可能通过干扰蛋白酶进入裂解位点影响蛋白酶对HA前体蛋白的裂解。大部分文献报道,HA蛋白潜在的糖基化位点的出现和增加会使病毒株的毒力下降,而本研究中从发病鸡群分离的3株H9N2毒株,与以往我们从健康鸡群中分离的H9N2禽流感毒株相比[6],因220位氨基酸的变异而缺失一个糖基化位点,受体结合位点的左缘235位发生了变异,由Q突变成了M。上述位点的改变是否影响病毒的致病性,宿主特异性以及抗原性,有待于进一步研究。此外也有文献报道[8],H9N2亚型AIV变异株HA蛋白在145~147位氨基酸出现1个新的潜在糖基化位点,但同时表现为毒力增强,糖基化位点在序列上所处的位置可能是导致这一差异的原因,因为该糖基化位点刚好处于发生漂变的关键氨基酸位点上,当然,其中的确切机制和相关性尚有待研究。此外,通过对HA基因上已公布的7个抗原位点进行分析表明,临床上分离的毒株与使用的疫苗株相比,部分位点已发生变异,所以目前使用的疫苗能否给禽群提供足够的保护力还需要作进一步的研究。本研究中的3株毒株均为重组体,均属于Ck/Bei/1/94系,这3株病毒与Ck/SH / Y1 / 08 8个基因片段均属于同一个基因群。随着时间的推移,Qa/HK/G1/97的基因片段在H9N2亚型禽流感病毒内部基因片段重排中出现的频率增加了。综上所述,在今后的工作中加强H9N2亚型禽流感流行病学监测是非常必要的。
[1]Fouchier R A, Munster V, Wallensten A,et al.Characterization of a novel influenza A virus hemagglutinin subtype (H16)obtained from black- headed gulls [J].J Virol, 2005, 79(5):2814-2822.
[2]Homme P J, Easterday B C.Characteristics of influenza A-turkey-Wisconsin-1966 virus [J].Avian Dis, 1970,14: 66-74.
[3]Zhang P, Tang Y, Liu X,et al.Characterization of H9N2 influenza viruses isolated from vaccinated flocks in an integrated broiler chicken operation in eastern China during a 5 year period (1998-2002) [J].J Gen Virol,2008, 89(12): 3102-3112.
[4]Sun Y, Pu J, Jiang Z,et al.Genotypic evolution and antigenic drift of H9N2 influenza viruses in China from 1994 to 2008 [J].Vet Microbiol, 2010, 146 (3-4): 215-225.
[5]Park K J, Kwon H I, Song M S,et al.Rapid evolution of low-pathogenic H9N2 avian influenza viruses following poultry vaccination programmer[J].J Gen Virol, 2011, 92(1): 36-50.
[6]Ge F, Zhou J, Liu J,et al.Genetic Evolution of H9 Subtype Influenza Viruses from Live Poultry Markets in Shanghai, China.J Clin Microbiol, 2009, 47(10): 3294-3300.
[7]Wu Z Q, Ji J, Zuo K J,et al.Cloning and phylogenetic analysis of hemagglutinin gene of H9N2 subtype avian influenza virus from different isolates in China during 2002 to 2009.Poult Sci, 2010, 89(6): 1136- 1143.
[8]陈陆, 郑鹿平, 赵军, 等.H9N2亚型禽流感病毒HA蛋白S145N变异株致病性及抗原特性.畜牧兽医学报, 2012,43(1): 82-89.
