解纤维梭菌培养条件的优化
2013-06-30王朗刘志丹王天民吴筱张翀汪群慧邢新会
王朗,刘志丹,王天民,吴筱,张翀,汪群慧,邢新会
1 北京科技大学土木与环境工程学院,北京 100083
2 中国农业大学水利与土木工程学院,北京 100083
3 清华大学化工系教育部工业生物催化重点实验室,北京 100084
木质纤维素类生物质被认为是第二代生物能源的主要原料,然而其致密牢固的分子结构制约了其高值化利用。解纤维梭菌 Clostridium cellulolyticum 是一种能够分泌纤维小体高效降解纤维素的反刍类中温纤维素降解菌[4-6]。纤维小体是一种具有降解纤维素、半纤维素和胶质能力的胞外酶复合体,它普遍存在于厌氧菌中,能在打破和利用结晶纤维素方面起到至关重要的作用。然而具有纤维小体的多数是厌氧菌,它们的生长速率慢,且培养密度不高,严重影响了厌氧类纤维素降解菌的工业应用。因此,对诸如C.cellulolyticum 类的具有纤维小体的厌氧菌进行高密度培养,将有利于解决纤维素等生物质能源底物降解的瓶颈。根据目前已有的文献报道,C.cellulolyticum 的最佳生长条件是34℃、pH 7,但由于对环境厌氧度要求高和代谢等方面的影响,它的培养密度较低,已有的最高培养细胞浓度也仅为0.863 g/L[8]。迄今为止,对C.cellulolyticum高密度培养的研究报道很少,常规培养时的最终细胞浓度(OD600)都在0.8左右[9],制约了该菌的工程应用。
本论文为了探讨C.cellulolyticum 的高密度培养方法,以解纤维梭菌培养最常用的CM3培养基作为原始培养基[10-12],利用响应面法优化,确定最佳培养基和培养条件,并在发酵罐中进行培养,从而探索C.cellulolyticum 高密度培养的可能性及其发酵特性。响应面法是一种快速有效优化培养基的方法,它可以综合实验设计和数学建模,通过实验模拟因素和结果的函数关系,得到局部的优化实验结果[13]。因此,近年来响应面优化在生物化学等领域得到了广泛的应用[14]。本论文将为进一步建立C.cellulolyticum 的高密度培养方法提供基础数据。
1 材料与方法
1.1 菌株及培养条件
解纤维梭菌Clostridium cellulolyticum DSM 5812购买于德国菌种保存中心 Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH (DSMZ)。所购买的菌株经CM3固体平板活化2代后,转接液体培养基以供后续实验所需。
发酵培养基为CM3培养基:纤维二糖6 g/L,酵母提取物2 g/L,(NH4)2SO41.3 g/L,KH2PO41.5 g/L,K2HPO4·3H2O 2.9 g/L,MgCl2·6H2O 0.2 g/L,CaCl20.075 g/L,FeSO4·7H2O 1.25 mg/L,刃天青1.0 mg/L,cystine-HCl·H2O 0.5 g/L,微量元素1.0 mL,FeCl2·4H2O 1.5 g,ZnCl270 mg,MnCl2·4H2O 100 mg,H3BO36 mg,CoCl2·6H2O 190 mg,CuCl2·2H2O 2 mg,NiCl2·6H2O 24 mg,Na2MoO4·2H2O 36 mg)。
培养条件是初始pH 7.2,温度37℃,转速170 r/min。培养用的种子菌是经过液体培养40 h后的菌液。所有培养均在厌氧条件下进行。
1.2 方法
1.2.1 厌氧培养
实验所用的厌氧培养小瓶为50 mL 的血清瓶,装液量是20 mL。将配制好的培养基分装于血清瓶中,用橡胶塞密封,并用高纯氮鼓气以排除瓶内氧气。鼓气完毕后,将装有培养液血清瓶置于高压灭菌锅中灭菌(121℃,15 min),待冷却后观察培养基颜色,以刃天青为指示剂,培养液不出现粉红色即可用于厌氧培养。所有的摇瓶实验都做3个平行,取平均值进行实验数据分析。
1.2.2 发酵罐批式培养
实验采用的是Sartorius Biostat A plus型发酵罐。有效容积5 L,装液量为3 L。罐体内发酵液的pH 是实时监测的,发酵罐则通过pH 的数据控制酸碱的泵。调节pH 用的酸为1 mol/L HCl溶液,碱为3 mol/L 的NaOH 溶液。种子菌在摇瓶培养40 h 后接入发酵罐。罐体内一直通入氮气以保持发酵罐的厌氧度。
1.2.3 菌体浓度测定
菌体生物量用比浊法进行测定。在紫外分光光度计600 nm 的吸收波长下测定其吸光度值,从而表征菌体生长量。
1.2.4 产物分析
代谢副产物有机酸由高效液相色谱(HPLC-10A,SHIMADZU 公司)测定。液体样品经过离心(12000 r/min,10 min),上清液用孔径为0.22µm 的滤膜过滤后进行分析。液相色谱选用Shodex RSpak KC-811有机酸分析柱,该柱尺寸为300 mm×8 mm。色谱分析条件为:柱温40℃,流动相为0.1%高氯酸,流速为1.0 mL/min,样品进样量为20µL,选用示差检测器。
1.2.5 酶活分析
菌液稀释10倍,取0.5 mL 加入2 mL 羧甲基纤维素缓冲液(CMC-Na 1 g 溶解于100 mL 蒸馏水中,加入20 mLHAC-NaAC buffer (pH 7)混匀)。在34℃恒温水浴锅中糖化1 h,取出测还原糖浓度。定义在34℃和pH 7的条件下,1 min内产生相当于1µg 葡萄糖的还原糖量的酶量为1 U。其中还原糖浓度采用3,5-二硝基水杨酸比色法进行测定[8]。
1.2.6 统计方法
响应面分析是多变量体系寻找最优试验条件的一种简单策略,首先选定出最重要的影响实验结果的因素,然后利用Plackett-Burman 实验设计筛选出显著影响因素,对显著影响因素进行爬坡试验设计,让其接近最优点区域,最后利用中心组合实验设计和响应面分析确定显著影响因素的最优值。即通过构造一个具有明确表达形式的多项式替代试验,以近似描述目标函数对设计变量的响应特性。实验所采用的分析软件为
Design-Expert v 8.0.6。
2 结果与分析
2.1 Plackett-Burman 实验设计确定显著影响因素
Plackett-Burman 是可以利用最少的实验次数找到最重要的影响因素的实验设计方法[15],选定可能影响实验结果的因素,每个因素设计2个水平,一个高水平(+1)和一个低水平(−1),然后通过实验结果可以模拟出一阶多项式方程。模型所模拟出的公式为

式中,Y 是表征结果数,α0和αi是常系数,Xi是实验所涉及的影响因素。显著影响因素的Prob>F 值一般都小于0.05,也可以根据实验具体情况选定Prob>F 值的界限值。显著影响因素一般选定3个为最佳。因为,随着显著影响因素的增多,后续实验次数就会增加(3个因素做20次,4个因素做31次)[12]。
本实验选取的11个因素分别是纤维二糖、酵母提取物、(NH4)2SO4、 KH2PO4、K2HPO4·6H2O、MgCl2·6H2O 的浓度,以及转速、温度、pH、接种量和一个虚拟变量。
在C.cellulolyticum 培养40 h 后,取样在紫外分光光度计600 nm 处测定菌体的光学密度。实验设计和结果如表1所示。在各因素实验中,最大的OD600值为0.578(表1中条件1所示),而原始培养基培养得到的OD600值为0.303(表1中条件12所示)。拟合的线性方程为
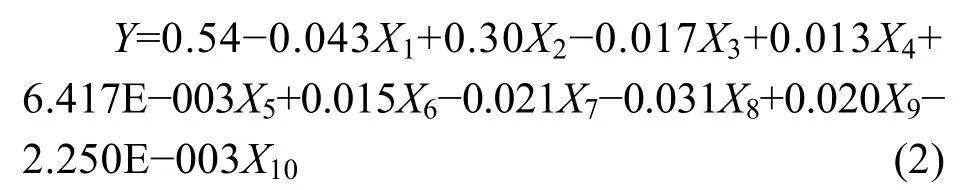
式中,R2为0.9998。表2显示的是方差分析结果,实验选定的Prob>F 值为0.05,该模型的Prob>F 为0.0342,表明此模型有效。其中,纤维二糖浓度、酵母提取物浓度和培养温度的Prob>F 值分别为0.0336、0.0097和0.0460,表明它们均为菌体生长的显著影响因素。
2.2 最陡爬坡实验设计
最陡爬坡实验设计是根据Plackett-Burman实验设计结果的一阶多项式中各因素的系数及方差分析的结果,以实验值变化的梯度方向为爬坡方向,用显著影响因素效应值的大小确定步长,增加或者减少影响因素的实验值,从而达到的实验条件的中心点区域范围[12]。最陡爬坡实验能最快逼近最大响应面区域,确定中心组合实验设计的中心点,并保证响应面分析结果的有效性。
根据Plackett-Burman 实验设计所得到的显著影响因素及数据,得出(NH4)2SO4、KH2PO4、K2HPO4·6H2O、MgCl2·6H2O 浓度,以及转速、pH和接种量对菌体生长无显著影响。因此保持在(NH4)2SO41.3 g/L,KH2PO41.5 g/L,K2HPO4·3H2O 2.9 g/L,MgCl2·6H2O 0.2 g/L,CaCl20.075 g/L,FeSO4·7H2O 1.25 mg/L,刃天青1.0 mg/L,cystine-HCl·H2O 0.5 g/L,微量元素1.0 mL,最初pH 7.2,转速170 r/min,接种量10%。此外,纤维二糖和培养温度对菌体生长存在负影响,在最陡爬坡实验设计中数值应该减小,酵母提取物存在正影响,在实验设计中数值应该增大。实验设计及结果如表3所示,随着3个显著影响因素的不同变化,菌体浓度的变化趋势是先增大后减小,其中条件5对应的菌体浓度达到最大值,OD600值为0.586,响应变量接近最大响应区域。因此,实验条件5可以作为中心组合实验设计和响应面分析的中心点。
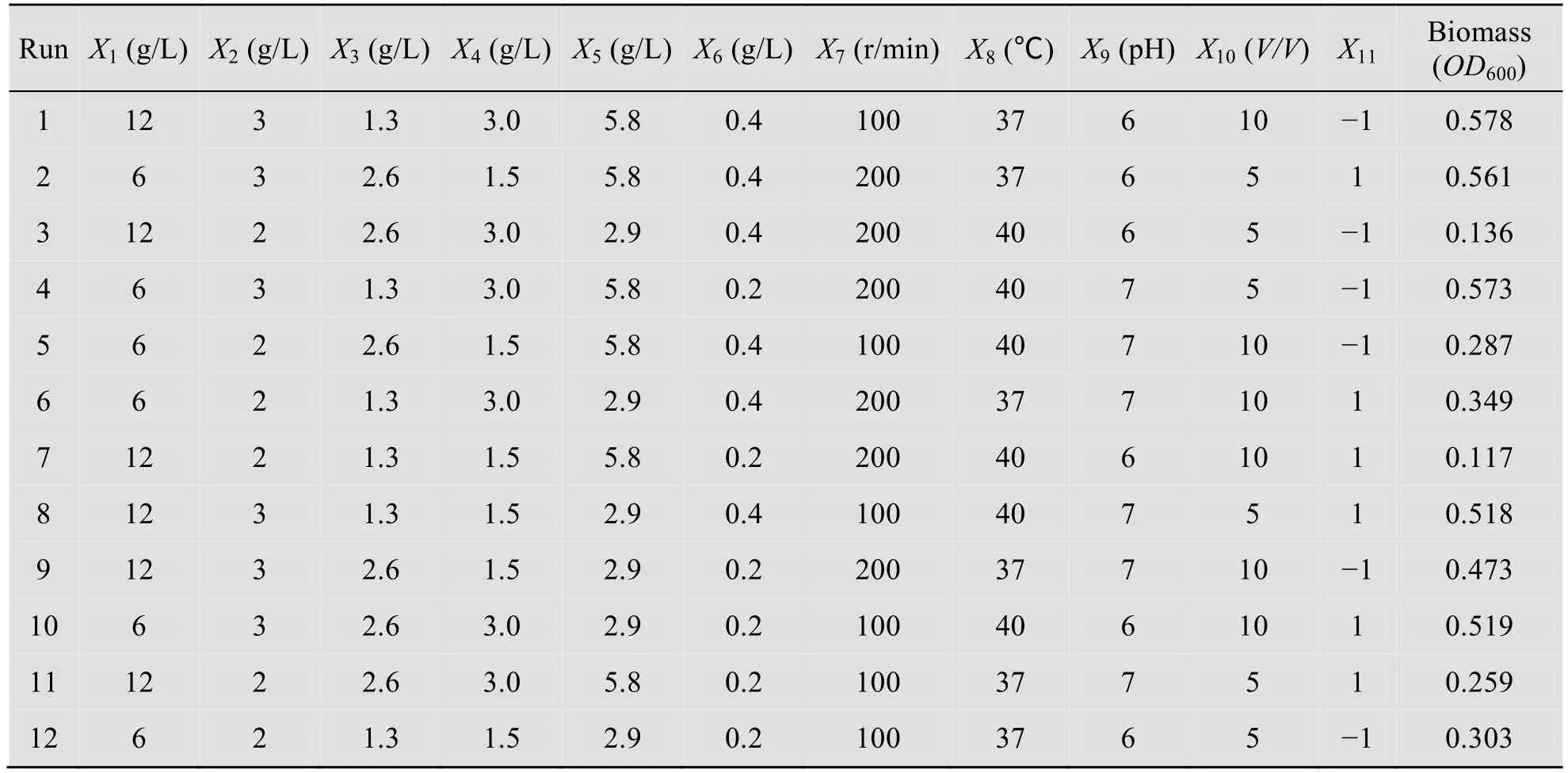
表1 Plackett-Burman 实验设计及结果Table 1 Plackett-Burman experiment design and results

表3 最陡爬坡实验设计及其实验结果Table 3 Experiment design and results of the steepest ascent path
2.3 中心组合实验设计
根据最陡爬坡实验设计逼近最优值区域后,显著影响因素设计5个不同水平(−1.682、−1、0、+1、+1.682)[16],所得的实验结果可以拟合出二次多项式方程,然后数据的多元回归能模拟出显著影响因素的经验模型。二次多项式方程为

式中,Y 是预测响应值,β0、βi、βij和βii是回归系数,β0是截距,βi是一次系数,βii是二次系数,βij是相互系数,Xi和Xj是显著影响因素。中心组合实验设计得到的二次多项式只有在考察的临近区域才符合真实情况,远离此区域的点在响应面实验中几乎是不存在任何意义的[11]。
根据最陡爬坡实验设计中的最优培养条件区域,以表3中条件5为中心点进行中心组合实验,选用臂长为1.682,3个显著影响因素设计20种实验条件,如表4所示。所得到的二次多项式为

式中,X1为纤维二糖浓度,X2为酵母提取物浓度,X8为温度。该模型的R2为0.9145,表明91.45%的条件符合此模型,Prob>F 为0.0003,说明模型的显著性较好,模型的F 值为11.89,表明此模型有效。

表4 中心组合实验设计及其结果Table 4 Central composite design and results

表5 中心组合实验设计回归方程的方差分析Table 5 Statistical analysis of central composite design
2.4 响应面分析
响应面的曲面图解释了显著影响因素之间的相互作用,确定了最优生长情况下显著影响因素的水平。结果如图1所示,每个图都表示在其他因素不影响的情况下,2个显著影响因素之间的相互作用,显著影响因素的值分别为X1=7,X2=3,X8=34。相应的,其他值分别为(NH4)2SO41.3 g/L,KH2PO41.5 g/L,K2HPO4·3H2O 2.9 g/L,MgCl2·6H2O 0.2 g/L , CaCl20.075 g/L ,FeSO4·7H2O 1.25 mg/L,刃天青1.0 mg/L,cystine-HCl·H2O 0.5 g/L,微量元素1.0 mL,最初pH 7.2,转速170 r/min,接种量10%。在此优化下,C.cellulolyticum 菌体浓度OD600由0.303提高到0.586,增加了93.4%。

图1 酵母提取物、纤维二糖浓度和培养温度对菌体生长的影响(A:酵母提取物和纤维二糖对菌体生长的影响,B:培养温度和纤维二糖对菌体生长的影响,C:培养温度和酵母提取物对菌体生长的影响)Fig.1 Influence of yeast extract concentration,cellobiose concentration and culture temperature on the growth of Clostridium cellulolyticum.(A) Response surface for the interaction between yeast extract concentration and cellobiose concentration affecting Clostridium cellulolyticum biomass at 34°C.(B) Response surface for the interaction between culture temperature and cellobiose concentration affecting Clostridium cellulolyticum biomass at yeast extract concentration of 3 g/L.(C) Response surface for the interaction between culture temperature and yeast extract concentration affecting Clostridium cellulolyticum biomass at cellobiose concentration of 7 g/L.
2.5 发酵罐批式培养
C.cellulolyticum 在发酵罐中的培养采用优化后的培养条件。在没有控制pH 的发酵罐中进行培养时,菌体OD600在46 h 达到最大值为2.544(图2)。为了进一步提高细胞密度,将培养液pH控制在7.2,培养结果如图3所示,菌体在72 h达到最大值OD600为3.432(相当于细胞干重浓度1.94 g/L)。相比于摇瓶培养,在发酵罐上的生长情况有很大幅度的提高。这主要可能和发酵罐搅拌更充分,传质效果更好有关。在pH 恒定的情况下,与相同条件下文献报道的相比[11],菌体浓度提高了2.8倍。
对比图2和图3可以看出,在不控制pH 的培养中,初始pH 为7.2,菌体在24 h 进入了指数生长期,糖利用率仅为26.15%,但酸的产生量很少。在46 h 时进入稳定期,同时达到最大菌体浓度,此时的OD600值为2.544,pH降低至6.15,开始产生酸,代谢产物主要以乙醇为主,指数期和稳定期的起始时间与恒pH 发酵的时间差不多一致,然而在58 h 时细胞便进入了衰退期,比恒pH 培养大约提前了14 h。46 h 后pH 降低程度增加,糖的利用率也很低,此时乳酸为主要有机酸。但总体而言,有机酸的量大大低于恒pH发酵。
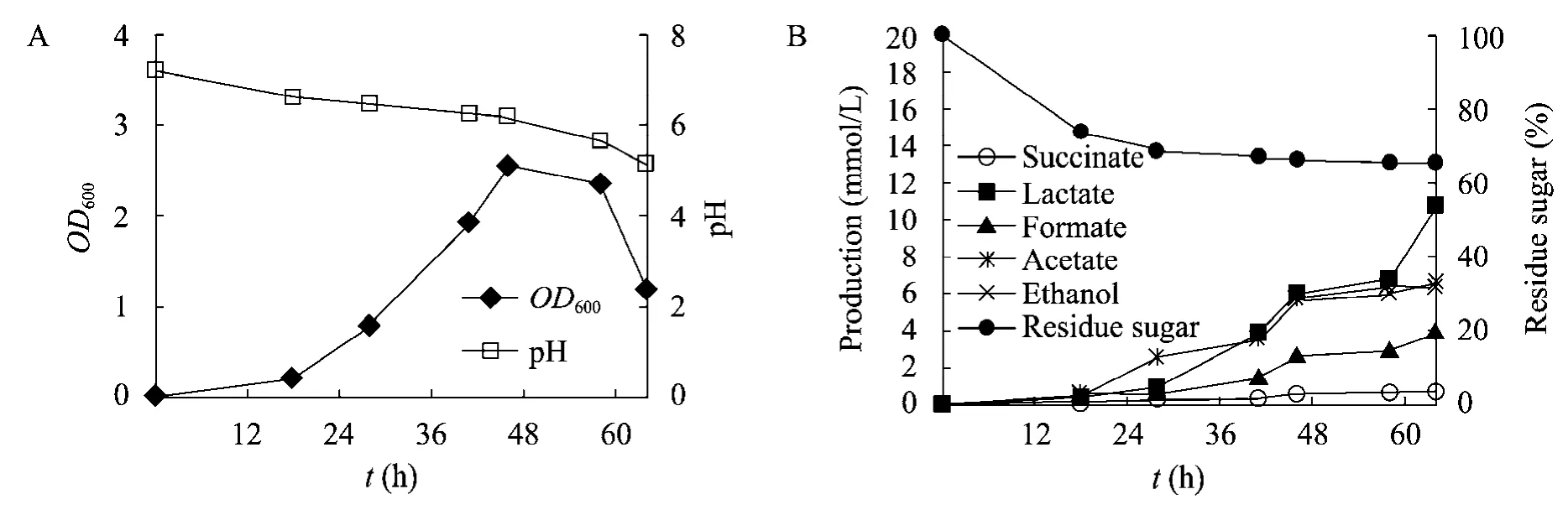
图2 无pH 控制下菌体的pH 变化和生长曲线(A)及还原糖利用和代谢物(B)Fig.2 pH variation and growth (A),and changes in residue sugar and metabolite concentrations (B) without pH control.

图3 恒pH 控制下菌体的pH 变化和生长曲线(A)及残留还原糖和代谢产物浓度变化(B)Fig.3 pH variation and growth (A),and changes in residue sugar and metabolite concentrations (B) with pH control.
从图3可以看出,在恒pH 发酵培养中,pH一直控制在7.2,菌体在24 h 进入指数生长期,此时乙醇大量生成。菌体在72 h 达到最大菌体浓度,此时OD600值为3.432,残余糖含量仅为31.55%,液相检测到的糖成分主要为纤维二糖,未检测到葡萄糖及阿拉伯糖的存在。随着72 h后菌体进入衰退期,代谢物大量生成,特别是甲酸、乙酸。但琥珀酸的含量一直很低。在发酵的96 h 时残余糖含量为31.53%。影响菌体继续生长的原因可能为后期大量酸的生成和碳源的不足。

图4 优化前后菌体CMC 酶活性随培养时间变化比较Fig.4 Comparison of CMC activities of cultures before optimization,after optimization,and after optimization with pH control.
纤维素降解菌对纤维素的降解性能是用酶活来进行表征的。解纤维梭菌培养的关键就在于能够在提高菌体密度的同时不对比酶活产生负面影响。图4为恒pH 罐式发酵与优化前后摇瓶培养菌体比酶活的对比。优化前菌体的最大比酶活为0.29 U/OD600,优化后的最大比酶活为0.34 U/OD600,恒 pH 罐式发酵最大比酶活是0.31 U/OD600,三种情况下菌体的比酶活基本相同。由此可以推测,在相同底物浓度和相同体积的条件下,随着菌体密度增加,单位体积酶活性将相应增加。因此,在保证比酶活的前提下,提高菌体密度是提高解纤维梭菌降解活性的一种有效途径。
综上所述,因为pH 影响解纤维梭菌的代谢产物分布,控制发酵过程pH 是实现高密度培养的重要条件。
3 结论
通过Plackett-Burman 实验设计对影响菌体生长的各因素进行了评价,并有效地找出了显著影响因素,最陡爬坡实验设计充分接近了最大响应面区域,中心组合实验设计建立了显著影响因素的二次多项数学模型,并利用统计学方法对该模型进行了显著性检验,优化了内在因素水平,中心组合实验设计和响应面分析证明了C.cellulolyticum 培养条件优化的有效性。最终优化的培养条件是纤维二糖7 g/L,酵母提取物3 g/L,(NH4)2SO41.3 g/L,KH2PO41.5 g/L,K2HPO4·3H2O 2.9 g/L,MgCl2·6H2O 0.2 g/L,CaCl20.075 g/L,FeSO4·7H2O 1.25 mg/L,刃天青1.0 mg/L,cystine-HCl·H2O 0.5 g/L,微量元素1.0 mL,最初pH 7.2,温度34℃,转速170 r/min,接种量10%。在50 mL 的摇瓶培养中优化后的培养基菌体浓度比原始培养基菌体浓度提高了93.4%。利用优化后的培养条件进行恒pH 的发酵罐培养,菌体OD600值能达到3.432,比文献报道的菌体密度提高了2.8倍。这为后续的研究提供了依据。
[1]Hill J,Polasky S,Nelson E,et al.Climate change and health costs of air emissions from biofuels and gasoline.Proc Natl Acad Sci USA,2009,106(6):2077–2082.
[2]Fang HP,Li CL,Zhang T.Acidophilic biohydrogen production from rice slurry.Int J Hydrogen Energy,2006,31(6):683–692.
[3]Fulton J,Marmaro RW,Egan GJ.System for producing a hydrogen enriched fuel:US,7721682B2.2010-05-25.
[4]Desvaux M,Guedon E,Petitdemange H.Carbon flux distribution and kinetics of cellulose fermentation in steady-state continuous cultures of clostridium cellulolyticum on a chemically defined medium.J Bacteriol,2001,183(1):119–130.
[5]Cailliez C,Benoit L,Thirion JP,et al.Characterization of 10 mesophilic cellulolytic clostridia isolated from municipal solid waste digestor.Curr Microbiol,1992,25(2):105–112.
[6]Giallo J,Gaudin C,Belaich JP,et al.Metabolism of glucose and cellobiose by cellulolytic mesophilic Clostridium sp.strain H10.Appl Environ Microbiol,1983,45(3):843–849.
[7]Doi RH,Kosugi A.Cellulosomes:plant-cell-walldegrading enzyme complexes.Nat Rev Microbiol,2004,2(7):541–551.
[8]Guedon E,Desvaux M,Payot S,et al.Growth inhibition of Clostridium cellulolyticum By aninefficiently regulated carbon flow.Microbiology,1999,145:1831–1838.
[9]Li YC,Tschaplinski TJ,Engle NL,et al.Combined inactivation of the Clostridium cellulolyticum lactate and malate dehydrogenase genes substantially increases ethanol yield from cellulose and switchgrass fermentations.Biotechnol Biofuels.2012,5:2–14.
[10]Jennert KCB,Tardif C,Young DI,et al.Gene transfer to Clostridium cellulolyticum ATCC 35319.Microbiology,2000,146(12):3071–3080.
[11]Desvaux M,Guedon E,Petitdemange H.Metabolic flux in cellulose batch and cellulose-fed continuous cultures of Clostridium cellulolyticum in response to acidic environment.Microbiology,2001,147(6):1461–1471.
[12]Montgonery DC.Design and Analysis of Experiments.New York:John Wiley&Sons,1991.
[13]Ooijkaas LP,Wilkinson EC,Tramper J,et al.Medium optimization for spore production of Coniothyrium minitans using statistically based experimental designs.Biotechnol Bioeng,1999,64(1):92–100.
[14]Plackett RL,Burman JP.The design of optimum multifactorial experiments.Biometrika,1946,33(4):305–325.
[15]Chen XC,Bai JX,Cao JM,et al.Medium optimization for the production of cyclic adenosine 30,50-monophosphate by Microbacterium sp.no.205 using response surface methodology.Biores Technol,2009,100(2):919–924.
[16]Davies OL,George EP,Lewis RC.The Design and Analysis of Industrial Experiments.London:Longman Group Limited,1978.
