产油嗜碱绿球藻MC-1的烟气适应性
2013-06-30杨熙向文洲张峰吴华莲何慧范洁伟
杨熙,向文洲,张峰,吴华莲,何慧,范洁伟
1 中国科学院南海海洋研究所,广东广州 510301
2 中国科学院大学,北京 100049
因大量温室气体的排放而引发的全球变暖已经越来越受到全世界人民的关注,在各种温室气体中,CO2是导致温室效应的最主要因素[1],减排已成为目前国内的重点工作之一。由于化石能源的不可再生性及其储量日益减少,人们普遍意识到必须寻找新能源以便实现经济和环境的可持续发展,并把目光投向了微藻[2]。微藻具有诸多其他材料无可比拟的优势,已成为生产清洁生物能源的首选材料,微藻产油的相关技术也已基本成熟[3],但目前还没能实现商业化生产,其主要问题是成本过高以及缺乏合适藻种[4-5]。据Grima 等[6]报道,微藻在培养过程中碳源的供应占总生产成本的41%之多。而发电厂所排放的煤炭烟气中含有大量的CO2气体,如果利用烟气培养微藻进行产油,则生产所需的碳源成本可忽略不计,又能达到减排的目的[7]。本实验室发现一株极具潜力的产油减排藻种——嗜碱绿球藻Chlorococcum alkaliphilus MC-1,其不仅生长速度快,油脂含量较高,且具有pH 快速漂移和高碱适应特性[8-9]。该藻的这种特性使其易于进行室外大体积培养,培养过程中藻液的偏碱性有利于提高烟气中CO2等酸性气体的吸收利用效果。
截至目前,国内外关于利用烟气进行产油微藻室外大体积培养的报道还比较少见,已有的一些报道:如Maeda 等[10]利用工厂烟气在70 L 的循环光反应器中培养微藻 Chlorella sp.T-1;Matsumoto等[11]将火力发电厂排放的工业烟气直接通入2 m2开放式跑道池中培养微藻微拟球藻Nannochloropsis salina (NANNP2);以及Israel等[12]在1000 L 的开放式跑道池中,利用工厂排出的烟气培养隅江篱(红藻门) Gracilaria cornea(Rhodophyta)。上述研究中都只粗略地分析了培养过程中烟气对微藻生物量的影响,而关于烟气影响微藻生物量的原因、烟气对微藻油脂含量的影响以及培养过程中烟气各成分的吸收利用情况等没有进行深入的研究。
本项研究通过利用煤炉燃烧煤炭产生的烟气分别于室外15 L 光生物反应器和24 m2开放式跑道池中培养嗜碱绿球藻 Chlorococcum alkaliphilus MC-1,研究了烟气对该藻的生长、藻体总脂含量和有毒重金属含量的影响,此外还测定了藻液中无机N 和无机S 的浓度变化,并分析了藻液对烟气中CO2、NO 和SO2的吸收效果,以评估该藻对烟气的适应性,为实现微藻产油与烟气减排的耦合培养和商业化生产提供参考依据。
1 材料与方法
1.1 藻种和培养基
本研究采用一株嗜碱绿球藻Chlorococcum alkaliphilus MC-1(暂定名,简称MC-1)作为实验藻种,该藻种由中国科学院南海海洋研究所微藻项目组于2002年在室外蓝藻培养箱中分离并经过固体纯化培养后获得[13]。
实验中所用培养基配方在原ZSNT 培养基[13]的基础上加以调整,调整后的配方为:每升蒸馏水中分别加入NaHCO30.5 g,KCl 0.1 g,NaNO30.4 g,NaH2PO4·2H2O 0.03 g,MgSO4·7H2O 0.05 g,CaCl20.02 g,M2、A5和B6各1 mL。M2溶液:每升蒸馏水添加FeCl3·6H2O 0.244 g 和Na2·EDTA 0.189 g。A5溶液:每升蒸馏水添加H3BO32.86 g,MnCl·4H2O 1.81 g , ZnSO4·7H2O 0.22 g ,CuSO4·5H2O 0.08 g,Na2MoO40.021 g 和浓H2SO41滴。B6溶液:每升蒸馏水添加NH4VO322.96 mg,K2CrO419.9 mg,NiSO4·6H2O 47.85 mg,NaWO4·2H2O 17.914 mg,Ti(SO4)340 mg 和Co(NO3)2·6H2O 43.98 mg。
1.2 气体来源及补气方法
烟气:实验中所使用的烟气由煤炉燃烧煤炭产生,煤炭为市场上采购的蜂窝煤。初始烟气先经过冷却过滤设备进行前处理,使温度降至25℃左右,处理后的烟气直接通入藻液中进行微藻培养。经测定烟气的主要成分及浓度分别为:
(14.72±0.02)% CO2、(4.20±0.02)% O2、(28.74±1.03) mg/m3NO、(343.78±17.22) mg/m3SO2。CO2
气体:实验中以纯度为99.99%的食品级CO2气缸作为CO2气源,液态CO2经减压气化后再导入藻液中培养微藻。
补气方法:鉴于该藻的最适生长pH 为9.00,而且该藻以NaHCO3为初始碳源进行光照培养时会产生明显的pH 漂移现象,即藻液pH 会在短时间内快速上升,本实验采用间歇性补气的方法,以藻液pH 值作为供气与否的指标,当pH值升至9.50时,开始供气降pH,当pH 降到9.00时停止供气,如此反复,此补气过程均采用人工控制。
1.3 光生物反应器培养条件
实验中使用圆柱形气升式光生物反应器,透明玻璃材质,内径为24 cm,高为33 cm,总容积为15 L,底部装有曝气装置,气体从底部导入,并带动藻液循环流动。实验分3组进行,空白组:不补充任何气体下培养;CO2组:通纯CO2气体进行培养;烟气组:通煤炭烟气进行培养。每组设3个平行样。实验于室外进行,反应器放置于盛水的玻璃水箱中,以此来控制藻液温度在30℃附近。每个反应器中藻液的初始OD700都为0.321,培养体积为14 L,自然光照,通气速率为250 mL/min,夜间停止补气,于每天18:00补充蒸发水。
1.4 开放式跑道池培养条件
跑道池的规格为:3.0 m (宽)×8.0 m (长),培养前藻池经消毒灭菌处理。实验于室外进行,选择天气晴朗,温度和光照强度相似的日期在池中先后进行纯CO2培养和烟气培养实验。藻液初始OD700均为0.425,培养深度为22 cm,自然光照,培养温度为30℃左右,通过曝气石向池底曝气,通气速率为2 L/min。每天早上6点开搅拌机,下午18:00关搅拌机,叶轮搅拌转速为13 r/min,藻液流速为0.3 m/s。夜间停止补气,于每天18:00补充蒸发水。
对培养末期采收的藻粉进行有毒重金属Pb、As、Cd 和Cr 含量的测定,由中山大学分析测试中心协助完成。依据JY/T 015-1996,采用全谱直读等离子体原子发射光谱仪(Icap6500Duo,美国)进行含量的检测,检测条件为:入射功率1150 W,等离子气流量14 L/min,雾化气流量0.6 L/min。Cd 的参照标准为保健(功能)食品通用标准(GB/2762-2005),As、Pb 和Cr 的参照标准为食品中污染物限量标准(GB/16740-1997)。
1.5 藻液pH、DIC (溶解无机碳)浓度以及微藻生长参数的测定
利用FiveGo 基础型便携式pH 计-FG2-FK(METTLER TOLEDO,美国)直接测定藻液pH,每天08:00、11:00、15:00和18:00分别进行测定,然后取平均作为当天藻液的pH 值;藻液中DIC浓度的测定参考Stumm 等[14]的方法;采用干重法[15]测定藻的生物量浓度(g/L),其方法是取15 mL 的藻液,利用0.22μm 的微孔滤膜过滤并用去离子水清洗2次,于110℃下烘干至恒重。
生长速率采用以下计算公式:
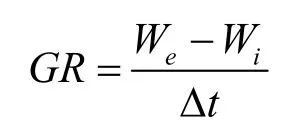
式中GR 为藻的生长速率(g/(L·d));We和Wi分别为培养末和培养初的生物量浓度(g/L);△t 为培养开始到结束所用的时间(d)。
CO2固定速率的计算参考Choi 等[16]的方法,计算公式如下:

式中FCO2为CO2固定速率(g/(L·d));GR 为藻的生长速率(g/(L·d));fC为藻细胞中有机碳含量(%,占干重比),经测定为44.43%(由中山大学分析测试中心协助完成);MCO2和MC分别为CO2和C 的相对分子质量。
1.6 藻体总脂含量的测定
依据Takagi 等[17]的方法并加以改进,通过离心收集藻泥,经过冷冻干燥后于−20℃保存。称取30 mg 左右的干藻粉放入碾钵中,加入少量石英砂,液氮冷冻后将碾钵放入冰块中进行碾磨,镜检至细胞完全破碎,将破碎后的藻液转移至10 mL 的离心管中,加入3 mL 氯仿∶甲醇(2∶1)溶液预处理样品2 h,再将样品转入70℃水浴锅中水浴15 min 至沉淀呈白色,冷却至室温后于4℃、3000 r/min 下离心10 min,取上层提取液,再在沉淀中加入1 mL 氯仿∶甲醇(2∶1)溶液水浴重新提取一次,将两次提取液合并,在提取液中加入1 mL 0.9%的KCl 溶液摇匀后于4℃、3000 r/min 下离心10 min,将底层溶液转入棕色吹瓶中,于高纯氮气下吹干,将吹瓶放入烘箱中烘干称重,每个样品重复3次,总脂含量计算公式如下:
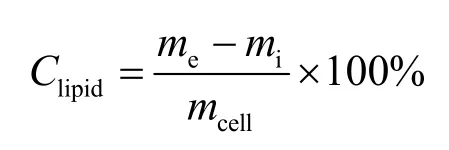
式中Clipid为藻体总脂含量(%);me和mi分别为末了和初始时吹瓶的重量(g);mcell为所测藻粉干重(g)。
1.7 藻液中NO3−、NO2−和SO42−浓度的测定
取15 mL 藻液,于4℃、5000 r/min 离心10 min,取上层清液,用去离子水稀释40倍,然后用离子色谱仪(WYIC6000,中国)进行测定,阴离子色谱柱型号:WY-Anion-4,进样体积100μL,流动相:1.8 mmol/L Na2CO3+1.7 mmol/L NaHCO3溶液,流速1.5 mL/min,温控箱温度35℃,电导池温度40℃。
培养始末,各培养体系单位体积中N 元素和S 元素总含量变化的计算公式如下:

式中△ρ为N 或S 总含量的变化(g/L);△W 为培养末与培养初藻细胞生物量浓度之差(g/L);f 为藻细胞中有机N 或S 的含量(%,占干重比),经测定分别为6.92%和0.48%(由中山大学分析测试中心协助完成);△C 为培养末与培养初藻液中无机N (包括NO2−和NO3−)浓度之差或无机S 浓度之差(mol/L);M 为N 或S 的相对分子质量。
1.8 藻液对烟气中CO2、NO 和SO2的吸收率的测定
采用烟气分析仪(testo 350,德国)对烟气中各气体成分浓度进行检测。光生物反应器培养的检测方法为:对通气过程中反应器进口处和出口处CO2、NO 和SO2的浓度以及气体流速进行检测,检测时的通气速率控制为250 mL/min;开放式跑道池培养的检测方法为:利用本实验室自制的一种检测装置,该装置为立方形,顶端有一个进气口和一个出气口,底部敞开,底部朝下扣置于藻池中,气体从进气口导入藻液中,经藻液吸收后从出气口排出,同样通过检测其进气口和出气口处CO2、NO 和SO2的浓度以及气体流速来计算吸收率,检测时的通气速率控制为2 L/min。吸收率的计算公式[15]如下:

式中 Rgas为藻液对气体的吸收率(%);gasinlet和gasoutlet分别指进口处和出口处各气体成分的浓度(%或mg/m3);qinlet和qoutlet分别指进口处和出口处的气体流量(L/min)。
1.9 统计分析
2 结果
2.1 光生物反应器培养实验
2.1.1 各培养体系中MC-1的生长状况和总脂含量
采用15 L 光生物反应器对微藻MC-1进行了7 d 的培养,测定了各培养体系中藻的生物量浓度、藻液pH 和DIC 浓度的变化。从图1A 可以看出,烟气组的生长速率明显要快于空白组和CO2组,在培养第7天空白组、CO2组和烟气组的生物量浓度分别为:(0.45±0.01) g/L、(0.75±0.04) g/L 和(1.02±0.07) g/L (起始生物量浓度均为0.15 g/L);各培养体系的生长参数见表1,烟气组的生长速率和CO2固定速率分别为(0.12±0.02) g/(L·d)和(0.20±0.02) g/(L·d),均比CO2组提高了33.33%。图1B 显示,空白组出现了明显的pH 漂移现象,在培养第2天pH 就由初始的9.00上升到了11.12,最高达到了11.70;而CO2组和烟气组中pH 始终维持在藻的最适生长pH 9.00附近。空白组由于没有碳源的补充,DIC 浓度呈明显的下降趋势,从起始的10.57 mmol/L 下降到第5天的(4.16±0.15) mmol/L,此时藻的生长也趋于停止;烟气组中DIC 浓度与CO2组呈现相似的变化趋势,由起始的10.57 mmol/L 上升到第6天的(14.72±0.18) mmol/L,并在此后维持在这一浓度附近(图1C),在这一过程中烟气组始终保持较快的生长速率。
培养末各培养体系中藻体总脂含量见表1,结果表明,与空白组相比,CO2组和烟气组中藻体的总脂含量都有所增加,烟气组的总脂含量达到了(37.84±0.58)%,增幅最大,比CO2组和空白组分别提高了15.34%和23.20%。以上结果显示,烟气组中微藻的生长和油脂积累状况都要优于CO2组。
2.1.2 各培养体系中无机N 和无机S 浓度的变化
通过对各培养体系NO2−、NO3−、SO42−浓度的检测发现,各体系中无机N 和无机S 的浓度都呈现明显的下降趋势,这种现象的出现主要是由藻的快速生长对体系中NO2−、NO3−、SO42−的大量消耗所导致,其中烟气组的下降速度最快,CO2组其次,空白组最慢,烟气组中无机N 在培养的第6天几乎已被消耗殆尽(图2);通过计算培养前后各培养体系单位体积内N元素和S元素总含量的变化发现,只有烟气组中N 和S 的总含量呈正增长,空白组和CO2组都呈负增长(表1),对于这一现象可能是由于在测定藻细胞中有机N和S 含量时,细胞内还储存有一定量的无机N 和S,而这一部分无机N 和S 没有被算入培养末N和S 的总含量中所导致。上述结果说明烟气对藻液中氮源和硫源起到了一定的补充作用。
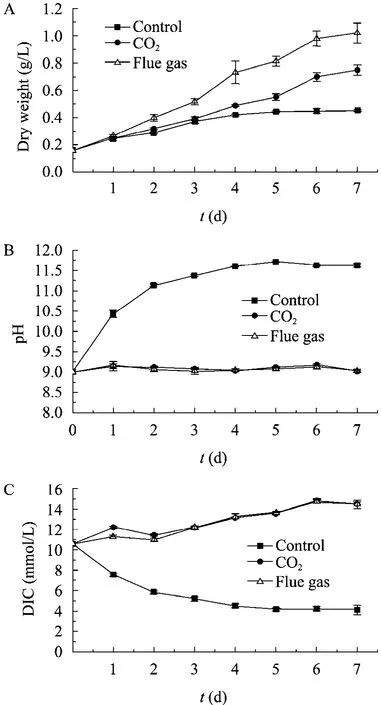
图1 光反应器培养实验中各培养体系的生物量浓度、pH 和DIC 浓度变化曲线Fig.1 Time course of biomass concentration,pH and DIC concentration of each experimental group in the photobioreactor test.

表1 光反应器培养实验中各培养体系藻的生长参数Table 1 Growth parameters of each experimental group in the photobioreactor test

图2 光反应器培养实验中各培养体系藻液无机N 和无机S 的浓度变化曲线Fig.2 Time course of inorganic N and S concentration of each experimental group in the photobioreacter test.
2.2 开放式跑道池培养实验
在室外24 m2开放式跑道池中先后进行了烟气和纯CO2培养实验,培养时间均为7 d。图3A显示,从生物量浓度的变化趋势来看,烟气和纯CO2具有相似的培养效果,在培养末,烟气和纯CO2培养下藻的最高生物量浓度分别为147.40 g/m2和140.80 g/m2;烟气能使藻液pH 维持在该藻最适生长pH 9.0附近(图3B);烟气培养中藻液的DIC 浓度呈现与纯CO2培养相似的变化趋势,由起始的10 mmol/L 上升到第2天的12.52 mmol/L,此后一直在该浓度附近波动(图3C);从各项生长参数来看,跑道池中烟气培养和纯CO2培养的差异不明显,烟气培养下藻生长速率、CO2固定速率和藻体总脂含量分别为14.73 g/(m2·d)、24.01 g/(m2·d)和35.72%(表2)。

图3 开放式跑道池中的生物量浓度、pH 和DIC 浓度变化曲线Fig.3 Time course of biomass concentration,pH and DIC concentration in the open raceway pond.
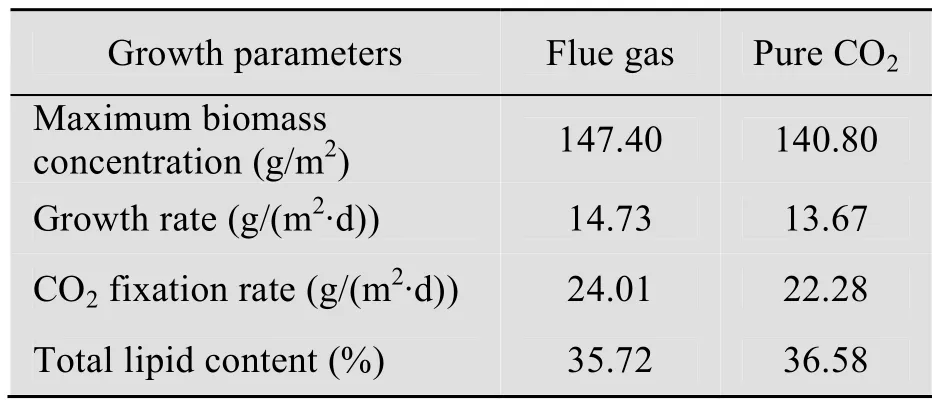
表2 开放式跑道池中微藻MC-1的生长参数Table 2 Growth parameters of MC-1 cultivated in the open raceway pond

表3 开放式跑道池培养产出的藻粉中有毒重金属(Pb、As、Cd 和Cr)的含量Table 3 Concentrations of toxic heavy metals (Pb,As,Cd and Cr) in the biomass of MC-1 cultivated on flue gas and pure CO2 in the open raceway pond
对开放式跑道池培养产出的干藻粉进行了有毒重金属Pb、As、Cd 和Cr 的含量检测,结果见表3,烟气和纯CO2培养下藻体中有毒重金属Pb、As 和Cd 的含量都远低于国家限量标准,就是含量相对较高的Cr 也没有超出国家限量标准。以上结果表明,微藻MC-1能适应室外烟气放大培养,且培养出的藻粉中没有出现有毒重金属含量过高的现象。
2.3 藻液对烟气中CO2、NO 和SO2的吸收效果
在通烟气培养时,当藻液pH 从9.5下降到9.0的过程中,测定了不同时间点藻液对烟气中CO2、NO 和SO2的吸收率,然后取平均值获得光生物反应器和开放式跑道池培养过程中藻液对烟气中CO2、NO 和SO2的平均吸收率。在光生物反应器中CO2、NO 和SO2的平均吸收率分别为:(67.78±3.60)%、(78.90±4.70)%和(70.61±3.84)%;开放式跑道池中CO2、NO 和SO2的平均吸收率分别为:(86.28±1.15)%、(78.65±6.18)%和(84.93±4.29)%(图4)。以上结果表明,培养过程中藻液对烟气中CO2、NO 和SO2具有较好的吸收效果。

图4 光生物反应器和开放式跑道池中藻液对烟气中CO2、NO 和SO2的平均吸收率Fig.4 The average absorption ratios of CO2,NO and SO2 by the culture solution in the photobioreactor and open raceway pond.
3 讨论
3.1 烟气培养下微藻MC-1的生长情况和总脂含量
本实验中烟气组微藻MC-1的生长不仅没有受到抑制,反而优于CO2组,在光生物反应器培养实验中烟气组的生长速率为(0.12±0.01) g/(L·d),比CO2组提高了33.33%;开放式跑道池培养实验证明了微藻MC-1能适应室外烟气放大培养。Douskova 等[18]利用城市垃圾焚烧炉中产生的烟气培养微藻Chlorella vulgaris 时,发现与对照组相比,烟气使该藻的生长速率提高了48%;Matsumoto 等[11]在2 m2的开放式跑道池中利用烟气培养微藻Nannochloropsis salina,实验发现烟气培养下该藻的生长曲线和CO2培养相似,生长速率为8 g/(m2·d),而在本实验中烟气培养池的生长速率为14.73 g/(m2·d),比其提高了1.84倍。经分析,本实验中出现此现象的原因主要有以下几点:1)由于烟气组与CO2组使用的气体中CO2浓度不同,烟气组中CO2浓度低,CO2组中CO2浓度高,虽然藻液最终都被调至相同的pH 值,但此过程中烟气组所通气体总流量要大于CO2组,这使得烟气组的藻液混合要优于CO2组,而混合效果越好对藻的生长是越有利的;2)烟气中所含NOX和SOX等气体对藻液中氮源和硫源起到了一定的补充作用。由于烟气中所含NOX和SOX被藻液吸收后会以NO2−、NO3−和SO42−等形式存在[19],而NO2−、NO3−和SO42−可被微藻作为营养元素加以吸收利用[20]。本实验也证实了烟气对藻液中氮源和硫源起到了补充作用,由于补充量相比于藻细胞生长对氮源和硫源的消耗量来说太小,因此在图2中无机N 和S浓度都呈总体下降趋势,没有体现出这一补充效果;3)由于烟气中含的一些微量元素,有可能其中有些微量元素是藻体中一些酶的重要激活因子[21],从而对微藻的生长起到了激活作用。
在光生物反应器培养中,烟气组藻体的总脂含量为(37.84±0.58)%,比CO2组提高了15.34%;开放式跑道池中烟气培养下藻体的总脂含量也达到了35.72%。Yoo 等[22]通过利用燃烧液化汽油产生的CO2浓度为5.5%的烟气培养微藻栅藻Scenedesmus sp.和布朗葡萄藻 Botryococcus braunii,研究发现,在烟气培养条件下这两种藻的总脂含量分别为18%和24%,比10% CO2培养下分别提高了1倍和14.29%。烟气促进微藻油脂积累的具体原因目前还不清楚,可能烟气在促进微藻生长的同时也加快了其对培养液中氮、磷等营养元素的消耗,使藻细胞较早进入了营养元素缺乏阶段,而氮、磷的缺乏会促使藻体从快速生长阶段转入油脂的积累阶段[23]。
烟气培养下微藻MC-1表现出较好的生长效果以及总脂含量有所升高的现象均说明了该藻对烟气有较好的适应性。
3.2 烟气培养产出藻粉的安全性分析
由于烟气中还含有一些重金属元素,如Cd、Pb、Hg、As、Cr、Co、Cu 等,且这些重金属会以氧化物或氯化物的形式存在于烟气中的微小颗粒中,而微藻对重金属有很强的吸收和吸附能力,很容易在藻体内发生重金属富集效应[19]。本实验通过测定在烟气培养下开放式跑道池产出的藻粉中有毒重金属Pb、As、Cd 和Cr 的含量,以此来判断其作为食品、饵料以及其他产品的安全性。结果发现藻体中这些指标的含量均低于国家限量标准。出现这种结果的原因有以下几种可能:1)由于烟气在通入藻液之前进行了冷却过滤处理,可能对其起到了净化作用,有效地降低了烟气中这些重金属的含量,从而没有出现藻体内重金属的富集现象;2)由于培养时间不够长,这些重金属在藻体中的富集现象还不明显。如果延长烟气培养时间,是否会出现藻体有毒重金属含量升高的现象还有待进一步研究。
3.3 藻液对烟气中各气体成分的吸收效果
烟气培养过程中藻液对烟气中CO2、NO 和SO2都有较高的吸收效果。此前关于利用烟气培养微藻的报道中,这三种气体的最高吸收率分别为:67%、68%和51%[15,24-25],均低于本研究。由于吸收率取决于气液接触的表面积和时间,以及藻液的酸碱性等,其中藻液的酸碱性是由藻的生理特性所决定的。因此,补气装置构造、补气时气泡大小以及藻的生理特性等都会影响气体的吸收效果。本实验中采用的是常规的补气方式(利用曝气石在光反应器和开放式跑道池底部补气),因此分析认为,出现较高的吸收率主要是由微藻MC-1独特的生理特性所决定的。该藻不仅具有嗜碱特性,且在培养过程中会使藻液产生明显的pH 漂移,即培养过程中随着藻细胞的生长,藻液表现出同步的pH 上升现象,从而使藻液呈碱性,根据酸碱平衡原理,CO2、NO 和SO2等酸性气体更容易被碱性溶液所吸收[26]。本实验采用间歇性通气方法很好地维持了这种平衡关系,使藻液既不会出现碱性过高现象,也不会由于大量酸性气体的通入而快速酸化,而是维持在该藻的最适生长pH 附近,既保证了烟气中各成分都具有较高的吸收效果,又能使该藻在最适pH 下快速生长。
3.4 微藻产油与烟气减排耦合培养的进一步优化及其商业化生产前景
虽然在24 m2开放式跑道池中烟气培养与纯CO2培养相比差异不明显,但其生长速率与此前研究相比有了较大幅度的提高。在室外大规模烟气培养中将会遇到培养条件难控制(如pH、温度、溶解氧等),天气以及敌害生物等因素的影响。因此我们认为在室外微藻产油与烟气减排的大规模培养中,需要进一步优化培养条件,包括培养系统、烟气补充系统等的优化。如何通过改善烟气补充装置,提高烟气中各成分的吸收利用率,从而更好地降低培养成本,有待进一步深入研究。
据统计,直到目前只有少数几家企业尝试过利用烟气进行微藻工业化生产,如以色列电力公司和Seambiotic 有限公司尝试过将烟气直接导入露天培养池中培养一种微绿球藻[27];在夏威夷,Cyanotech 公司利用自己研发的一种烟气发生系统来进行微藻节旋藻Arthropspira sp.的培养,并利用燃料燃烧产生的余热来干燥藻泥[28],而在我国关于利用烟气大规模培养微藻的研究则少有报道。本实验中所使用的嗜碱绿球藻MC-1是一株能适应烟气培养条件的产油藻种,由于其培养过程中藻液偏碱性,能对敌害生物起到有效的控制作用,易于室外大规模培养。如果采用具有与本研究中微藻MC-1相似生理特性的藻种,优化培养条件,进一步完善烟气补给系统,耦合微藻产油与烟气减排并实现商业化生产是可期的。
[1]Florides GA,Christodoulides P.Global warming and carbon dioxide through sciences.Environ Int,2009,35(2):390−401.
[2]Huang YM,Wang WL,Li YG,et al.Strategies for research and development and commercial production of microalgae bioenergy.Chin J Biotech,2010,26(7):907−913(in Chinese).黄英明,王伟良,李元广,等.微藻能源技术开发和产业化的发展思路与策略.生物工程学报,2010,26(7):907−913.
[3]Chisti Y.Biodiesel from microalgae.Biotechnol Adv,2007,25:294−306.
[4]Brian JG.The economics of producing biodiesel from algae.Renewable Energy,2011,36:158−162.
[5]Sun A,Davis R,Starbuck M,et al.Comparative cost analysis of algal oil production for biofuels.Energy,2011,36:5169−5179.
[6]Grima EM,Belarbi EH,Fernández FG,et al.Recovery of microalgal biomass and metabolites:processoptions and economics.Biotechnol Adv,2003,20:491−515.
[7]Zhang YX,Zhao BT,Xiong KB,et al.Progress in biofixation of CO2from combustion flue gas by microalgae.Chin J Biotech,2011,27(2):164−171(in Chinese).张一昕,赵兵涛,熊锴彬,等.微藻固定燃烧烟气中 CO2的研究进展.生物工程学报,2011,27(2):164−171.
[8]Zhang F,Xiang WZ,Xiao B,et al.CO2sequestration coupled with industrial cultivation of microalgae.Acta Microbiol Sin,2012,52(11):1378−1384(in Chinese).张峰,向文洲,肖邶,等.耦合二氧化碳减排的微藻产业化培养技术.微生物学报,2012,52(11):1378−1384.
[9]Xiang WZ,Wu HL,Xie K,et al.Extremophilic traits of Chlorococcum sp.and rapid induction of astaxanthin.J Tropical Oceanography,2007,26(1):50−54(in Chinese).向文洲,吴华莲,谢科,等.一种绿球藻的极端适应特性与虾青素高效诱导.热带海洋学报,2007,26(1):50−54.
[10]Maeda K,Owada M,Kimura N,et al.CO2fixation from the flue gas on coal-fired thermal power plant by microalgae.Energy Convers,1995,36(6−9):717−720.
[11]Matsumoto H,Hamasaki A,Sioji N.Influence of CO2,SO2and NO in flue gas on microalgae productivity.J Chem Eng Japan,1997,30(4):620−624.
[12]Israel A,Gavrieli J,Glazer A,et al.Utilization of flue gas from a power plant for tank cultivation of the red seaweed Gracilaria cornea.Aquaculture,2005,249:311−316.
[13]Xiang WZ,Xie K,Wu HL,et al.Microscopic structure of a green alga isolate.J Tropical Oceanography,2007,26(2):65−68(in Chinese).向文洲,谢科,吴华莲,等.一种绿藻分离物的显微研究.热带海洋学报,2007,26(2):65−68.
[14]Stumm W,Morgan JJ.Aquatic Chemistry.3nd ed.New York:John Wiley &Sons Press,1996:268−269.
[15]Li FF,Yang ZH,Zeng R,et al.Microalgae capture of CO2from actual flue gas discharged from a combustion chamber.Ind Eng Chem Res,2011,50:6496−6502.
[16]Choi W,Kim G,Lee K.Influence of the CO2absorbent monoethanolamine on growth and carbon fixation by the green alga Scenedesmus sp..Biores Technol,2012,120:295−299.
[17]Takagi M,Karseno,Yoshida T.Effect of salt concentration on intracellular accumulation of lipids and triacylglyceride in marine microalgae Dunaliella cells.J Biosci Bioeng,2006,101(3):223−226.
[18]Douskova I,Doucha J,Livansky K,et al.Simultaneous flue gas bioremediation and reduction of microalgal biomass production costs.Appl Microbiol Biotechnol,2009,82(1):179−185.
[19]Hende SVD,Vervaeren H,Boon N.Flue gas compounds and microalgae:(Bio-)chemical interactions leading to biotechnological opportunities.Biotechnol Adv,2012,30(6):1405−1424(in Chinese).
[20]Nagase H,Yoshihara K,Eguchi K,et al.Uptake pathway and continuous removal of nitric oxide from flue gas using microalgae.Biochem Eng J,2001,7(3):241−246.
[21]Becker EW.Microalgae:Biotechnology and Microbiology.Cambridge:Cambridge University Press,2008:293−294.
[22]Yoo C,Jun SY,Lee JY,et al.Selection of microalgae for lipid production under high levelscarbon dioxide.Biores Technol,2010,101:71−74.
[23]Chen Y,Qiu YJ,Zhang W,et al.Effect of nutrient elements on growth and lipid accumulation of Phaeodactylum tricornutum.Biomass Chem Eng,2011,45(5):1−6(in Chinese).陈昱,邱昱晶,张维,等.营养元素对三角褐指藻生长和脂类积累的影响.生物质化学工程,2011,45(5):1−6.
[24]Chiu SY,Kao CY,Huang TT,et al.Microalgal biomass production and on-site bioremediation of carbon dioxide,nitrogen oxide and sulfur dioxide from flue gas using Chlorella sp.cultures.Biores Technol,2011,102:9135−9142.
[25]Doucha J,Straka F,Lívansky K.Utilization of flue gas for cultivation of microalgae Chlorella sp.in a outdoor open thin-layer photobioreactor.J Appl Phycol,2005,17(5):403−412.
[26]Ju-No L,Jin-Suk L,Chul-Seung S,et al.Methods to enhance tolerances of Chlorella KR-1 to toxic compounds in flue gas.Appl Biochem Biotechnol,2000,84−86:329−342.
[27]Christenson L,Sims R.Production and harvesting of microalgae for wastewater treatment,biofuels,and bioproducts.Biotechnol Adv,2011,29(6):686−702.
[28]Jensen G.Integrated microalgae production and electricity cogeneration:US,5659977.1997-08-26.
