酵母菌利用糖蜜发酵产麦角甾醇的工艺条件优化
2013-06-30王绍杰郭雪娜何秀萍张博润
王绍杰,郭雪娜,何秀萍,张博润
1 中国科学院微生物研究所酵母菌分子遗传与育种实验室,北京 100101
2 中国科学院大学,北京 100049
麦角甾醇是真菌细胞各种膜结构的重要组成部分,它在确保膜结构的完整性、流动性、通透性、与膜结合酶的活性、细胞活力等方面具有重要的生理功能[1-3]。麦角甾醇还是一种具有重要经济价值的代谢产物,是合成维生素D2的前体和生产可的松、黄体酮、芸苔素内酯和抗癌药物等甾醇类药物的重要原料[4-5]。酵母菌发酵法是国内外麦角甾醇生产的主要方式。在众多的酵母菌中,以酿酒酵母Saccharomyces cerevisiae 麦角甾醇的含量最高,因而成为发酵法生产麦角甾醇的优选菌种[6]。
酵母菌麦角甾醇产量同时受到细胞生长速率和细胞麦角甾醇合成能力的影响,但野生型酵母菌细胞生长和麦角甾醇合成之间常表现出一种相互制约的关系[7-9]。利用传统的微生物育种技术,并结合代谢途径的定向优化,可以在一定程度上从菌种层面突破细胞生长和麦角甾醇合成之间的相互制约,提高麦角甾醇产量[9-11]。同时通过发酵条件的优化也可以适当协调细胞生长和麦角甾醇合成之间的制约关系,实现麦角甾醇产量的提高。以葡萄糖和酵母粉等为主要原料的发酵条件优化已有较多报道[8-10,12-13]。但通常情况下,发酵培养基约占发酵成本的50%,实现廉价、可再生原料的替代是新型发酵工业的发展趋势[14]。糖蜜作为制糖工业的副产物,富含蔗糖、葡萄糖和果糖等碳源,以及维生素和无机盐,是发酵工业中一种经济易得的原料[15-16]。在我们前期研究中,对甘蔗糖蜜为主要原料的酵母菌发酵法生产麦角甾醇发酵条件进行了初步分析[11]。
响应面分析法(Response surface methodology,RSM)作为解决多变量问题的一种统计方法,已应用于多种发酵过程和生物反应过程的优化[16-18]。本研究将以甘蔗糖蜜为主要原料,通过响应面分析获得优化培养基;在此基础上进行5 L 发酵罐的发酵实验及发酵条件的进一步优化,以期为以糖蜜为主要原料的酵母菌发酵法生产麦角甾醇工业化应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 发酵菌种
酿酒酵母 Saccharomyces cerevisiae YEH56(pHXA42)由本实验室构建和保存[11]。
1.1.2 实验试剂
甘蔗糖蜜(含糖量为48%,总氮4.6%,总磷0.6%,Mg2+0.02%,Cu2+0.03%, Zn2+0.008%,Fe2+0.06%,W/W)购自北京市海昌鑫霖有限公司;玉米浆购自北京保乐吉生物科技有限公司;麦角甾醇标准品购自Sigma 公司;其他试剂均为国产分析纯试剂。
1.1.3 培养基
酵母菌常规培养、保存及发酵用种子培养基YEPD 参照文献[11]。
初始发酵培养基:糖蜜83.3 g,磷酸1.68 g,尿素2.0 g,溶于蒸馏水中,用氢氧化钠调pH 至5.4,定容至1000 mL。
优化后的发酵培养基:糖蜜83.3 g,KH2PO41 g,K2HPO41.86 g,CuSO4.5H2O 17.5 mg,FeSO4.7H2O 13.9 mg,MgSO4.5H2O 12.3 mg,玉米浆10 mL,溶于蒸馏水中,调pH 至6.5,定容至1000 mL。
糖蜜流加补料发酵基础培养基是将糖蜜浓度降低到41.6 g/L,KH2PO41 g,其他组分和pH 与优化后的发酵培养基完全相同。
1.2 方法
1.2.1 摇瓶发酵培养
从保存的菌种斜面上挑一环菌,转接到50 mL YEPD 中,30℃、200 r/min 培养18 h;按10%(V/V)接种量将种子液转接到装45 mL发酵培养基的250 mL三角瓶中,30℃、200 r/min 培养36 h。
1.2.2 发酵罐发酵培养
从保存的菌种斜面上挑一环菌,转接到5 mL YEPD 液体培养基中,30℃、200 r/min 培养16 h,然后转接到200 mL YEPD 液体培养基中,30℃、200 r/min 培养18 h,按10%(V/V)接种量转接至装有2 L 发酵培养基的5 L 发酵罐(上海保兴生物工程设备有限公司)中进行发酵,温度为30℃,转速400 r/min,通气量4 L/min,pH 控制在6.50左右。
进行流加补料分批发酵时,发酵罐初始装液量为1.8 L 基础培养基。补料液为含糖量为300 g/L的糖蜜,在发酵开始后5 h 以10 mL/h 的速度流加,从10 h 开始流加速度增加到20 mL/h,直到发酵结束为止。发酵12 h 前发酵条件控制同上;发酵12~30 h,转速550 r/min,通气量6 L/min,发酵末期恢复到初期转速和通气量。
1.2.3 分析方法
细胞生物量的测定和麦角甾醇的提取参照文献[9]进行。细胞麦角甾醇含量测定参照文献[11]进行。麦角甾醇产量指每升发酵液收获的细胞所含的麦角甾醇的量(mg/L),转化率为每消耗1克糖蜜产生麦角甾醇的毫克数(mg/g),麦角甾醇产率指每小时每消耗1克糖蜜产生的麦角甾醇毫克数(mg/(g·h))。
2 结果与分析
2.1 影响麦角甾醇产量的显著因素的筛选
依据单因子实验结果及影响酵母菌生长代谢的一般因素,本研究选取糖蜜糖浓度(X1)、CuSO4(X2)、FeSO4(X3)、MgSO4(X4)、玉米浆(X5)、K2HPO4(X6)、KH2PO4(X7)、和pH (X8)为考察因素,并余留3个空白项以估计实验误差;每个因素设2个水平,以麦角甾醇产量(mg/L)为响应值,进行试验次数为N=12的Plackett-Burman 设计,具体试验设计及结果见表1,利用Design Expert 7.1.3软件对表1中试验数据进行分析,发现本试验获得的模型的“Prob (P)>F”为0.0024,说明本试验模型显著。该模型的决定系数和校正决定系数分别为0.9948和0.9811,说明相关性良好。其中影响酵母菌麦角甾醇产量的显著因素为CuSO4(P=0.0002)、K2HPO4(P=0.0301)和pH(P=0.0066),其他被考察因素影响不显著。
2.2 中心组合设计与响应面分析
依据 Plackett-Burman 试验结果和Box-Behnken 中心组合设计原理,对筛选出的显著影响麦角甾醇产量的 CuSO4(X1)、K2HPO4(X2)和初始pH(X3)三个关键因素进行中心组合设计,3因素取3水平共设计17组试验,每组试验重复3次。各因素水平及试验结果见表2。
利用Design-Expert 7.1.3软件对中心组合试验结果进行分析,得到以麦角甾醇产量为响应值(Y)的拟合二次多项式回归方程:Y=343.64+13.20X1-1.39X2+3.85X3+2.67X1X2-1.04X1X3+9.11X2X3-29.02X12-6.64X22-2.98X32。对回归方程进行分析,发现该模型极显著(P<0.0001),多元相关系数R2=0.9805,说明模型与实际情况拟合很好;在模型参数中,X1(CuSO4)对麦角甾醇产量的线性效应极显著(P<0.0001),X3(发酵起始pH)对麦角甾醇产量的线性效应显著(P=0.0316),而X2(K2HPO4)对麦角甾醇产量的线性效应不显著(P=0.3668)。

表1 Plackett-Burman 试验设计及结果Table 1 Experimental design of Plackett-Burman and corresponding results
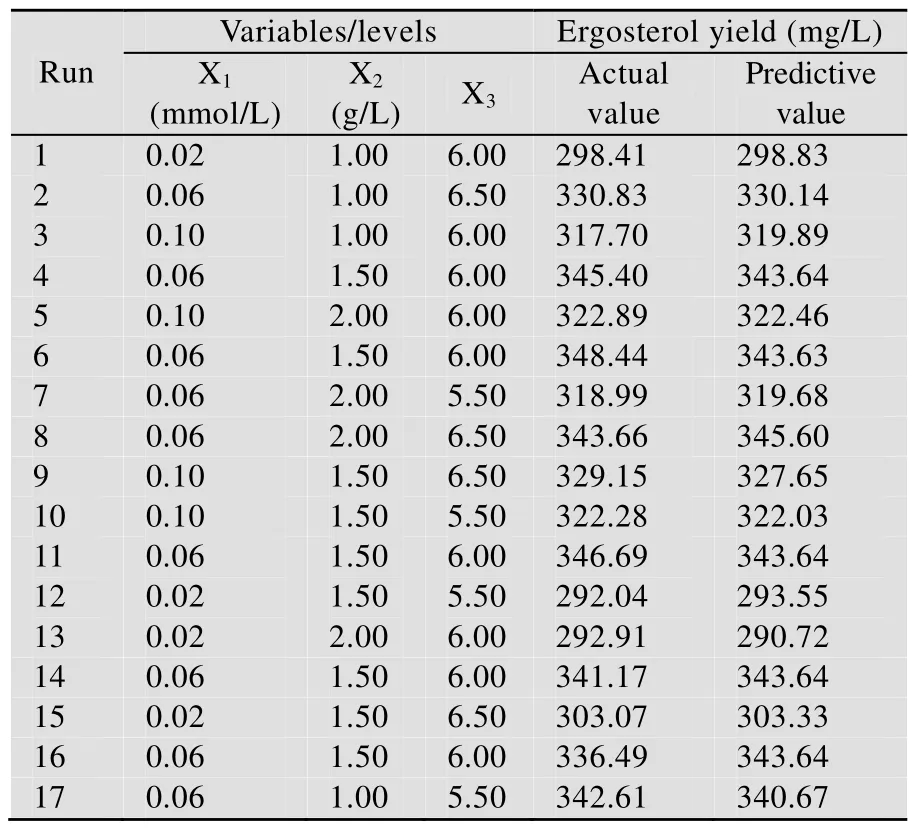
表2 中心组合试验设计及结果Table 2 Results of central composite design
对回归方程求解,得到各因素的最适水平,即硫酸铜0.07 mmol/L、磷酸氢二钾1.82 g/L 和pH为6.50,其他因素取Plackett-Burman 试验中的高水平,在此条件下利用模型预测麦角甾醇产量为348.40 mg/L。
2.3 优化结果验证
为了验证模型的准确性和有效性,在预测的最佳培养条件下进行发酵试验,试验重复3次,3次试验麦角甾醇产量平均值为371.56 mg/L,预测精确度达到93.8%,说明模型可靠。酵母菌麦角甾醇产量比优化前(286.89 mg/L)提高了29.5%。
2.4 发酵罐发酵试验
利用优化后的发酵培养基在5 L 发酵罐中进行分批发酵试验,比较了发酵过程pH 变化对麦角甾醇产量的影响,发现pH 控制在6.5左右,麦角甾醇产量达最高,发酵38 h,细胞生物量为13.33 g/L、细胞麦角甾醇含量为45.15 mg/g、麦角甾醇产量为601.85 mg/L(图1A)。与摇瓶试验相比,麦角甾醇产量和转化率均提高了62.1%。
在分批发酵试验基础上,进行了底物糖蜜流加补料发酵试验,发酵38 h,麦角甾醇产量为1953.85 mg/L,是分批发酵的3.2倍(图1B)。其中流加补料发酵试验中糖蜜到麦角甾醇的转化率为10.32 mg/g、麦角甾醇产率为0.28 mg/(g·h),均比分批发酵提高了42.7%。
3 结论

图1 酵母菌在5-L 发酵罐中批次发酵和底物流加发酵时间曲线Fig.1 Fermentation profiles of Saccharomyces cerevisiae in 5 L bioreactor.(A) Batch fermentation.(B) Fed-batch fermentation.
培养基组成是影响发酵成本和发酵效率的重要因素,利用廉价可再生的原料是发酵工业未来发展的重要趋势,本研究以制糖工业副产物-糖蜜为主原料,综合采用培养基配方优化、发酵过程pH 恒定控制及底物流加补料策略,不但使麦角甾醇产量比前期报道提高了14.5%,而且生产效率提高了20.5%[11]。与以葡萄糖为主要发酵原料的研究报道[13]相比,麦角甾醇产量提高了20.2%。本研究为酵母菌发酵糖蜜生产麦角甾醇的产业化应用提供了重要的参考依据。
[1]Dupont S,Lemetais G,Ferreira T,et al.Ergosterol biosynthesis:a fungal pathway for life on land?Evolution,2012,66(9):2961–2968.
[2]Krumpe K,Frumkin I,Herzig Y,et al.Ergosterol content specifies targeting of tail-anchored proteins to mitochondrial outer membranes.Mol Biol Cell,2012,23(20):3927–3935.
[3]Lees ND,Bard M,Kirsch DR.Biochemistry and molecular biology of sterol synthesis in Saccharomyces cerevisiae.Rev Biochem Mol Biol,1999,34(1):33–47.
[4]Subbiah MT,Abplanalp W.Ergosterol (major sterol of baker’s and brewer’s yeast extracts) inhibits the growth of human breast cancer cells in vitro and the potential role of its oxidation products.Int J Vitam Nutr Res,2003,73(1):19–23.
[5]Kalaras MD,Beelman RB,Holick MF,et al.Generation of potentially bioactive ergosterol-derived products following pulsed ultraviolet light exposure of mushrooms (Agaricus bisporus).Food Chem,2012,135(2):396–401.
[6]Veen M,Lang C.Production of lipid compounds in the yeast Saccharomyces cerevisiae.Appl Microbiol Biotechnol,2004,63(6):635–646.
[7]Arnezeder C,Hampel WA.Influence of growth rate on the accumulation of ergosterol in yeast cells.Biotechnol Lett,1990,12(4):277–282.
[8]Arnezeder C,Hampel WA.Influence of growth rate on the accumulation of ergosterol in yeast cells in a phosphate limited continous culture.Biotechnol Lett,1991,13(2):97–100.
[9]He XP,Huai WH,Tie CJ,et al.Breeding of high ergosterol-producing yeast strains.J Ind Microbiol Biotechnol,2000,25(1):39–44.
[10]He XP,Zhang BR,Tan HR.Overexpression of a sterol C-24(28)-reductase increases ergosterol production in Saccharomyces cerevisiae.Biotechnol Lett,2003,25(6):773–778.
[11]He XP,Guo XN,Liu N,et al.Ergosterol production from molasses by genetically modified Saccharomyces cerevisiae.Appl Microbiol Biotechnol,2007,75(1):55–60.
[12]Shang F,Wen S,Wang X,et al.High-cell-density fermentation for ergosterol production by Saccharomyces cerevisiae.J Biosci Bioeng,2006,101(1):38–41.
[13]Shang F,Wang Z,Tan TW.High-cell-density cultivation for co-production of ergosterol and reduced glutathione by Saccharomyces cerevisiae.Appl Microbiol Biotechnol,2008,77(6):1233–1240.
[14]Van Hoek P,Aristidou A,Hahn JJ,et al.Fermentation goes large scale.Chem Eng Prog,2003,99(1):37–42.
[15]Vedyashkina TA,Revin VV,Gogotov IN.Optimizing the conditions of dextran synthesis by the bacterium Leuconostoc mesemteroides grown in a molasses-containing medium.Appl Biochem Microbiol,2005,41(4):361–364.
[16]Banik RM,Santhiagu A,Upadhyay SN.Optimization of nutrients for gellan gum production by Sphingomonas paucimobilis ATCC-31461 in molasses based medium using response surface methodology.Bioresour Technol,2007,98(4):792–797.
[17]Montgomery DC.Design and Analysis of Experiments.5th Ed.New York:John Wiley and Sons,2001:451–463.
[18]Khan MA,Hamid R,Ahmad M,et al.Optimization of culture media for enhanced chitinase production from a novel strain of Stenotrophomonas maltophilia using response surface methodology.J Microbiol Biotechnol,2010,20(11):1597–1602.
