间充质干细胞在动脉粥样硬化治疗中的研究进展
2013-06-30刘佳佳张亦婷彭航刘鹏霞
刘佳佳,张亦婷,彭航,刘鹏霞
内蒙古大学生命科学学院国家动物转基因技术研究中心,内蒙古呼和浩特 010021
近30年来,有关动脉粥样硬化的研究虽取得了一系列的进展,但是动脉粥样硬化及其并发症仍然是人类死亡的主要原因,其发病机制尚不完全清楚。目前认为动脉内皮细胞功能发生障碍是动脉粥样硬化病变的第一步,许多心血管疾病发生的危险因素,如年老、吸烟、糖尿病、高血压、高血脂症等都会造成内皮细胞功能发生障碍[1-3]。血管壁内皮损伤如果不能及时修复,就会引发动脉粥样硬化炎症以及粥样斑块的产生,炎症反应在动脉粥样硬化的发生、发展及其并发症形成过程中起着重要作用[4]。此外,血管平滑肌细胞的异常改变在动脉粥样硬化的发生发展中也扮演着重要角色,大量研究显示动脉粥样硬化中增殖的平滑肌细胞是血管中膜平滑肌细胞受到各种病理刺激后发生表型改变、迁移进入内膜后聚集、增殖而来[5]。因此,探索有效措施促进有益的血管内皮细胞再生并抑制平滑肌细胞增生是血管损伤防治的关键。
越来越多的研究表明干细胞具有修复损伤组织的潜能,干细胞技术的发展为损伤血管修复提供了新方向[6]。间充质干细胞(Mesenchymal stem cells,MSCs)是一群中胚层来源的具有自我更新、多向分化潜能的干细胞[7]。MSCs 广泛存在于成体组织当中,易于分离培养,在体外容易培养得到治疗所需要的细胞数目;此外,MSCs还具有低免疫原性的特点及免疫调控能力,在相同种属之间移植不容易引起免疫排斥反应[8-9]。有研究表明,MSCs 可以分化为内皮细胞,加速受损内皮修复,抑制动脉狭窄的形成[10-11]。然而也有体内实验表明,血管内皮受损后,骨髓来源的MSCs 会归巢到受损血管局部,分化为血管平滑肌细胞并在局部增生,参与再狭窄或动脉粥样硬化的形成[12]。本文综述了体外输注MSCs 对动脉粥样硬化发生发展的影响的最新进展,希望为后续开展的间充质干细胞治疗动脉粥样硬化的研究提供一定参考。
1 MSCs 的来源及生物学特征
1966年,Friedenstein 等首次从成体组织中培养出了MSCs[13]。MSCs 是一群中胚层来源的具有自我更新、多向分化潜能的干细胞;广泛存在于多种成体器官和组织中,例如骨髓、脂肪、脐带、脐血、胎盘、羊水和胎儿组织等[14-20]。Abedin 等认为,MSCs 可能也存在于正常的动脉壁和微血管中[21]。
体外培养的MSCs 形态类似于成纤维母细胞,贴壁生长。MSCs 不具有特异的表面识别标志,表达间质系标志如CD90、CD73和CD105,表达一些在细胞结合和归巢中起重要作用的黏附分子如CD29、CD44、CD49、CD51和CD104,表达造血细胞表面分子的配体如CD54、CD106和CD102,还表达主要组织相容性复合体I (Major histocompatibility complex I,MHC-I),不表达CD34、CD45和主要组织相容性复合体II (Major histocompatibility complex II,MHC-II)[13-20]。
体外培养的MSCs 分泌多种细胞因子,例如基质细胞衍生因子l (Stroma-derived factor-1,SDF-l),肝细胞生长因子(Hepatocyte growth factor,HGF),胰岛素样生长因子l (Insulin-like growth factor-l,IGF-1),碱性成纤维细胞生长因子(Basic Fibroblast growth factor,bFGF),缺氧诱导因子 lα(Hypoxia inducible factor-1α,HIF-1α),血管内皮生长因子(Vascular endothelial growth factor,VEGF),血管生成素1(Angiopoietin-1,Ang-1),单核细胞趋化蛋白l(Monocyte chemoattractant protein-l,MCP-1),白细胞介素l (Interleukin-l,IL-1)和白细胞介素6(Interleukin-6,IL-6)等[9,13-20]。
MSCs 具有很强的多向分化潜能。在特定的培养条件诱导下,MSCs 不仅可以分化为中胚层来源的细胞如成骨细胞、软骨细胞、脂肪细胞等,还可以分化为内皮细胞、肝脏细胞、心肌细胞和神经细胞[7,10,13-20]。不同来源的MSCs 的分化潜能有差异,据报道,脂肪组织来源的MSCs 与骨髓组织来源的MSCs 分化为成骨细胞和软骨细胞的潜能不同,前者的分化潜能比后者低[19]。
MSCs 具有低免疫原性的特点及免疫调控能力。MSCs 不表达MHC-II,免疫原性较低,在相同种属之间移植不容易引起免疫排斥反应[9]。MSCs 可通过抑制多种免疫细胞的增殖来调节机体局部免疫能力。研究证实,MSCs 对T 淋巴细胞增殖有抑制作用[22]。同时,MSCs 还可以抑制树突状细胞的成熟和功能的发生,并抑制部分祖细胞分化为树突状细胞[23]。此外,MSCs 能够抑制自然杀伤细胞的增殖和B 淋巴细胞的终末分化[24-25]。由于MSCs 具备以上特点,越来越多的研究者将MSCs 用于细胞治疗的临床前研究。但是,近来有研究发现异体MSCs 移植所引发的免疫反应足以导致之后注射的异体MSCs 的存活数显著减少,显示在异体移植中还需考虑采取相应措施降低MSCs 的免疫原性[26]。
2 MSCs 用于动脉粥样硬化治疗的基础研究
有研究者发现,体外培养的MSCs 能够分化为内皮细胞[10,27-28];移植的MSCs 能够向血管损伤部位募集,并进一步分化为内皮细胞,修复损伤血管[11,29-33]。然而,也有研究显示,自体的MSCs 能够归巢到血管损伤部位,参与动脉粥样硬化斑块的形成[34];体外培养的MSCs 表达早期平滑肌细胞表面标志α平滑肌肌动蛋白(α-Smooth muscle actin,SMA),其细胞骨架也类似于平滑肌细胞,相对具备更多的平滑肌特性[35-36];在体外,MSCs 能够分化为平滑肌细胞[37-39];用氧化性低密度脂蛋白处理后,MSCs分化而来的平滑肌细胞能大量增殖并形成泡沫细胞,提示这类细胞可能参与脂质核心的形成,进而促进动脉粥样硬化的形成[39];体内实验显示输注的MSCs 可以分化为平滑肌细胞,在血管局部增生,参与血管再狭窄及动脉粥样硬化的发生[12,34,40-41]。本课题组也做了相关研究,我们通过高胆固醇高脂饲料喂养的方法建立了兔动脉粥样硬化模型,考虑到动脉粥样硬化是广泛分布于大、中弹力动脉的病变,我们采用静脉注射方式输注细胞;鉴于静脉注射最大的问题是机体器官对注射细胞的截留,因此在确定细胞输注量时,我们依照当时在美国clinicaltrials 数据库登记注册证明安全的MSCs 静脉输注治疗急性心肌梗塞的最大细胞数量进行了折算[42]。我们的研究发现在兔动脉粥样硬化模型中,一次性大剂量静脉注射MSCs 并不是合适的方案,大剂量MSCs注射促进了动脉外膜滋养血管的增生,进而加重了病变进展[40]。上述体内实验研究均未使用免疫抑制剂,具体实验内容见表1。
以上证据表明MSCs 在动脉粥样硬化的发生发展过程中扮演着双重角色。但是,目前还不清楚血管损伤后究竟是什么因素决定MSCs 发挥特定功能。
3 MSCs 发挥功能的相关机制
动脉粥样硬化病变复杂,机体环境、输注细胞量、输注次数和输注时间等都会影响MSCs 治疗的结果。目前的研究显示,MSCs 可以通过3种方式发挥治疗作用:第一,分泌可溶性因子,通过旁分泌作用促进损伤细胞功能的恢复;第二,归巢到损伤组织局部,分化为特定细胞类型,替代损伤细胞发挥功能;第三,通过调节免疫应答发挥作用[43]。
旁分泌作用是MSCs 发挥治疗作用的主要方式,因为大部分体外输注的MSCs 都截留于肺和组织毛细血管床,只有极少数的MSCs 能够归巢到损伤部位并存活[44]。而MSCs 能够合成和分泌多种生长因子、细胞因子和趋化因子,这些因子作用于不同的靶细胞发挥功能[45]。大鼠颈动脉切开术模型中发现,输注MSCs 后减轻了动脉狭窄程度,输注组损伤动脉处MCP-1和IL-1β mRNA表达下调,转化生长因子β(Transforming growth factor β,TGF-β) mRNA 表达上调[11]。大鼠静脉移植模型中发现,MSCs 输注组血管再狭窄率降低,输注组内皮型一氧化氮合酶(Endothelial nitric oxide synthase,eNOS)和诱导型一氧化氮合酶(Inducible endothelial nitric oxide synthase,iNOS)表达增多[29]。兔颈动脉粥样硬化狭窄血管成形术模型中也发现,MSCs 输注组血管再狭窄率降低,MSCs 移植后3、7、14、28 d 移植组血清VEGF 水平显著高于对照组[31]。猪动脉粥样硬化性肾动脉狭窄血管成形术模型中发现,MSCs输注后重建了肾血流动力学和肾功能、减少了炎症和细胞凋亡,输注组动脉中eNOS 和bFGF 表达上调[32]。小鼠股动脉导线损伤模型中发现,
MSCs 输注组内膜增厚显著,血管损伤后12 h 血液中SDF-1α、干细胞因子(Stem cell factor,SCF)、粒细胞集落刺激因子(Granulocyte colonystimulating factor,G-CSF)和VEGF 的表达量迅速增高[34]。从以上数据可以看出,MSCs 输注改变了损伤血管局部和血清中相关炎症因子的表达,可以推测不同的炎症因子表达会导致不同的治疗效果。因此,确定不同机体环境下MSCs 分泌的因子类型对明确MSCs 的特定治疗作用有重要意义。
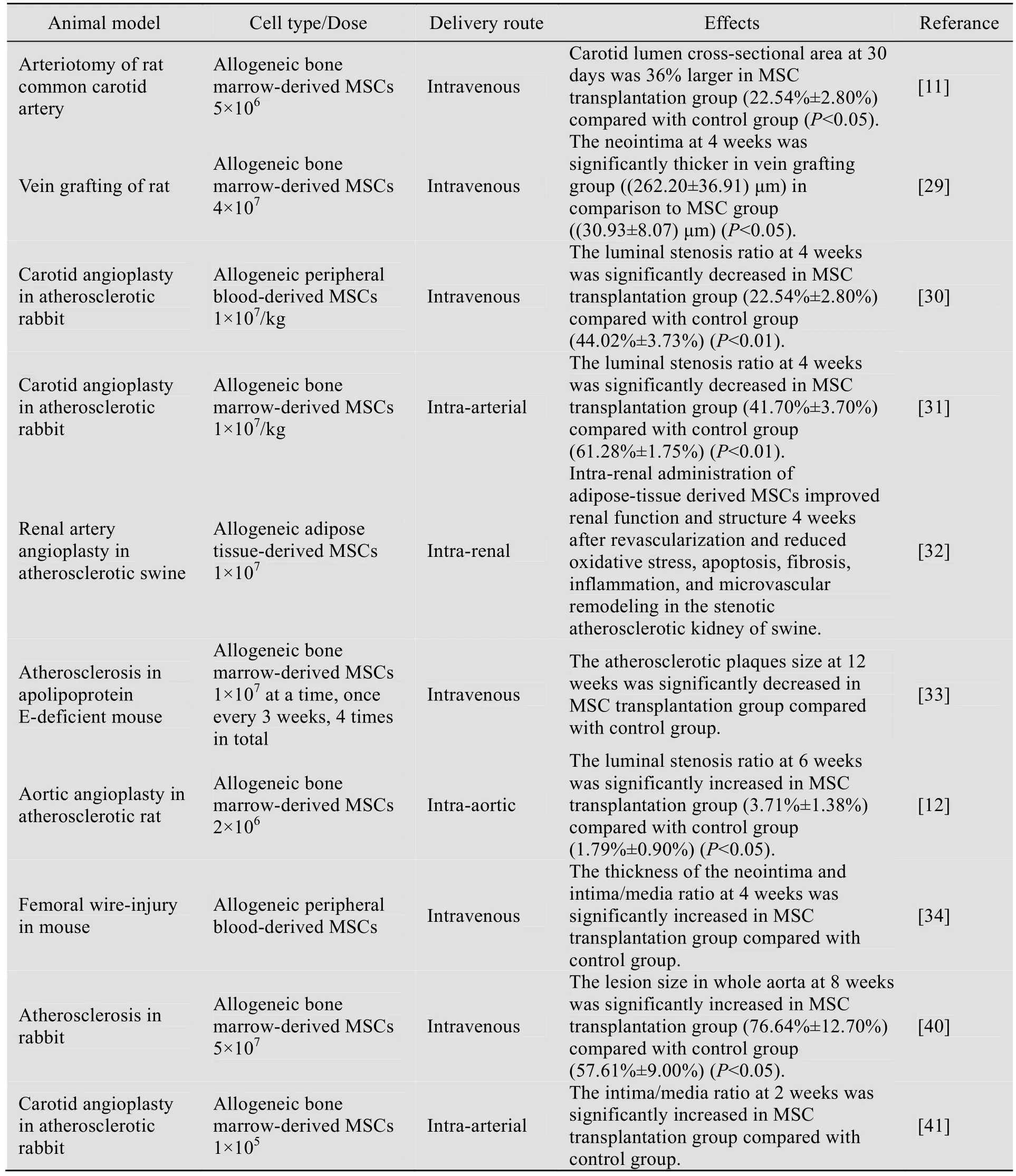
表1 MSCs 用于动脉粥样硬化治疗的基础研究Table 1 Fundamental researches of mesenchymal stem cell therapy for atherosclerosis
另外,在动脉粥样硬化模型中,体外输注的MSCs 能够分化为内皮细胞和平滑肌细胞发挥作用,但是MSCs 定向分化相关的信号还不太清楚。研究显示,MSCs 的分化方向与其所处的微环境有密切的关系,移植的MSCs 能在组织微环境中分化为与其周围细胞生物学特性相似的细胞[46]。骨髓MSCs 和大血管的内皮细胞共培养时,能够同时表达内皮细胞和平滑肌细胞的表面标志,而当骨髓MSCs 与微血管内皮细胞共培养时,只能表达内皮细胞的标志[47]。另有研究者对MSCs 的mRNA 表达进行了分析,结果发现MSCs 存在某些内皮细胞特异性基因及转录因子如Ta1-1/Scl,在特定微环境下内皮细胞特异性基因开放并表达相关蛋白质,使MSCs 向内皮细胞分化[48]。进一步实验证实,通过与晚期内皮前体细胞共培养,能够促使MSCs 向内皮细胞分化;在小鼠股动脉导线损伤模型中,同时输注晚期内皮前体细胞能够减少MSCs 输注引起的新生内膜增厚[34]。袁文丹等将大鼠骨髓来源的MSCs 与大鼠血管成纤维细胞共培养发现,与对照组相比,共培养的骨髓MSCs 高表达早期平滑肌细胞特异性蛋白SMA,显示血管成纤维细胞也会影响MSCs 的定向分化[49]。Goerke 等则发现内皮祖细胞能够通过激活细胞外信号调节激酶(Extracellular signal-regulated kinase,ERK)信号通路促进MSCs 向平滑肌细胞分化[50]。此外,微环境中存在的细胞因子也能够影响MSCs 的定向分化。有数据显示,在培养基中添加VEGF、bFGF 和促红细胞生成素均会诱导MSCs 向内皮细胞分化,促红细胞生成素的作用是通过促进MSCs 分泌VEGF 而实现的[10,27-28,51]。而在培养基中添加血小板衍生生长因子PDGF (Platelet-derived growth factor,PDGF)和TGF-β1则会诱导MSCs 分化为平滑肌细胞,PDGF 的作用是通过激活RhoA/Rho 激酶信号通路实现的[37-39,52]。由此可以看出,特定的微环境是决定MSCs 定向分化进而发挥作用的重要因素。
此外,如前所述,MSCs 具有免疫抑制与免疫调节作用。王治校等的研究发现在小鼠动脉粥样硬化模型中输注MSCs 后,小鼠外周血中调节性T 细胞增加,斑块面积明显减小,他们指出MSCs 输注对动脉粥样硬化的治疗作用可能与其免疫调节功能相关[33]。这方面的作用还需进一步的研究来证实。
4 问题及展望
目前,动脉粥样硬化及其相关并发症严重威胁着人类的生命。MSCs 是组织工程中应用很广泛的一类成体干细胞,越来越多的研究者开始探讨将MSCs 用于动脉粥样硬化治疗的可行性。已经报道的基础研究中通常采用输注法来治疗动脉粥样硬化,包括静脉输注和动脉管腔内注射;研究者们希望输注的MSCs 归巢到受损部位,分化为内皮细胞从而修复受损内膜,进而抑制血管病变进一步恶化。
然而,动脉粥样硬化病因复杂病程长,存在多种危险因素,且不同发病阶段病理变化及全身改变差异较大。动物模型模拟的发病阶段稍有差异就会导致细胞治疗效果迥异,这可能也是导致目前实验结论不统一的原因之一。鉴于动脉粥样硬化病变的复杂性,MSCs 用于动脉粥样硬化治疗还需谨慎。在将MSCs 用于动脉粥样硬化治疗之前,以下问题尚待解决:1)目前还不清楚特定动脉粥样硬化机体条件下,MSCs 分泌的可溶性因子有哪些,而旁分泌作用是MSCs 发挥治疗作用的主要方式之一。2)还未阐明MSCs 的分化机制,诱导分化的信号通路还不清楚。3)动脉粥样硬化各阶段病理改变不同,在不同时间点输注MSCs 作用也不同,应制定适用于细胞治疗的机体条件评分。4) MSCs 用于动脉粥样硬化的最佳输注方式和输注量还不确定,有待进一步优化。
[1]Celermajer DS,Adams MR,Clarkson P,et al.Passive smoking and impaired endotheliumdependent arterial dilatation in healthy young adults.N Engl J Med,1996,334(3):150-154.
[2]Cardillo C,Campia U,Kilcoyne CM,et al.Improved endothelium-dependent vasodilation after blockade of endothelin receptors in patients with essential hypertension.Circulation,2002,105(4):452-456.
[3]Casino PR,Kilcoyne CM,Quyyumi AA,et al.Impaired endothelium-dependent vascular relaxation in patients with hypercholesterolemia extends beyond the muscarinic receptor.Am J Cardiol,1995,75(1):40-44.
[4]Ross R.Atherosclerosis:an inflammatory disease.N Engl J Med,1999,340(2):115-126.
[5]Ross R.The pathogenesis of atherosclerosis:a perspective for the 1990s.Nature,1993,362(6423):801-809.
[6]Salem HK,Thiemermann C.Mesenchymal stromal cells:current understanding and clinical status.Stem Cells,2010,28(3):585-596.
[7]Pittenger MF,Mackay AM,Beck SC,et al.Multilineage potential of adult human mesenchymal stem cells.Science,1999,284(5411):143-147.
[8]Reyes M,Lund T,Lenvik T,et al.Purification and ex vivo expansion of postnatal human marrow mesodermal progenitor cells.Blood,2001,98(9):2615-2625.
[9]Nauta AJ,Fibbe WE.Immunomodulatory properties of mesenehynlal stromal cells.Blood,2007,110(10):3499-3506.
[10]Oswald J,Boxberger S,Jorgensen B,et al.Mesenchymal stem cell can be differentiated into endothelial cells in vitro.Stem Cells,2004,22(3):377-384.
[11]Forte A,Finicelli M,Mattia M,et al.Mesenchymal stem cells effectively reduce surgically induced stenosis in rat carotids.J Cell Physiol,2008,217(3):789-799.
[12]Chen XC,Shan HW,Qu HL.Bone marrow mesenchymal stem cell transplantation aggravates postangioplasty aortic restenosis in rats.Chin J Cardiol,2007,35(9):802-806(in Chinese).陈晓春,单鸿伟,瞿海龙,等.骨髓间充质干细胞移植加重大鼠主动脉血管成形术后再狭窄程度.中华心血管病杂志,2007,35(9):802-806.
[13]Friedenstein AJ,Piatetzky-Shapiro II,Petrakova KV.Osteogenesis in transplants of bone marrow cells.J Embryol Exp Morphol,1966,16(3):381-390.
[14]Erices A,Conget P,Minguell JJ.Mesenchymal progenitor cells in human umbilical cord blood.Br J Haematol,2000,109(1):235-242.
[15]Campagnoli C,Roberts IA,Kumar S,et al.Identification of mesenchymal stem/progenitor cells in human first-trimester fetal blood,liver,and bone marrow.Blood,2001,98(8):2396-2402.
[16]De Ugarte DA,Morizono K,Elbarbary A,et al.Comparison of multi-lineage cells from human adipose tissue and bone marrow.Cells Tissues Organs,2003,174(3):101-109.
[17]Wang HS,Hung SC,Peng ST,et al.Mesenchymal stem cells in the Wharton’s jelly of the human umbilical cord.Stem Cells,2004,22(7):1330-1337.
[18]In ’t Anker PS,Scherjon SA,Kleijburgvan der Keur C,et al.Isolation of mesenchymal stem cells of fetal or maternal origin from human placenta.Stem Cells,2004,22(7):1338-1345.
[19]Im GI,Shin YW,Lee KB.Do adipose tissue-derived mesenchymal stem cells have the same osteogenic and chondrogenic potential as bone marrow-derived cells? Osteoarthritis Cartilage,2005,13(10):845-853.
[20]Liu M,Han ZC.Mesenchymal stem cells:biology and clinical potential in type 1 diabetes therapy.J Cell Mol Med,2008,12(4):1155-1168.
[21]Abedin M,Tintut Y,Demer LL.Mesenchymal stem cells and the artery wall.Circ Res,2004,95(7):671-676.
[22]Nicola MD,Carlo-Stella C,Magni M,et al.Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli.Blood,2002,99(10):3838-3843.
[23]Djouad F,Charbonnier LM,Bouffi C,et al.Mesenchymal stem cells inhibit the differentiation of dendritic cells through an interleukin-6-dependent mechanism.Stem Cells,2007,25(8):2025-2032.
[24]Spaggiari GM,Capobianco A,Abdelrazik H,et al.Mesenchymal stem cells inhibit natural killer cell proliferation,cytotoxicity and cytokine production:role of indoleamine 2,3-dioxygenase and prostaglandin E2.Blood,2008,111(3):1327-1333.
[25]Asari S,Itakura S,Ferreri K,et al.Mesenchymal stem cells suppress B cell terminal differentiation.Exp Hematol,2009,37(5):604-615.
[26]Schu S,Nosov M,O'Flynn L,et al.Immunogenicity of allogeneic mesenchymal stem cells.J Cell Mol Med,2012,16(9):2094-2103.
[27]Shi TX,Zhang MG,Ji MF,et al.Influence of erythropoietin on the induction and differentiation of human bone marrow mesenchymal stem cells into endothelial cells.Chin J Vasc Surg,2010,2(2):112-116(in Chinese).师天雄,张明光,季明芳,等.促红细胞生成素对人骨髓间充质干细胞向血管内皮细胞分化的影响.中国血管外科杂志,2010,2(2):112-116.
[28]Wu XJ,Huang L,Zhou Q,et al.Plasticity of bone marrow stromal stem cells along endothelial lineage under different culture condition.Chin J Arterioscler,2005,13(4):393-396(in Chinese).武晓静,黄岚,周骐,等.不同诱导条件对人骨髓基质干细胞向内皮分化的影响.中国动脉硬化杂志,2005,13(4):393-396.
[29]Yue WM,Liu W,Bi YW,et al.Mesenchymal stem cells differentiate into an endothelial phenotype,reduce neointimal formation and enhance endothelial function in a rat vein grafting model.Stem Cells Dev,2008,17(4):785-793.
[30]Guo Y,Shi B,Wang ZL,et al.Effects of peripheral blood mesenchyme stem cells transplantation on vascular smooth muscle cell apoptosis after balloon-induced artery injury in rabbits.Chin J Biomed Eng,2010,29(2):288-294(in Chinese).郭艳,石蓓,王正龙,等.外周血间充质干细胞移植对球囊损伤兔血管平滑肌细胞凋亡的影响.中国生物医学工程学报,2010,29(2),288-294.
[31]Liu ZJ,Shi B,Xu GX.Effect of bone marrow mesenchymal stem cells transplantation on repairment of injured vascular endothelial.Chin J Arterioscler,2011,19(9):716-720(in Chinese).刘志江,石蓓,许官学,等.骨髓间充质干细胞移植对损伤血管的内皮修复作用.中国动脉硬化杂志,2011,19(9):716-720.
[32]Eirin A,Zhu XY,Krier JD,et al.Adipose tissue-derived mesenchymal stem cells improve revascularization outcomes to restore renal function in swine atherosclerotic renal artery stenosis.Stem Cells,2012,30(5):1030-1041.
[33]Wang ZX,Mao S,Li Y.Effects of MSCs on the progression of atherosclerosis plaque in ApoE-knock out mice.Chin J Cell Mol Immunol,2012,28(3):244-246(in Chinese).王治校,毛山,李玉,等.间充质干细胞移植对小鼠动脉粥样斑块形成的影响.细胞与分子免疫学杂志,2012,28(3):244-246.
[34]Wang CH,Cherng WJ,Yang NI,et al.Late-outgrowth endothelial cells attenuate intimal hyperplasia contributed by mesenchymal stem cells after vascular injury.Arterioscler Thromb Vasc Biol,2008,28(1):54-60.
[35]Peled A,Zipori D,Abramsky O,et al.Expression of alpha-smooth muscle actin in murine bone marrow stromal cells.Blood,1991,78(2):304-309.
[36]Charbord P,Lerat H,Newton I,et al.The cytoskeleton of stromal cells from human bone marrow cultures resembles that of cultured smooth muscle cells.Exp Hematol,1990,18(4):276-282.
[37]Kinner B,Zaleskas JM.Regulation of smooth muscle actin expression and contraction in adult human mesenchymal stem cells.Exp Cell Res,2002,278(1):72-83.
[38]Gong Z,Niklason LE.Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs).FASEB J,2008,22(6):1635-1648.
[39]Yan Pk,Duan CW,Li SH,et al.Effect of oxidative low-density lipoprotein on the proliferation of bone marrow stem cell-derived smooth muscle cells.J South Med Univ,2010,30(5):989-992(in Chinese).严鹏科,段才闻,李世煌,等.氧化型低密度脂蛋白对骨髓源性平滑肌样细胞增殖的影响.南方医科大学学报,2010,30(5):989-992.
[40]Liu PX,Zhang L,Liao WB.Transfusion of allogeneic mesenchymal stem cells promotes progression of atherosclerotic plaque in rabbits.J Exp Hematol,2009,17(3):700-705(in Chinese).刘鹏霞,张磊,廖文斌,等.异基因间充质干细胞输注促进动脉粥样硬化发展.中国实验血液学杂志,2009,17(3):700-705.
[41]O’Shea CA,Hynes SO,Shaw G,et al.Bolus delivery of mesenchymal stem cells to injured vasculature in the rabbit carotid artery produces a dysfunctional endothelium.Tissue Eng Part A,2010,16(5):1657-1665.
[42]Psaltis PJ,Zannettino AC,Worthley SG,et al.Concise review:mesenchymal stromal cells:potential for cardiovascular repair.Stem Cells,2008,26(9):2201-2210.
[43]Satija NK,Singh VK,Verma YK,et al.Mesenchymal stem cell-based therapy:a new paradigm in regenerative medicine.J Cell Mol Med,2009,13(11/12):4385-4402.
[44]Karp JM,Leng Teo GS.Mesenchymal stem cell homing:the devil is in the details.Cell Stem Cell,2009,4(3):206-216.
[45]Gnecchi M,Zhang Z,Ni A,et al.Paracrine mechanisms in adult stem cell signaling and therapy.Circ Res,2008,103(11):1204-1219.
[46]Mimeault M,Hauke R,Batra SK,et al.Stem cells:a revolution in therapeutics-recent advances in stem cell biology and their therapeutic applications in regenerative medicine and cancer therapies.Clin Pharmacol Ther,2007,82(3):252-264.
[47]Lozito,Kuo CK,Taboas JM,et al.Human mesenchymal stem cells express vaseular cell phenotypes upon interaction with endothelial cell matrix.J Cell Bioehem,2009,107(4):714-722.
[48]Tremain N,Korkko J,Ibberson D,et al.MicroSAGE analysis of 2353 expressed genes in a single c ell-derived colony of undifferentiated human mesenchymal stem cells reveals mRNAs of multiple cell lineages.Stem Cells,2001,19(5):408-418.
[49]Yuan WD,Sun XH,Fang XU.Study on differentiation of bone marrow mesenchymal stem cells in coculture with the adventitial fibroblasts cells.Life Sci Res,2012,16(5):441-445(in Chinese).袁文丹,孙旭红,徐芳.血管外膜成纤维细胞诱导BMSCs 向平滑肌细胞定向分化.生命科学研究,2012,16(5):441-445.
[50]Goerke SM,Plaha J,Hager S,et al.Human endothelial progenitor cells induce extracellular signal-regulated kinase-dependent differentiation of mesenchymal stem cells into smooth muscle cells upon cocultivation.Tissue Eng Part A,2012,18(23-24):2395-2405.
[51]Janmaat ML,Heerkens JL,de Bruin AM,et al.Erythropoietin accel-erates smooth muscle cell-rich vascular lesion formation in mice through endothelial cell activation involving enhanced PDGF-BB release.Blood,2010,115(7):1453-1460.
[52]Ball SG,Shuttleworth CA,Kielty CM.Plateletderived growth factor receptor-alpha is a key determinant of smooth muscle alpha-actin filaments in bone marrow-derived mesenchymal stem cells.Int J Biochem Cell Biol,2007,39(2):379-391.
