核酸疫苗初免-蛋白疫苗加强的免疫策略提高日本血吸虫核酸疫苗免疫效果
2013-06-30刘秉春崔新洁罗新松王潇
刘秉春,崔新洁,罗新松,王潇
1 内蒙古大学生命科学学院,内蒙古呼和浩特 010021
2 湖南省血吸虫病防治研究所,湖南岳阳 414000
日本血吸虫病是一种流行广泛、危害严重的人兽共患寄生虫病。如何有效控制和预防日本血吸虫成为全世界普遍关注的公共卫生问题。研制血吸虫病疫苗可作为化疗的补充,能更有效地控制血吸虫感染。近年来己经开展了血吸虫DNA疫苗的研制,并且取得了一定的效果,但其免疫保护效果还是很不理想。如何增强DNA 疫苗的免疫效果是当前日本血吸虫疫苗研究的重点[1-2]。联合运用性质不同的核酸疫苗和重组蛋白疫苗进行免疫接种可以同时增强DNA 疫苗诱导的体液免疫应答和细胞免疫应答,如上调抗体水平、细胞增殖反应、CTL 活性及细胞因子的分泌等,从而有效地提高疫苗效果[3-5]。本课题组前期研究工作表明,单一构建SjGST-32的核酸疫苗和蛋白疫苗均难以同时诱导高水平的体液免疫和细胞免疫应答。本研究将构建的 VR1012-SjGST-32 DNA 疫苗免疫小鼠,然后用相应用蛋白rSjGST-32疫苗加强免疫,探讨DNA 初免-蛋白加强的联合免疫策略是否能增强血吸虫DNA疫苗的免疫保护效果,为研制高效抗血吸虫疫苗提供实验依据。
1 材料与方法
1.1 材料
1.1.1 主要试剂
大肠杆菌DH5α、载体VR1012以及编码谷胱苷肽转移酶和组织蛋白酶B 二价核酸疫苗VR1012-SjGST-32和相应重组蛋白rSjGST-32为本实验室保存;羊抗小鼠IgG-HRP、TMB、MTT、刀豆蛋白(Con A)、牛血清白蛋白(BSA)、莫能菌素、多聚甲醛和皂素均为Sigma 公司产品;IL-4、IFN-γ、CD4、IL-10荧光单克隆抗体和Fc抗体购自BD 公司;胎牛血清和RPMI-1640为GIBCO 公司产品。
1.1.2 试验动物
雌性C57/B6小鼠,6~8周龄,购自北京维通利华实验动物公司,试验动物均用无病源污染的饲料及饮水饲养。
1.2 抗原的制备与鉴定
将实验室保存的重组质粒VR1012-SjGST-32转化大肠杆菌DH5α感受态细胞,利用限制内切酶鉴定重组质粒的正确性,经发酵后通过碱裂解法大量制备重组质粒,−20℃保存备用;重组rSjGST-32蛋白抗原的制备参考分子克隆试验手册,用Bradford 法进行蛋白定量后−80℃保存备用。
1.3 动物免疫及攻击感染
将6~8周龄C57/B6雌性小鼠随机分成A、B、C、D、E 5组,每组10只:A 组(PBS 对照组)、B 组(空质粒VR1012对照组)、C 组(核酸疫苗VR1012-SjGST-32组)、 D 组(蛋白疫苗rSjGST-32组)、E 组(联合免疫VR1012-SjGST-32+rSjGST-32组)。VR1012空质粒及核酸疫苗100μg/次、蛋白疫苗50μg/次,各组均于0 d、14 d、28 d 采用肌肉多点注射免疫3次(联合免疫组0 d、14 d 为核酸疫苗,28 d 为蛋白疫苗)。末次免疫后2周,每鼠经腹部皮肤感染(30±2)条日本血吸虫(大陆株)尾蚴。攻击感染45 d 后剖杀小鼠,肝门静脉灌注法收集成虫。从固定部位取小鼠肝组织1 g,加入20 mL 5%的KOHL,于37℃孵箱中消化过夜,取0.1 mL 在普通光镜下进行虫卵计数。
减虫率(%)=(对照组平均检获成虫数−实验组平均检获成虫数)/对照组平均检获成虫数×100%。
减卵率(%)=(对照组每雌虫平均产卵数−实验组每雌虫平均产卵数)/对照组每雌虫平均产卵数×100%。
1.4 鼠肝脏虫卵肉芽肿平均直径及虫卵肉芽肿的面积检测
攻击感染后45 d 剖杀小鼠,从固定部位切取小鼠肝组织,用10%福尔马林液固定,石蜡包埋,切片和HE 染色,低倍镜下观察其病理学变化,并应用Motic 照相处理软件和病理图像分析系统,测量各组鼠肝脏虫卵肉芽肿平均直径和虫卵肉芽肿面积。
1.5 血清总IgG 的检测
用重组蛋白rSjGST-32抗原包被ELISA 板,以末次免疫后14 d 小鼠血清为一抗,以酶标羊抗鼠IgG 为二抗,间接ELISA 法检rSjGST-32特异性IgG 水平。
1.6 MTT 法检测T 淋巴细胞增殖反应
末次免疫后7 d,无菌条件下分离小鼠脾脏淋巴细胞,通过尼龙柱除去B 细胞制成单细胞悬液,调整细胞浓度到1×106个/mL,活细胞数在90%,每孔加入100μL 细胞悬液到96孔细胞培养板上。其中实验组为加100μL 日本血吸虫抗原至终浓度为5μg/mL,阳性对照为加100μL ConA 至终浓度为5μg/mL,无关对照为加100μL BSA 至终浓度为2μg/mL,空白对照物为100μL RPMI-1640。实验组和对照组各设3个重复孔,37℃、5% CO2培养48~72 h 后,每孔加入20μL 5μg/mL MTT,继续培养4 h,离心弃上清,每孔加入100μL DMSO,培养15 min 后,用酶标仪测定A570吸光值。淋巴细胞增殖反应能力用刺激指数表示。刺激指数SI =(A 实验组−A 培养基)/(A 细胞−A 培养基)。
1.7 流式细胞仪检测细胞因子表达水平
末次免疫后7 d,无菌条件下分离小鼠脾脏淋巴细胞,通过尼龙柱除去B 细胞制成单细胞悬液,调整细胞浓度到5×106个/mL ,每孔加入100μL 细胞悬液到96孔细胞培养板上。实验组:加日本血吸虫抗原和抗CD28抗体,每孔各50μL 至终浓度为5μg/mL;阳性对照组:加100μL PMA 至终浓度为5μg/mL,空白对照组:加100μL RPMI-1640。实验组和对照孔各设3个重复孔。37℃、5% CO2培养48 h 后,离心收集细胞,用抗Fc 抗体封闭,加4%多聚甲醛固定8 min,0.1%皂素破膜5 min,PBS 洗2次,用10μL 荧光单克隆抗体4℃暗处染色30 min 后,取300μL 进行流式细胞仪检测。
2 结果与分析
2.1 虫体的收获及减虫率的计算
攻击感染后45 d 剖杀小鼠,各免疫组的虫荷数及减虫率见表1,联合免疫组的减虫率达42.92%,而DNA 单独免疫组或蛋白单独免疫组的减虫率分别为31.15%和22.68%。联合免疫组和单独DNA 疫苗组或单独蛋白疫苗组相比,差异显著,但单独免疫组之间的虫荷数无显著差异。
2.2 虫卵的收获及减卵率的计算
各组小鼠肝组织中每条雌虫平均产卵数及减卵率见表2。如表所示,联合免疫组的减卵率(57.98%)与DNA单独免疫组(39.58%)或蛋白单独免疫组(37.09%)相比差异显著,但单独免疫组减卵率无显著差异。
2.3 鼠肝脏虫卵肉芽肿平均直径及虫卵肉芽肿的面积测定结果
表3显示各组肝脏虫卵肉芽肿平均直径及虫卵肉芽肿的面积测定结果,联合免疫组的虫卵肉芽肿平均直径及虫卵肉芽肿的与DNA 单独免疫组和蛋白单独免疫差异显著。
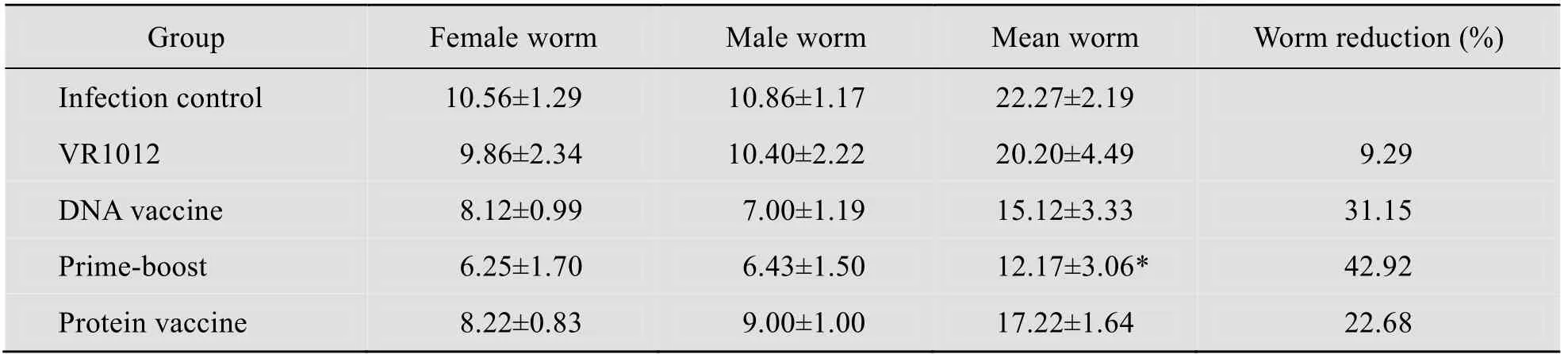
表1 各组检获成虫数和减虫率Table 1 Worm burden and worm reduction rate in immunized mice compared with the control

表2 各组平均每克肝组织虫卵数及减卵率Table 2 Eggs per gram of liver tissue and egg reduction rate of groups
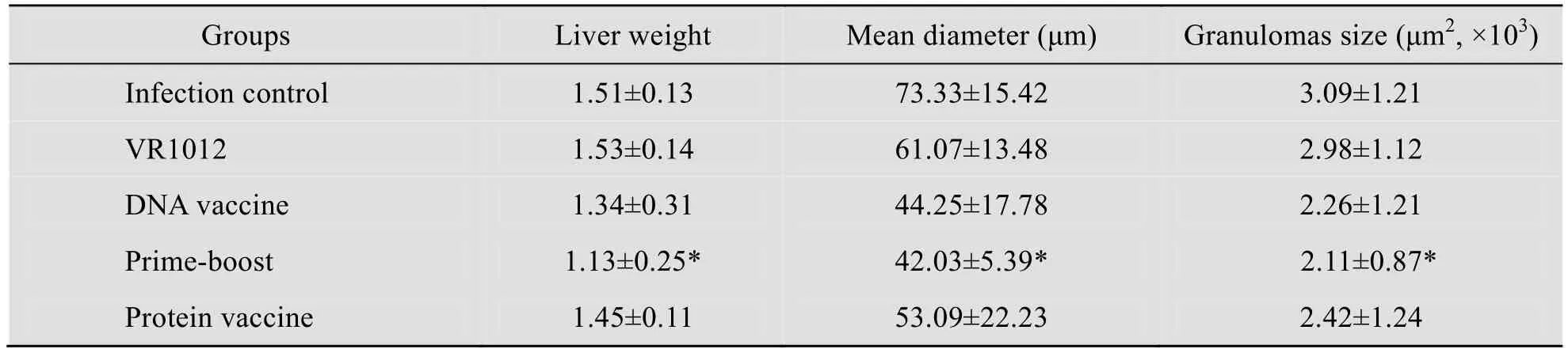
表3 鼠肝脏虫卵肉芽肿平均直径和肉芽肿的面积结果Table 3 Mean areas of single-egg granulomas and the mean areas occupied by granulomas in liver sections
2.4 淋巴细胞增殖反应
为了检测各种疫苗免疫后细胞免疫反应,在末次免疫后7 d,无菌取出脾脏,通过MTT 法进行T 细胞扩增检测,ConA 用于所有的实验组中作为阳性对照,rSjGST-32抗原来刺激T 细胞增殖,而BSA 作为非特异性抗原。如图1所示,DNA 初免-蛋白加强免疫组T 细胞增殖反应显著高于单独免疫DNA 疫苗组和单独免疫蛋白疫苗组。
2.5 血清总IgG 的检测
以r SjGST-32蛋白作为检测用抗原,包被ELISA 板,间接ELISA 法对末次免疫后14 d 收集的小鼠血清中的IgG 进行测定,结果如图2所示,联合免疫组抗体IgG 滴度显著高于DNA 疫苗组,但与单独免疫蛋白疫苗组,无显著差异。

图1 T 淋巴细胞扩增反应结果Fig.1 T cell proliferation.

图2 间接ELISA 检测IgG 滴度Fig.2 IgG titer in different groups.
2.6 细胞因子检测结果
细胞因子的表达在调节免疫反应和免疫平衡过程中起到重要作用,为进一步检测联合免疫后小鼠体内细胞因子表达的变化情况,在末次免疫后7 d,分离各实验组小鼠脾脏淋巴细胞,对小鼠脾脏淋巴细胞进行胞内因子染色,用流式细胞仪检测并分析结果。结果如图3所示,DNA疫苗初免-蛋白疫苗加强的免疫策略显著增强了抗原特异性 CD4+IFN-γ+的产生,而降低了CD4+IL-10+的产生,提示为Th1型免疫应答。

图3 流式细胞仪检测胞内细胞因子Fig.3 Antigen-specific cytokines profiles by FACS.Intracellular staining for IFN-γ+ in CD4+(A) and IL-4 in CD4+(B)IL-10 in CD4+(C) in cells was performed.The percentages of positive cells were showed in each dot-plot in the gated area.D is a representation of the percentage of intracellular cytokines of each group.The data shown are representative of three independent experiments.*P <0.05.
3 讨论
虽然DNA 疫苗能诱导全面的免疫应答反应,而且能引起长期的免疫记忆。然而,DNA疫苗诱导以细胞免疫为主,抗体水平较弱,保护效果不够理想[6-7]。基因工程构建的重组蛋白疫苗一般均能诱导机体产生高滴度的抗体,但其诱导的细胞免疫水平常显不足,保护效果有限[8-10]。许多研究者认为,采用核酸疫苗与蛋白疫苗联合免疫可发挥两种疫苗在机体内诱导免疫应答的不同优势,从而增强疫苗诱导机体产生特异性免疫应答的效果。近年来,在布鲁杆菌病、疟疾、弓形虫病、日本脑炎、结核病和艾滋病等疫苗的研究中发现,用核酸疫苗初免继而用相应蛋白疫苗加强免疫后,其免疫应答水平和保护性免疫效果均较单一核酸疫苗或单一蛋白疫苗增高[11-14]。
血吸虫疫苗追求的目标主要有3个,第一是能够产生较强的感染免疫保护力,表现在减虫率指标上。本实验用日本血吸虫 DNA 疫苗VR1012-SjGST-32与重组蛋白疫苗rSjGST-32联合免疫小鼠(核酸疫苗初免-蛋白疫苗加强),获得了42.3%的减虫率,与VR1012-SjGST-32单独免疫(减虫率为31.15%)和rSjGST-32联合免疫(减虫率为22.68%)相比,差异显著,表明DNA疫苗和蛋白疫苗联合应用有明显的减虫作用。其二是抗生殖力,表现为雌虫产卵量的下降和卵胚发育的障碍[15-16]。本研究显示,从减卵效果来看,结果发现联合免疫组获得了59.6%的减虫率,与VR1012-SjGST-32单独免疫(减虫率为31.15%)和rSjGST-32联合免疫(减虫率为22.68%)相比,差异显著,进一步说明联合免疫组除具有抗日本血吸虫感染的功效外,也具有一定的抗生殖作用。其三是抗病理免疫保护力,表现在对虫卵肉芽肿形成的抑制和肝纤维化的调节上。血吸虫病的病变主要由虫卵引起,虫卵主要是沉着在宿主的肝及结肠肠壁等组织,所引起的肉芽肿和纤维化是血吸虫病的主要病变,虫卵肉芽肿与纤维化的形成是肝脏病理变化的基础。虫卵肉芽肿的形成是宿主对致病因子的一种免疫应答。一方面通过肉芽肿反应将虫卵破坏清除,并能隔离和清除虫卵释放的抗原,减少血液循环中抗原抗体复合物的形成和对机体的损害;另一方面,肉芽肿反应破坏了宿主正常组织,不断生成的虫卵肉芽肿形成相互连接的疤痕,导致干线型肝硬变及肠壁纤维化等一系列病变[17-21]。在本研究中发现,联合免疫组与单独免疫组相比,小鼠肝脏病理变化明显减轻,肉芽体积较小,炎症反应轻微,改善了由于虫卵的沉积而造成的肝脏病理损害。
许多研究表明,血吸虫疫苗诱导的保护力依赖于CD4+T 淋巴细胞和IFN-γ的存在,IFN-γ激活的效应性细胞是抵抗血吸虫感染的主要机制[22]。在本研究中,我们用胞内细胞因子染色的方法对CD4+IFN-γ+和CD4+L-10+进行检测,结果显示,与单独DNA 免疫组或者单独蛋白免疫组相比,DNA 疫苗初免-蛋白疫苗加强的免疫策略增强了抗原特异性CD4+IFN-γ+的产生,而降低了CD4+L-10+的产生,显著地提高了Th1型细胞因子的表达,这可能与联合疫苗可以在一定程度上提高动物的保护效果有关。
研究结果初步证明:DNA 初免-蛋白加强的联合免疫策略可以提高减虫和减卵效果,而且在一定程度上减轻了肝脏的病理损害,其免疫保护效果可能与联合免疫增强了抗原特异性CD4+IFN-γ+的产生有关,为探索日本血吸虫病疫苗研制的新途径和探讨日本血吸虫感染的保护性免疫机制提供有益的实验研究资料。
[1]Halkic N,Gintzburger D.Schistosomiasis.N Engl J Med,2002,347(10):766−768.
[2]Ross AG,Sleigh AC,Li Y,et al.Schistosomiasis in the People's republic of China:prospects and challenges for the 21st century.Clin Microbiol Rev,2001,14(2):270−295.
[3]Glynn A,Freytag LC,Clements JD.Effect of homologous and heterologous prime-boost on the immune response to recombinant plague antigens.Vaccine,2005,23(16):1957−1965.
[4]Ahmad G,Zhang W,Torben W,et al.Prime-boost and recombinant protein vaccination strategies using Sm-p80 protects against Schistosoma mansoni infection in the mouse model to levels previously attainable only by the irradiated cercarial vaccine.Parasitol Res,2009,105(6):1767−1777.
[5]Lasaro MO,Luiz WB,Sbrogio-Almeida ME,et al.Prime-boost vaccine regimen confers protective immunity to human-derived enterotoxigenic Escherichia coli.Vaccine,2005,23(19):2430−2438.
[6]Wang S,Kennedy JS,West K,et al.Cross-subtype antibody and cellular immune responses induced by a polyvalent DNA prime-protein boost HIV-1 vaccine in healthy human volunteers.Vaccine,2008,26(31):3947−3957.
[7]Wong HT,Cheng SC,Sin FW,et al.A DNA vaccine against foot-and-mouth disease elicits an immune response in swine which is enhanced by co-administration with interleukin-2.Vaccine,2002,20(21/22):2641−2647.
[8]Zhang Y,Taylor MG,Johansen MV,et al.Vaccination of mice with a cocktail DNA vaccine induces a Th1-type immune response and partial protection against Schistosoma japonicum infection.Vaccine,2001,20(5/6):724−730.
[9]Dai Y,Zhu YC,Donald A.Harn,et al.DNA vaccination by electroporation and boosting with recombinant proteins enhances the efficacy of DNA vaccines for Schistosomiasis japonica.Clin Vaccine Immunol,2009,16(12):1796−1803.
[10]Wynn TA,Jankovic D,Hieny S,et al.IL-12 enhances vaccine-induced immunity to Schistosoma mansoni in mice and decreases T helper 2 cytokine expression,IgE production,and tissue eosinophilia.J Immunol,1995,154(9):4701−4709.
[11]Cassataro J,Velikovsky CA,Bruno L,et al.Improved immunogenicity of a vaccination regimen combining a DNA vaccine encoding Brucella melitensis outer membrane protein 31(Omp31) and recombinant Omp31 boosting.Clin Vaccine Immunol,2007,14(7):869−874.
[12]Dunachie SJ,Hill AV.Prime-boost strategies for malaria vaccine development.J Experiment Biol,2003,206:3771−3779.
[13]Bivas-Benita M,Laloup M,Versteyhe S,et al.Generation of Toxoplasma gondii GRA1 protein and DNA vaccine loaded chitosan particles:preparation,characterization,and preliminary in vivo studies.Int J Pharm,2003,266(1/2):17−27.
[14]Shu Y,Winfrey S,Yang ZY,et al.Efficient protein boosting after plasmid DNA or recombinant Adenovirus immunization with HIV-1 vaccine constructs.Vaccine,2007,25(8):1398−1408.
[15]Da'dara AA,Li YS,Xiong T,et al.DNA-based vaccines protect against zoonotic schistosomiasis in water Buffalo.Vaccine,2008,26(29-30):3617−3625.
[16]Da'dara AA,Skelly PJ,Fatakdawala M,et al.Comparative efficacy of the Schistosoma mansoni nucleic acid vaccine,Sm23,following microseeding or gene gun delivery.Parasite Immunol,2002,24(4):179−187.
[17]Mountford AP,Anderson S,Wilson RA.Induction of Th1 cell-mediated protective immunity to Schistosoma mansoni by co-administration of larval antigens and IL-12 as an adjuvant.J Immunol,1996,156(12):4739−4745.
[18]Pancre V,Wolowczuk I,Guerret S,et al.Protective effect of rSm28GST-specific T cells in schistosomiasis:role of gamma interferon.Infect Immun,1994,62(9):3723−3730.
[19]Czaja MJ,Weiner FR,Takahashi S,et al.Gamma-interferon treatment inhibits collagen deposition in murine schistosomiasis.Hepatology,1989,10(5):795−800.
[20]Fallon PG,Dunne DW.Tolerization of mice to Schistosoma mansoni egg antigens causes elevated type 1 and diminished type 2 cytokine responses and increased mortality in acute infection.J Immunol,1999,162(7):4122−4132.
[21]Xiao W,Jin HL,Du XG,et al.The protective efficacy aganist Schistosoma japonicum infection by immunization with DNA vaccine and levamisole as adjuvant in mice.Vaccine,2008,26(15):1832−1845.
[22]Da'dara AA,Skelly PJ,Wang MM,et al.Immunization with plasmid DNA encoding the integral membrane protein,Sm23,elicits a protective immune response against Schistosome infection in mice.Vaccine,2001,20(3/4):359−369.
