高效转化黄姜皂苷为薯蓣皂苷元菌株的筛选及转化条件优化
2013-06-30张佳佳李会李恒陆震鸣史劲松许正宏
张佳佳,李会,李恒,陆震鸣,史劲松,许正宏
江南大学药学院,江苏无锡 214122
黄姜[Dioscorea zingiberensis C.H.Wright(DZW)]是我国特有的薯蓣科薯蓣属植物,其根茎含有的薯蓣皂苷是生产薯蓣皂苷元的重要原料之一[1]。薯蓣皂苷元是合成多种甾体类药物的重要中间体,主要以薯蓣皂苷配体的形式存在于薯蓣科等植物根茎内[2]。传统的生产薯蓣皂苷元的方法包括酸解法、自然发酵法、酶解法、萃取法等[3]。工业上普遍使用的酸解法带来严重的环境污染和资源浪费。近年来,研究人员针对薯蓣皂苷元生产中存在的问题做了一系列的改进,如热处理剥离黄姜中的淀粉和纤维素,干燥后直接提取[4];微波辅助双水相提取[5];以及微生物转化法切断薯蓣皂苷中的糖苷键,释放薯蓣皂苷元等[6]。
与酸解法相比微生物转化法具有低成本、强选择性、易于控制反应条件等特点,而且大幅度降低了废水中BOD、COD、H+、SO42−。Feng 等[7]利用新月弯孢霉转化黄姜中皂苷,并从转化产物中发现薯蓣皂苷元、萨尔萨皂苷元、知母皂苷等;Zhu等[8]利用里氏木霉将黄姜中皂苷转化为薯蓣皂苷元,转化时间为6.5 d,产率为(30.4±1.54) mg/g DZW。但是仍面临着副产物多、前处理复杂和转化周期较长等问题。
为解决以上问题,从本实验室保藏的菌种库中筛选能将黄姜中的皂苷转化为薯蓣皂苷元且副产物少的微生物。在此基础上,利用统计实验方法Plackett-Burman (PB)和响应面设计优化培养基,以期为生物转化制备薯蓣皂苷元方法的工业化生产和应用奠定基础。
1 材料与方法
1.1 材料
1.1.1 菌株
本研究使用的菌株均来自实验室保藏库。
1.1.2 培养基
筛选培养基(g/L):硝酸钠3,磷酸二氢钾1,七水硫酸镁0.5,氯化钾0.5,七水硫酸亚铁0.01,黄姜皂苷3,琼脂20,自然pH。
基础转化培养基(g/L):葡萄糖10,酵母膏7.5,氯化钠1,磷酸二氢钾3,七水硫酸锌1,黄姜提取物3,pH 7.0。
1.1.3 主要材料与试剂
黄姜购自湖北省郧西县;淀粉酶(20000 U/mL)、糖化酶(100000 U/mL)购自江苏诺维信(中国)生物技术有限公司。其他试剂来自国药化学试剂有限公司。
1.1.4 主要实验仪器
UV1700紫外-可见光分光光度计购自天津天光公司;HYL-C 组合式摇床购自太仓强乐实验设备有限公司;Ultimate 3000高效液相色谱仪购自戴安公司。
1.2 方法
1.2.1 菌种初筛
将实验室保藏的36株微生物分别接种至液体察氏培养基进行种子培养2 d,分别吸取100μL 均匀涂布于筛选培养基,30℃培养2 d,挑选能在筛选培养基表面生长的微生物[1]。
1.2.2 菌种复筛
将初筛菌株接种到液体基础转化培养基,30℃、200 r/min 培养7 d,设不接种微生物的为空白对照。取50 mL 转化液离心取沉淀,并加20 mL石油醚超声提取4 h[3-4]。采用TLC 和HPLC 检测提取液中的薯蓣皂苷元,与空白和标准品比较。
1.2.3 薄层层析(TLC)检测法
采用硅胶预制板,展开剂是99%氯仿:1%甲醇,显色剂为5%香草醛硫酸溶液,点样量5μL,105℃加热5 min 显色。
1.2.4 高效液相色谱(HPLC)检测法
C18反相柱(Agilent TC-C18,4.6 mm×150 mm,5μm);流动相为90%乙腈:10%水;流速1 mL/min;柱温为室温;紫外检测波长203 nm;进样量10μL。
1.2.5 黄姜的预处理方法对薯蓣皂苷元产量的影响
无水乙醇提取法:100 g 干黄姜粉末加入1 L无水乙醇,回流提取8 h,过滤,滤液蒸干得到醇溶皂苷。
直接酶解法:100 g 干黄姜粉,加入2 L 水中煮沸1 h。加入淀粉酶1 mL 和糖化酶4 mL,60℃温育8 h。离心取沉淀,烘干[8-9]。
预处理酶解法:称取鲜黄姜312 g (合100 g 干黄姜)粉碎磨浆,重复洗涤过滤。滤液静置后取中层悬浊液,加入淀粉酶1 mL 和糖化酶4 mL,60℃酶解6 h,离心取沉淀烘干[10]。
按照以上3种方法处理黄姜,将得到的固体作为转化底物分别加入转化培养基,比较不同黄姜预处理方式对薯蓣皂苷元产量的影响。
1.2.6 优化方法
设计Plackett-Burman 实验,考察培养基各组分对薯蓣皂苷元产率影响的显著性;设计影响最显著因素的最陡爬坡实验,根据实验结果确定响应面实验的因素和水平。使用design expert 设计响应面实验,通过对结果进行分析得到优化培养基组成[11-12]。进行最优条件下的发酵转化验证实验,首先将赤霉菌WX12接种至液体察氏培养基进行种子培养24 h,然后将种子接种至优化后的转化培养基,培养7 d,每12 h 取转化培养基离心取沉淀,石油醚超声提取,检测不同时间石油醚提取液中薯蓣皂苷元的产率。确定薯蓣皂苷元最高产率的时间,重复发酵转化验证试验3次。
2 结果
2.1 菌种筛选
经过初筛,挑选得到7株能生长的菌株。继而将初筛获得的微生物接种到液体基础转化培养基中,培养7 d 后通过TLC 和HPLC 检测进行复筛。TLC 检测提取液中的薯蓣皂苷元(图1),结果发现赤霉菌Gibberella intermedia WX12的转化液中含有薯蓣皂苷元。图2为薯蓣皂苷元标准品与赤霉菌转化液的HPLC 图谱,可以看出,转化液的HPLC图谱中有与标准品的出峰时间一致的物质峰,证实了转化液中薯蓣皂苷元的存在。因此选择赤霉菌作为转化菌株。
2.2 黄姜前处理
干黄姜100 g 通过乙醇提取、直接酶解、预处理酶解分别可以得到转化底物7.10 g、56.2 g 和10.1 g。将这3种转化底物加入转化培养基,使用赤霉菌进行转化试验可以分别得到薯蓣皂苷元(2.0±0.1)、(11.9±0.2)、(3.1±0.1) mg/g DZW。因此使用直接酶解法作为黄姜前处理方法。
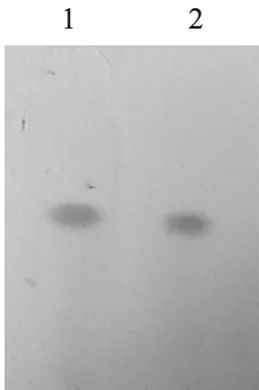
图1 发酵产物薄层层析(TLC)色谱图Fig.1 Thin layer chromatogram of fermentation sample.1:standard;2:fermentation sample.
2.3 PB 实验设计结果与分析
利用design expert 软件进行PB 实验设计,考察培养基的5个组分对薯蓣皂苷元产率的影响。表1显示葡萄糖、酵母膏和硫酸锌对薯蓣皂苷元产率影响显著。其中正向影响因子是葡萄糖和硫酸锌,负向影响因子为酵母膏,可信度>95%。
2.4 最陡爬坡实验结果
根据PB 实验结果筛选出3个主要因素的效应和大小比例,设定变化方向及步长,进行最陡爬坡实验。根据实验结果找出逼近薯蓣皂苷元最高产率的区域,将其作为响应面实验因素水平的中心点。通过最陡爬坡实验,得到薯蓣皂苷元产率达到(19.2±0.2) mg/g DZW。
2.5 响应面实验结果
利用design expert 8.0软件进行响应面实验设计,并进行回归分析和方差分析,拟合得到回归方程:
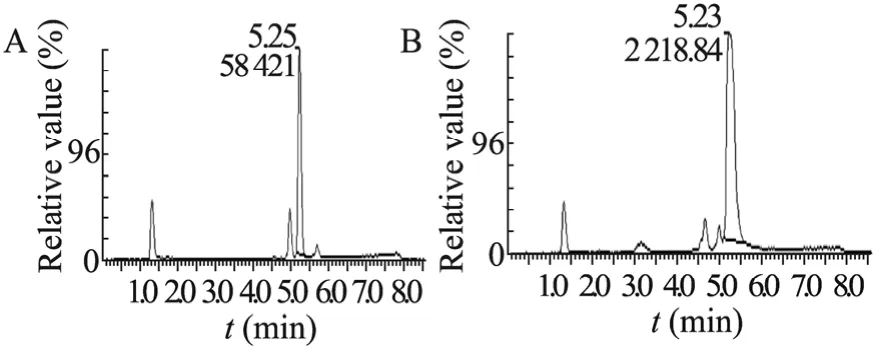
图2 标样(A)和赤霉菌发酵产物(B)的HPLC 分析图Fig.2 HPLC chromatograms of diosgenin standard (A)and fermention sample (B).
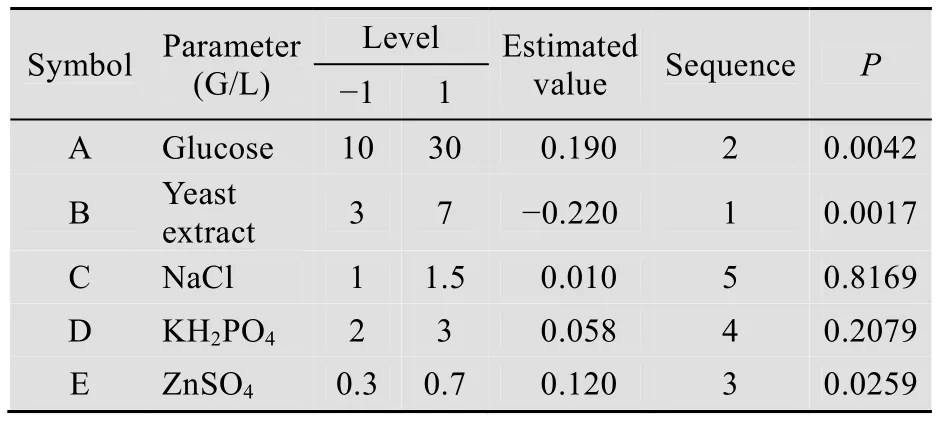
表1 试验设计的因子水平及效应评价Table 1 Factors levels and efficiency evaluation of experimental design
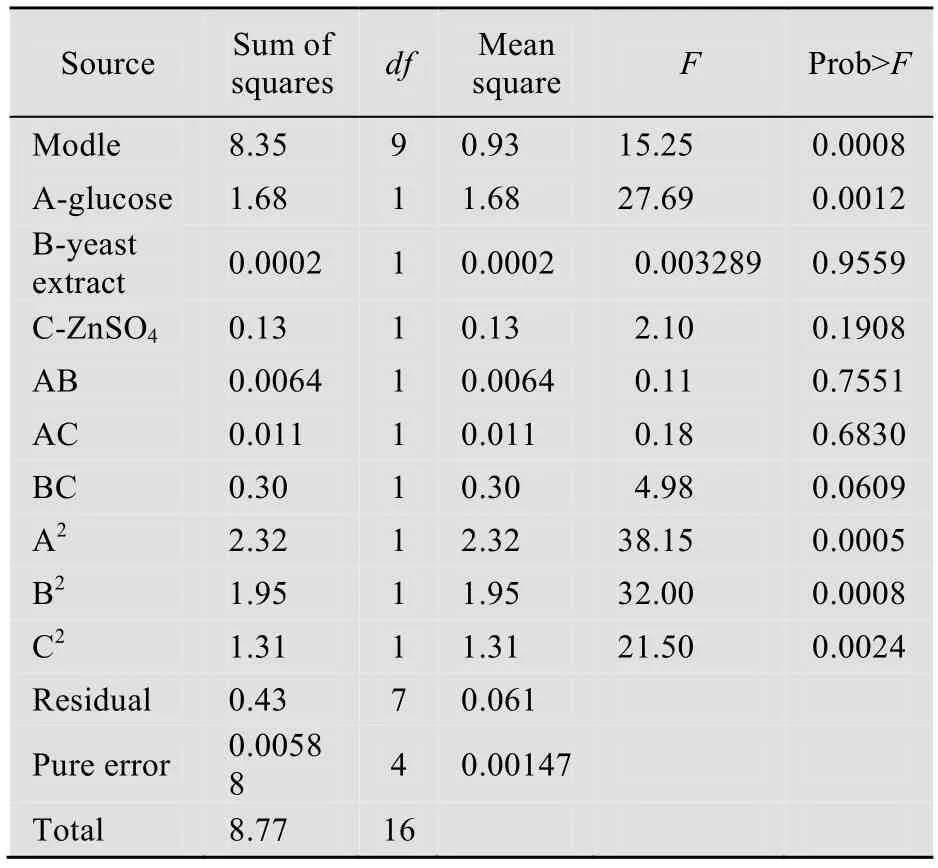
表2 回归模型的方差分析Table 2 Variance analysis of parameters in regression modle
Y=−112.0599+7.8988A+0.8656B+41.6125C−0.01AB−0.1313AC+0.6875BC−0.1856A2−0.1699B2−13.9313C2。
从回归方程和表2以看出,回归模型大于F 值的概率为0.0008,说明此模型的可信度较高。由可信度分析可以得到复相关系数R2=0.9515,校正后R2=0.8891,也说明了该模型的可信度较高。对回归方程求导得到培养基组分(g/L)为:葡萄糖20.6;酵母膏5.0;氯化钠1;磷酸二氢钾3;硫酸锌1.5;黄姜酶解物3;预测值:31.1 mg/g DZW。
根据不同时间的薯蓣皂苷元产率结果得到转化5 d 后薯蓣皂苷元的产率最高,因此将转化时间定为5 d。根据响应面的结果进行3次发酵转化验证实验,最后测得薯蓣皂苷元产率为30.8、31.3、30.8 mg/g DZW,平均值是(31.0±0.3) mg/g DZW,比优化前提高了3倍。实验值与预测值相差较小,说明该模型能较好地反映实际转化情况。
3 结论
本研究为首次报道赤霉菌Gibberella intermedia能将黄姜中的皂苷转化为薯蓣皂苷元。采用统计学设计方法-PB 实验和响应面实验对培养基优化,确定了最优培养配方。利用优化的培养基配方,薯蓣皂苷元的产率提高到(31.0±0.3) mg/g DZW,较优化前提高了3倍。
[1]Zhao YT,Xu ZL,Dai CC,et al.Selection of the microorganism for dioscin hydrolyze.J Chin Med Mater,2007,30(8):905−909(in Chinese).赵玉婷,徐增莱,戴传超,等.薯蓣皂苷水解微生物的筛选.中药材,2007,30(8):905−909.
[2]Wang YN,Fu YY,Wang Y,et al.Purification of diosgenin from culture of Rhodopseudomonas sp.No.18.J Dalian Polytech Univ,2010,(1):1−3(in Chinese).王亚南,富瑶瑶,王颖,等.细菌发酵产黄姜薯蓣皂苷元的分离纯化.大连工业大学学报,2010,(1):1−3.
[3]Li D,Li WH,Han F,et al.Process of extracting diosgenin in from Dioscorea zingiberisis by grinding starch and ultrasonic extracting method.Chin Tradit Herbal Drugs,2007,38(12):1815−1817(in Chinese).李冬,李稳宏,韩枫,等.磨浆-超声法提取黄姜中薯蓣皂苷元的工艺研究.中草药,2007,38(12):1815−1817.
[4]Chen JY,Liu GJ.Study of extracing diosgenin from heat-decomposed Dioscorea zingiberensis.Hubei Agr Sci,2007,46(1):130−132(in Chinese).陈俊英,刘国际.热分解黄姜提取薯蓣皂素的工艺.湖北农业科学,2007,46(1):130−132.
[5]Liu L,Dong YS,Xiu ZL.Microwave-assisted aqueous two-phase extraction of steroidal saponins in Dioscoreazingiberensis.Chin J Process Eng,2009,9(6):1147−1152(in Chinese).刘琳,董悦生,修志龙.微波辅助双水相提取盾叶薯蓣中的皂苷成分.过程工程学报,2009,9(6):1147−1152.
[6]Donova MV,Egorova OV.Microbial transformations:current state and prospects.Appl Microbiol Biotechnol,2012,6:1423−1447.
[7]Feng B,Ma BP,Kang LP,et al.The microbiological transformation of steroidal saponins by Curvularia lunata.Trtrahedron,2005,61:11758−11763.
[8]Zhu YL,Ni JR,Huang W.Process optimization for the production of diosgenin with Trichoderma reesei.Bioprocess Biosyst Eng,2010,33(5):647–655.
[9]Zhu YL,Huang W,Ni JR,et al.Production of diosgenin from tubers through enzymatic saccharification and microbial transformation.Appl Microbiol Biotechnol,2010,85:1409–1416.
[10]Liu W,Huang W,Sun WL,et al.Production of diosgenin from yellow ginger (Dioscorea zingiberensis C.H.Wright)saponins by commercial cellulose.World J Microbiol Biotechnol,2010,26:1171–1180.
[11]Ling HZ,Ge JP,Ping WX,et al.Fermentation optimization by response surface methodology for enhanced production of β-glucosidase of Aspergillus niger HDF05.Chin J Biotechnol,2011,27(3):419−426(in Chinese).凌宏志,葛菁萍,平文祥,等.响应面法优化黑曲霉HDF05产β-葡萄糖苷酶过程参数.生物工程学报,2011,27(3):419−426.
[12]Liu J,Luo JG,Ye H,et al.Medium optimization and structural characterization of exopolysaccharides from endophytic bacterium Paenibacillus polymyxa EJS-3.Carbohyd Polym,2010,79:206−213.
