猪VHL基因克隆及敲低克隆胚胎的构建
2013-06-30金红红王健宇王芳马婧牟彦双刘忠华
金红红,王健宇,王芳,马婧,牟彦双,刘忠华
东北农业大学胚胎工程实验室,黑龙江哈尔滨 150030
Von Hippel-Lindau (VHL)疾病是临床上常染色体显性遗传病,主要死因是肾透明细胞癌[1]和中枢神经系统成血管细胞瘤引起的并发症[2-4]。目前研究表明VHL 为肿瘤抑制基因并且参与多种生物学功能,VHL 基因编码的蛋白(以下称为VHL)可特异性结合ElonginC、B 亚单位形成pVHL-ElonginC-ElonginB 复合体,从而阻断了ElonginABC 复合物的形成,抑制了RNA 聚合酶Ⅱ的转录延长,进一步达到抑制mRNA 合成的目的[5-6]。此外VHL 还参与细胞外基质的组装[7-9]、控制细胞外围微管的稳定性以及调控细胞的凋亡和衰老等过程[10-14]。1993年,Latif 等通过连锁分析将人VHL 基因定位于染色体3p25-26,并首次成功克隆了人VHL 基因[15]。VHL 基因缺失,会使发育至E10.5-E12.5 d 的小鼠胚胎因缺少血管导致死亡[16]。Ma 等构建了接近于人VHL 疾病的小鼠模型,采用ß-actin 启动子介导的Cre/lox定点重组技术的方法,VHL 基因敲除后小鼠会引发肝血管瘤,在胰腺、肾脏、脾和心脏中同样会引发血管扩张和血管再生等[17]。
猪的心血管系统、消化系统、营养需要以及矿物质代谢等都与人类较接近[18-21],因此可能是较好的VHL 疾病模型。但目前,对猪VHL 基因的研究较少,而且并没有得到该基因的全长序列。据此,本研究首先利用3´和5´-RACE 获得猪VHL 基因全长序列,并应用RNAi 技术,在细胞和胚胎中对该基因进行有效干扰为VHL 疾病模型猪的建立奠定基础。
1 材料与方法
1.1 材料
新生巴马仔猪源自东北农业大学实验基地猪场,在实验室解剖取材,将取得的各器官组织样(包括肝脏、肾脏、脑、脊髓、肾上腺、结肠、胰腺、心脏、睾丸和肺)保存于液氮中。
实验所用质粒和菌株包括干扰载体pGenesil1.0、大肠杆菌DH5α、原代猪胎儿成纤维细胞和猪iPS (Induced pluripotent stem cells)细胞均来自本实验室。
1.2 主要试剂
LA Taq 酶、PMD-18T、T4 DNA 连接酶、3′-RACE 试剂盒、5′-RACE 试剂盒、限制性内切酶均购自TaKaRa 公司;脂质体2000和Trizol试剂均购自Invitrogen 公司;胶回收试剂盒购自Axygen 公司;质粒小量及大量提取试剂盒购自天根生物有限公司;DNA marker 购自全式金公司、逆转录试剂盒来自ABI 公司;DNA 测序由上海立菲生物技术有限公司完成。
1.3 猪VHL 基因的克隆
克隆猪VHL 基因保守序列:25μL 总体积的PCR 反应体系包括:模板1μL,引物各0.5μL,10×PCR 缓冲液2.5μL,dNTPs 2.5μL,rTaq 0.3μL,dH2O 17.7μL。PCR 反应参数设置为:94℃预变性5 min;94℃变性30 s,60℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min。PCR 产物在1.2%琼脂糖凝胶中电泳并观察结果,连接PMD-18T 并测序。共进行了3次3´-RACE 扩增和5´-RACE 扩增,按照TaKaRa公司试剂盒说明书标准操作。引物序列详见表1。
根据3´-RACE 和5´-RACE 扩增获得的序列信息,设计引物利用重叠PCR 的方法扩增VHL基因全长(图1)。扩增产物在1.0%琼脂糖凝胶中电泳并观察结果,连接PMD-18T 载体并测序。
1.4 Real-time PCR 检测VHL 基因在猪各组织器官中的表达情况
图1 猪VHL 基因全长的扩增Fig.1 The full length of the VHL gene cloning by overlapping PCR.M:DNA marker;1:VHL gene.
用Trizol 试剂提取了小巴马猪肝脏、肾脏、脑、脊髓、肾上腺、结肠、胰腺、心脏、睾丸、肺和pm20(iPS 的一个系)的RNA,反转录为cDNA。Real-time PCR 检测以上10种组织中VHL基因的表达量。反应体系为20μL:上、下游引物各0.4μL,SYBR Mix 10μL,ddH2O 7.8μL,cDNA 1μL。循环参数:95℃15 s;95℃5 s,60℃34 s,40个循环,95℃15 s,60 1 min℃,95℃15 s。反应在ABI 7500 Real Time PCR 仪上进行,以β-actin 作为内参对照,引物序列具体见表1。
1.5 干扰片段的设计及干扰载体的构建
干扰片段设计:针对猪VHL 基因的CDS 序列及3´非编码区,通过Ambion 网站设计并筛选出5条shRNA 干扰片段(表2),并对这些选定片段提交到NCBI 网站上进行Blast 比对,确保了只针对VHL 基因起作用。
重组载体构建:合成的带有 BamHⅠ和Hind Ⅲ酶切位点的5条寡核苷酸单链干扰片段,复性成双链,连接到经BamHⅠ和Hind Ⅲ线性化的pGenesil-1载体。测序正确的5种干扰载体。大量提取后测质粒浓度,用于后续转染。
将pGenesil-1.0-1-pGenesil-1.0-5五种干扰载体以脂质体的方式分别稳定转染猪iPS 细胞。24 h 后观察绿色荧光蛋白的表达情况,挑取克隆并纯化克隆,收集全部表达绿色荧光的克隆,提取RNA 并反转为cDNA,冻于−40℃。Real-time检测5种干扰载体的干扰效率。以β-actin 作为内参对照,以猪iPS 细胞中VHL 基因的表达量为1(control),反应在ABI 7500 Real Time PCR 仪上进行,按照TaKaRa 试剂盒说明书操作。
1.6 猪克隆胚胎的构建
筛选高效的干扰载体稳定转染猪胎儿成纤维细胞系,新霉素筛选2周后进行DNA 水平鉴定,阳性细胞作为核移植的供体细胞。普通成纤维细胞为阴性对照,用固定管吸住一个卵母细胞,在显微操作液(添加7.5µg/mL 细胞松弛素B 的普通操作液)中用注射针吸除第一极体及周围的部分胞质完成去核,并注入一个供体细胞于透明带下,使之与卵母细胞质膜紧密接触,在融合液中直流电击(1.2 kV/cm、30µs、2次脉冲)诱导体细胞与去核卵母细胞融合形成重构胚并使之被激活,然后进行胚胎培养。

表1 引物序列与扩增片段长度Table 1 Primers and amplified fragment length

表2 猪VHL 基因干扰片段Table 2 shRNA sequences of the pig VHL gene
核移植后48 h 和156 h 分别统计试验组和对照组胚胎的卵裂率、囊胚率及囊胚细胞数。Real-time PCR 检测囊胚中VHL 基因的表达水平。
2 结果与分析
2.1 猪VHL 基因的克隆及序列分析
猪VHL 基因序列全长为2725 bp,定位于13号染色体上,通过NCBI 网站(http://blast.ncbi.nlm.nih.gov/Blast.cgi),将VHL 克隆序列与预测序列进行Blast 比对,核苷酸序列相似性为100%。通过基因结构分析网站(http://genes.mit.edu/GENSCAN.html)分析发现,5'非编码区域为65 bp,3´非编码区域为2042 bp,编码区为618 bp,共编码205个氨基酸。猪VHL 基因与人和小鼠的VHL 基因的cDNA 编码区有较高的同源性,同源性分别为79.85%和71.36%,其蛋白与人和小鼠的 VHL 蛋白序列同源性分别为78.08%和76.10%(图2)。
为了阐述猪VHL 基因及其他物种的VHL 基因的分子进化关系,我们基于氨基酸序列利用MEGA 软件构建系统树。分析发现进化树可以分为灵长类、偶蹄类、啮齿类和节肢动物类。整个系统树的分析结果基本符合常规分类学。从分支上可以看出猪的VHL 基因更接近于人类(图3)。
2.2 猪VHL 基因在各组织中的表达分析
在出生2 d 的巴马猪中检测VHL 基因的表达情况(图4)。以β-actin 作为内参对照,相对于肝脏中VHL 基因的表达量,分析其余组织中VHL基因的表达情况,发现VHL 基因在肝脏、肾上腺、胰腺、心脏、睾丸中的表达量显著高于肾脏、大脑、脊髓、肠和肺等组织(P<0.01),而且在iPS 细胞(pm20)中VHL 基因的表达量也较高,与肝脏没有显著差异(P=0.4626)。

图2 VHL 序列同源性比对分析Fig.2 Multiple sequence alignment result of VHL protein.

图3 VHL 基因系统树分析Fig.3 Phylogenic tree analysis of VHL gene.
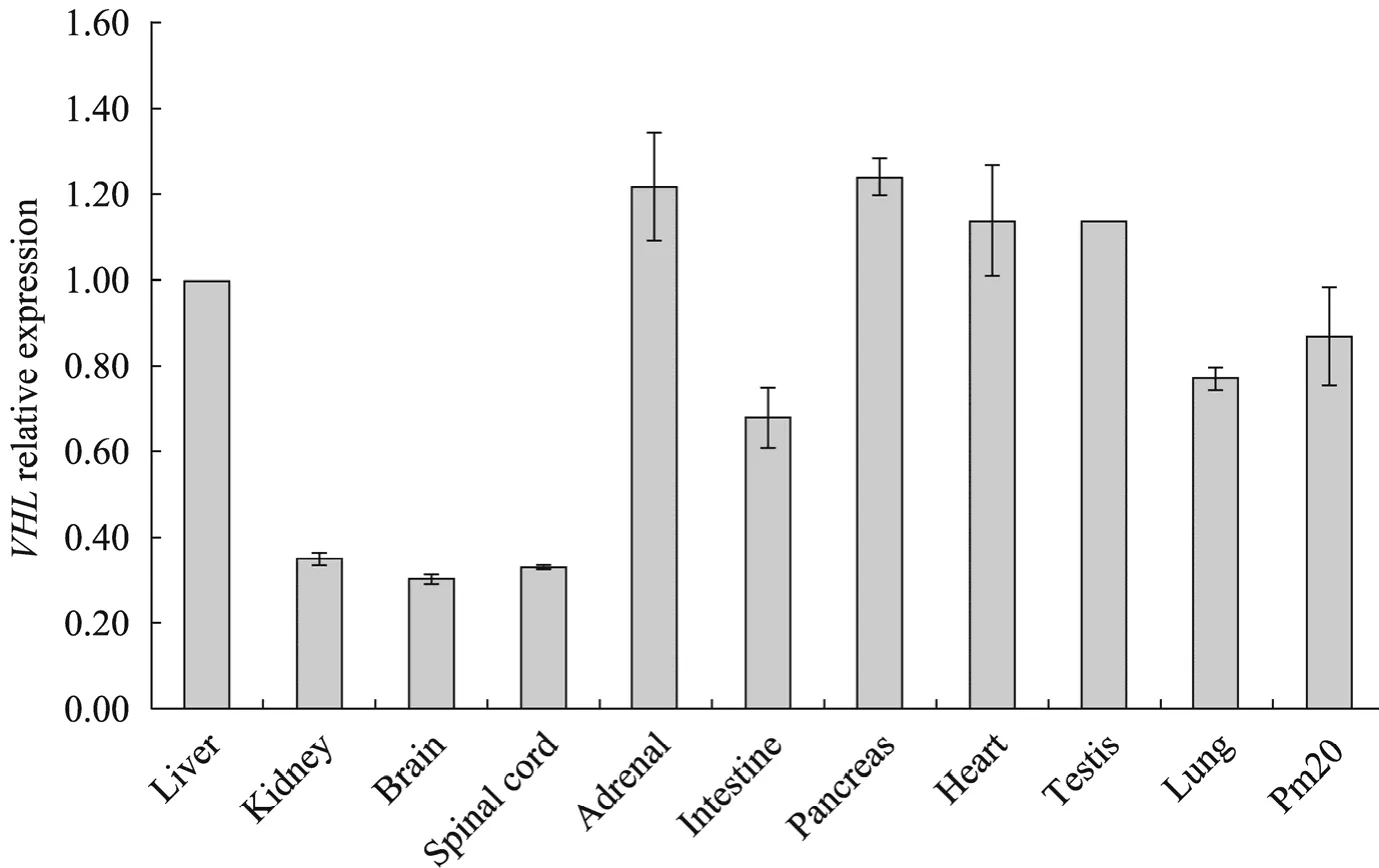
图4 猪不同组织中VHL 基因表达量的分析Fig.4 VHL expression in tissues of pig.
2.3 VHL 基因的干扰片段在猪iPS 细胞中的筛选
将pGenesil-1-pGenesil-5干扰载体稳定转染猪iPS 细胞筛选获得纯化的表达绿色荧光的克隆(图5A、B)。
Real-time PCR 检测干扰效率,结果表明,在pm20中,干扰片段sh1和sh2显著敲低了VHL基因的表达,分别降低了64%和72%(图5C,P<0.01),而sh3、sh4和sh5对VHL 基因的表达没有显著影响(图5C,P>0.05)。
2.4 VHL 基因的干扰对克隆胚胎发育的影响
将 sh1和 sh2两个干扰片段共同连接到pGenesil-1.0载体上,以电转的方式获得稳定转染猪胎儿成纤维细胞,作为核供体构建克隆胚胎,结果表明与对照组比较试验组在卵裂率、囊胚率和囊胚细胞数上没有明显差异(表3),进一步Real-time PCR 结果显示试验组克隆囊胚VHL基因表达量显著降低了71%(图6,P<0.01),表明所筛选的干扰片段可以有效地在胚胎中敲低猪VHL 基因。

图5 猪VHL 基因在iPS 细胞中的干扰克隆及其Real-time 检测干扰片段的干扰效率Fig.5 VHL RNAi in iPS of pig.(A) Sh1-Sh5 were observed in the light.(B) Sh1-Sh5 were observed in the fluorescence microscopic.(C) Screen of effective interference fragment by Real-time PCR.The interference efficiency of sh1 and sh2 fragment is about 64% and 72% respectively.*:P<0.01.
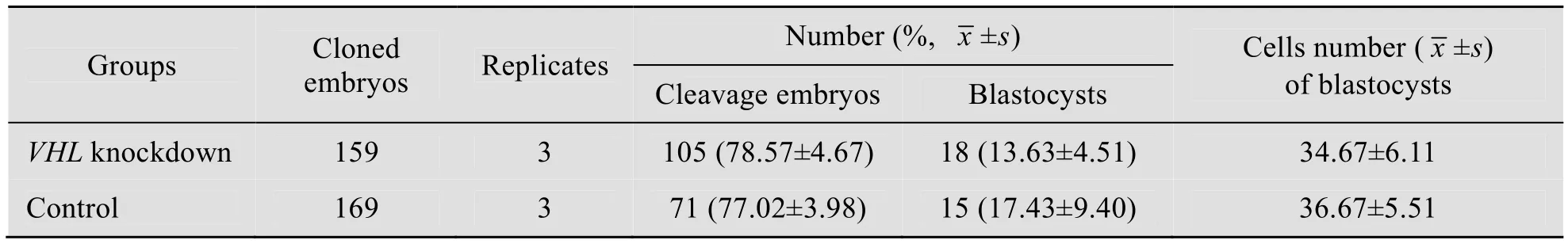
表3 核移植胚胎发育数据Table 3 Development of nuclear transfer embryos
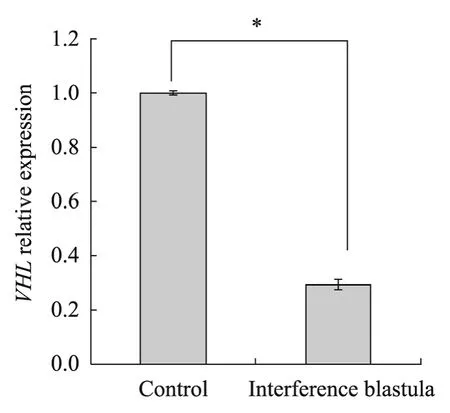
图6 Real-time PCR 检测VHL 在猪克隆胚胎中的敲低效率Fig.6 VHL expression level in knockdown blastocyst by Real-time PCR.The interference efficiency is about 71%.*:P<0.01.
3 讨论
我们克隆获得了猪VHL 基因mRNA 全长,通过对出生2 d 的仔猪组织中VHL 基因的表达情况分析,猪VHL 基因在肝脏、肾上腺、胰腺、心脏、睾丸中的表达量较高。根据克隆获得的序列信息设计了干扰片段,稳定转染猪iPS 细胞系筛选获得高效的干扰片段,并在猪克隆胚胎中成功敲低了VHL 基因,从而为后续获得VHL 猪疾病模型奠定基础。
猪VHL 基因定位于13号染色体上,mRNA全长2725 bp,共编码205个氨基酸。小鼠和人的VHL 基因蛋白序列同源性为76.10%,而猪和人的VHL 基因蛋白序列同源性为78.08%,而且第60~200氨基酸处仅有4个氨基酸的差异。说明VHL 基因在人和猪中同源性较高。文献报道人VHL 基因的103~124氨基酸编码的蛋白对肾细胞瘤的生长和浸染有抑制作用[22],而猪103~124氨基酸序列和人相同,从而预测猪VHL基因功能与人更相似。
VHL 基因缺失会使胚胎致死,因此基因敲低的方法是研究VHL 基因的功能及其构建疾病模型的思路之一。2006年,Hong 等利用四环素诱导重组酶Cre 转基因技术可以在特定时期失活VHL 基因,发育至E14.5 d 的小鼠胚胎VHL 基因失活后会引发组织器官大面积的损坏包括胚胎的血管缺陷和肝脏损坏等,发育至E15.0 d 的小鼠胚胎VHL 基因失活后卵黄囊的血液循环受阻[23-24]。在小鼠肾脏中特异性敲除VHL 基因会引发肾囊肿等疾病[25]。我们通过相对定量的方法检测到iPS细胞(pm20)中VHL基因的表达量也较高,这与文献中报道VHL 基因可与klf4[26]多能性因子相互作用吻合。所以我们选择猪ips 细胞为筛选有效干扰片段的细胞系,Real-time PCR检测干扰效率可高达72%。将稳定转染干扰载体的猪胎儿成纤维细胞作为核供体,核移植后检测囊胚中VHL 基因的表达量为对照组的29%。另外,VHL 基因敲低后胚胎的卵裂率和囊胚率与对照组相比并没有明显的差异,说明VHL 基因敲低并没有影响猪早期胚胎发育。我们获得了VHL基因敲低后的囊胚,验证了VHL 干扰片段在胚胎水平的有效性,从而为后续构建四环素诱导的VHL 基因敲低转基因猪及组织特异性VHL 基因敲低猪打下基础。
综上所述我们克隆了猪VHL 基因并且根据序列信息设计干扰片段,筛选出高效的干扰片段,并获得了猪VHL 基因高效干扰的细胞系和克隆胚胎,为后续构建疾病模型猪奠定了基础。
[1]Calzada MJ.Von Hippel-Lindau syndrome:molecular mechanisms of the disease.Clin Transl Oncol,2010,12:160−165.
[2]Lonser RR,Glenn GM,Walther M,et al.Von Hippel-Lindau disease.Lancet,2003,361:2059−2067.
[3]Richard S,David P,Marsot-Dupuch K,et al.Central nervous system hemangioblastomas,endolymphatic sac tumors,and von Hippel-Lindau disease.Neurosurg Rev,2000,23:1−24.
[4]Wanebo JE,Lonser RR,Glenn GM,et al.The natural history of hemangioblastomas of the central nervous system in patients with von Hippel-Lindau disease.J Neurosurg,2003,98:82−94.
[5]Maher ER,Neumann HP,Richard S.Von Hippel-Lindau disease:a clinical and scientific review.Eur J Hum Genet,2011,19:617−623.
[6]Kaelin WG Jr.Molecular basis of the VHL hereditary cancer syndrome.Nat Rev Cancer,2002,2(9):673−682.
[7]Hes FJ,Hoppener JW,Luijt RB,et al.Von Hippel-Lindau disease.Hered Cancer Clin Practice,2005,3(4):171−178.
[8]Ohh M,Yauch RL,Lonergan KM,et al.The von Hippel-Lindau tumor suppressor protein is required for proper assembly of an extracellular fibronectin matrix.Mol Cell,1998,1:959−968.
[9]Kurban G,Hudon V,Duplan E,et al.Characterization of a von Hippel Lindau pathway involved in extracellular matrix remodeling,cell Invasion and angiogenesis.Cancer Res,2006,66:1313−1319.
[10]Kuehn EW,Walz G,Benzing T.Von Hippel-Lindau:a tumor suppressor links microtubules to ciliogenesis and cancer development.Cancer Res,2007,67:4537−4540.
[11]Sinha S,Mondal G,Hwang EJ,et al.Von Hippel-Lindau gene product directs cytokinesis:a new tumor suppressor function.J Cell Sci,2011,124:2132−2142.
[12]William G,Kaelin Jr.The von Hippel-Lindau tumour suppressor protein:O2sensing and cancer.Nat Rev Cancer,2008,8:865−873.
[13]Barontini M,Dahia PL.VHL disease.Best Pract Res Clin Endocrinol Metab,2010,24:401−413.
[14]Kim WY,Kaelin WG.Role of VHL gene mutation in human cancer.J Clin Oncol,2004,22:4991−5004.
[15]Latif F,Tory K,Gnarra J,et al.Identification of the von Hippel-Lindau disease tumor suppressor gene.Science,1993,260:1317−1320.
[16]Gnarra JR,Ward JM,Porter FD,et al.Defective placental vasculogenesis causes embryonic lethality in VHL-deficient mice.Proc Natl Acad Sci USA,1997,94:9102−9107.
[17]Barry RE.Functional Analysis of the von Hippel-Lindau Tumour Suppressor and Its Role in Tumourigenesis.1st ed.Zürich:Eidgenössische Technische Hochschule Press,2004:91−94.
[18]Lunney JK.Advances in swine biomedical model genomics.Int J Biol Sci,2007,3(3):179−184.
[19]Aigner B,Renner S,Kessler B,et al.Transgenic pigs as models for translational biomedical research.J Mol Med (Berl),2010,88:653−664.
[20]Schook L,Beattie C,Beever J,et al.Swine in biomedical research:creating the building blocks of animal models.Anim Biotechnol,2005,16:183−190.
[21]Ibrahim Z,Busch J,Awwad M,et al.Selected physiologic compatibilities and incompatibilities between human and porcine organ systems.Xenotransplantation,2006,13:488−499.
[22]Datta K,Sundberg C,Karumanchi SA,et al.The 104-123 amino acid sequence of the beta-domain of von Hippel-Lindau gene product is sufficient to inhibit renal tumor growth and invasion.Cancer Res,2001,61:1768−1775.
[23]Haase VH.The VHL tumor suppressor in development and disease:functional studies in mice by conditional gene targeting.Semin Cell Dev Biol,2005,16:564−574.
[24]Hong SB,Furihata M,Baba M,et al.Vascular defects and liver damage by the acute inactivation of the VHL gene during mouse embryogenesis.Lab Invest,2006,86:664−675.
[25]Rankin EB,Tomaszewski JE,Haase VH.Renal cyst development in mice with conditional inactivation of the von Hippel-Lindau tumor suppressor.Cancer Res,2006,66:2576−2583.
[26]Gamper AM,Qiao X,Kim J,et al.Regulation of klf4 turnover reveals an unexpected tissue-specific role of pVHL in tumorigenesis.Molecular Cell,2012,45:233−243.
