高纯度(>99%)6-羟基犬尿喹啉酸的合成*
2013-06-29郑永胜连春霞袁伟成张晓梅
郑永胜,连春霞,袁伟成,张晓梅
(1.中国科学院成都有机化学研究所,四川成都 610041;2.中国科学院大学,北京 10039)
6-羟基犬尿喹啉酸(1)大量存在于银杏叶中,是广谱中枢神经氨基酸拮抗剂,它作用于N-甲基-D-天冬氨酸,能改善脑缺氧,近年来已引起国内外广泛重视。为了检测银杏叶提取物中1的准确含量,需要高纯度的标准样品作对照,因此合成高纯度的1具有重要意义。
本文在文献[1~6]方法的基础上,对 1的合成路线和1的纯化方法进行了改进,得到高纯(>99%)的1,可作为标准样品用于银杏叶提取物中1的含量检测。氨基苯酚(2)与丁炔二酸二甲酯(3)经迈克尔加成反应生成2-(4-羟基苯胺基)-富马酸二甲酯(4);4在伊顿试剂的作用下发生环化反应生成6-羟基犬尿喹啉酸甲酯(5);5经碱水解得到1,纯度93%(HPLC)。1与溴苄经衍生化制得4,6-二苄氧基喹啉-2-甲酸苄酯(6);6在Pd(OH)2/C催化下氢化脱苄基合成了1(Scheme 1),纯度>99%。
1 实验部分
1.1 仪器与试剂
Bruker-300型核磁共振仪(CDCl3为溶剂,TMS为内标);BioTOF Q型质谱仪;岛津 LC-10ATVP型液相色谱仪[色谱柱C18,检测波长:254 nm;流动相:V(水)∶V(甲醇)∶V(磷酸)=40 ∶60 ∶0.1,流速:0.5 mL·min-1]。
伊顿试剂,自制;DMF经无水硫酸镁干燥;其余所用试剂均为分析纯。
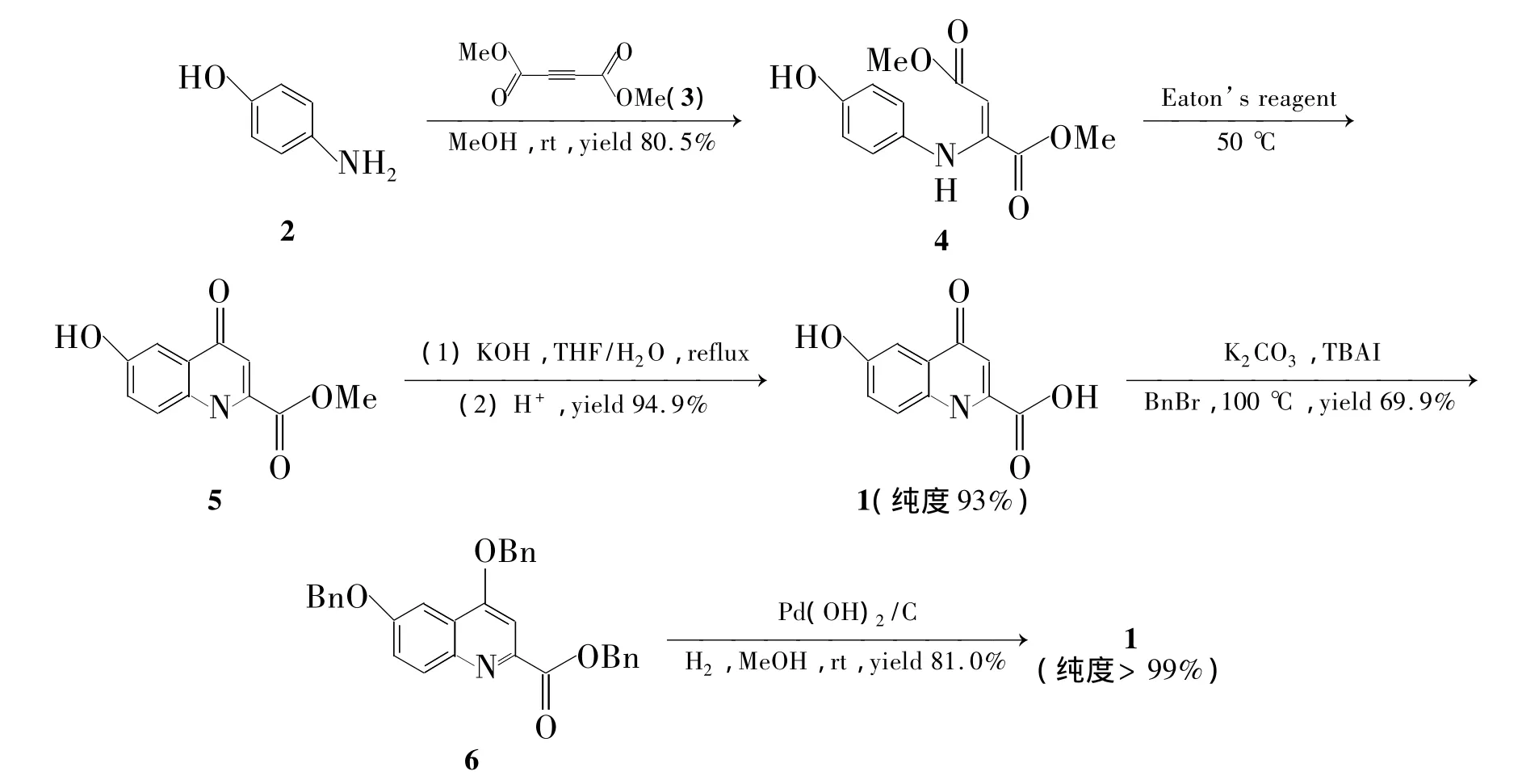
Scheme 1
1.2 合成
(1)4的合成
在单口瓶中加入2 41.8 g(383 mmol)和无水甲醇500 mL,搅拌下于室温缓慢滴加3 56.5 g(398 mmol)的甲醇(100 mL)溶液,滴毕,于50℃反应2 h。减压蒸馏除溶剂,残余物经硅胶柱层析[洗脱剂:V(石油醚)∶V(乙酸乙酯)=4∶1]纯化得黄色黏稠物(冷冻为黄色固体)4 77.1 g,收率80.5%;1H NMR δ:3.69(s,3H),3.71(s,3H),5.27(s,1H),6.44(brs,1H),6.70(d,J=8.6 Hz,2H),6.76(d,J=8.6 Hz,2H),9.46(s,1H)。
(2)5的合成
在反应瓶中加入4 88.2 g(351 mmol)和伊顿试剂618 mL,用惰性气体置换反应体系的空气,搅拌下于50℃反应6 h(体系变为黑色黏稠状)。倒入冰水中,用4 mol·L-1NaOH溶液调至 pH 10,于室温搅拌反应1 h。过滤,滤饼用冷水洗涤数次。合并滤液与洗液,用3 mol·L-1盐酸调至pH 2,析出大量灰白色絮状固体,过滤,滤饼用水洗涤数次,干燥得灰色固体5,不纯化,直接用于下步反应。
(3)1的合成
在反应瓶中依次加入5,水180 mL,THF 180 mL及NaOH 26 g,搅拌下回流反应10 h。过滤,滤液加入冰块,用3 mol·L-1盐酸缓慢调至 pH 2,析出大量灰白色絮状固体,过滤,滤饼用纯净水洗涤数次,干燥得灰色固体1 68.4 g,两步收率94.9%,纯度 93%。
(4)6的合成
在反应瓶中依次加入1 42.0 g(205 mmol),溴化苄 151.2 mL(1.273 mol),碳酸钾 184.8 g(1.337 mol),四丁基碘化铵(TBAI)7.56 g(20 mmol)及DMF 2 L,搅拌下于100℃反应18 h。倒入冰水中充分搅拌,析出固体,过滤,滤饼用水洗活,干燥后用混合溶剂[V(石油醚)∶V(乙酸乙酯)=4 ∶1]重结晶得白色固体 6 68.0 g,收率69.9%,纯度 >99%;1H NMR δ:5.19(s,2H),5.32(s,2H),5.52(s,2H),7.43(m,16H),7.58(s,1H),7.63(s,1H),8.16(d,J=9.2 Hz,1H)。
(5)1的合成
在单口烧瓶中加入 6 40.0 g(84 mmol),10%Pd(OH)2/C 8 g和无水甲醇4 L,用氮气置换反应体系的空气三次,搅拌下于室温反应过夜。减压蒸除大部分溶剂,残余物用NaOH溶液调至pH 10(固体全部溶解),用硅藻土过滤除去Pd(OH)2/C,滤饼用纯净水洗涤数次,合并滤液与洗液,用3 mol·L-1盐酸调至 pH 2,析出大量灰白色絮状沉淀,过滤,滤饼用纯净水洗涤数次,干燥得灰色固体 1 14.0 g,收率 81.0%,纯度>99%;1H NMR(DMSO-d6)δ:7.46(d,J=2.4 Hz,1H),7.53(d,J=2.4 Hz,1H),7.56(s,1H),7.90(brs,1H),8.18(d,J=9.2 Hz,1H),8.90(brs,1H),10.85(brs,1H);13C NMR(DMSO-d6)δ:104.5,105.3,122.9,123.9,126.9,134.0,140.3,157.5,161.9,170.3;HR-ESI-MSm/z:Calcd for C10H6NO4[M-H+]204.030 2,found 204.031 1。
2 结果与讨论
1的合成文献[1]方法是以4-甲氧基苯胺与3发生Michael加成反应生成2-(4-甲氧基苯胺基)-富马酸二甲酯(7);7经环化反应得6-甲氧基犬尿喹啉酸甲酯(8);8脱掉两个甲基得到1。但在重复该实验的过程中我们发现苯甲氧基上的甲基很难完全脱除。另外,1因溶解性很差,难以通过柱层析或重结晶的方法提纯,致使1的纯度达不到标准品要求。
为此,本文对文献[1]方法进行了改进,合成路线见Scheme 1,避免了脱苯甲氧基的甲基的难题。4在伊顿试剂的作用下发生环化反应生成5;5经过碱水解得到1,但 HPLC测定纯度只有93%。本文采取了衍生化方法,即1与溴苄反应得到6;由于6良好的溶解性能,重结晶后纯度达99%。高纯度的6在Pd(OH)2/C催化下进行氢化脱苄基合成了高纯度(99%)的1。衍生化方法将1的纯度从93%提高至99%。
另外,吡啶酮结构具有双亲核性,在对1进行苄基保护时,主要产物为氧烷基化产物,反应具有很好的选择性。主要原因可能一方面是在加热条件下反应倾向于生成共轭体系更大的更稳定产物,另一方面是由于氧原子的电负性强于氮原子。
6在氢化脱苄基保护基时,钯碳作催化剂不能催化该反应彻底进行,而采用氢氧化钯碳可以在室温常压下快速彻底脱除苄基保护基。
3 结论
通过工艺改进和衍生化法合成了高纯度(>99%)的6-羟基犬尿喹啉酸。其可作为标准品用于银杏叶提取物中1的含量检测。
[1]Akino K,Akaha H.The conversion of 5-hydroxykynurenine to 6-hydroxykynurenic acid and 6,4-dihydroxyquino line with liver homogenates[J].J Am Chem Soc,1954,76:6193-6194.
[2]Larina N A,Lokshin V,Berthet J,et al.Synthesis and photochromism of a series of new 2-unsubstituted 3-(2-benzylbenzoyl)quinolin-4(1H)-ones[J].Tetrahedron,2010,66:8291 -8299.
[3]Bradbury R H,Allott C P,Dennis M,et al.New nonpeptide angiotensin II receptor antagonists.2.Synthesis,biological properties,and structure-activity relationships of 2-alkyl-4-(biphenylylmethoxy)quinoline derivatives[J].J Med Chem,1992,35:4027 -4038.
[4]Crespo M I,Gràcia J,Puig C,et al.Synthesis and biological evaluation of 2,5-dihydropyrazolo[4,3-c]quinolin-3-ones,a novel series of PDE 4 inhibitors with low emetic potential and antiasthmatic properties[J].Bioorg Med Chem Lett,2000,10:2661 -2664.
[5]Manera C,Benetti V,Castelli M P,et al.Design,synthesis,and biological evaluation of new 1,8-naphthyridin-4(1H)-on-3-carboxamide and quinolin-4(1H)-on-3-carboxamide derivatives as CB2 selective agonists[J].J Med Chem,2006,49:5947 -5957.
[6]Stern E,Muccioli G G,Bosier B,et al.Pharmacomodulations around the 4-oxo-1,4-dihydroquinoline-3-carboxamides,a class of potent CB2-selective cannabinoid receptor ligands:Consequences in receptor affinity and functionality[J].J Med Chem,2007,50:5471 -5484.
