再生水中亚硝酸盐对余氯衰减的影响及其控制
2013-06-24周广宇赵新华单金林
周广宇,赵新华,张 蕾,单金林
(天津大学环境科学与工程学院,天津 300072)
再生水中亚硝酸盐对余氯衰减的影响及其控制
周广宇,赵新华,张 蕾,单金林
(天津大学环境科学与工程学院,天津 300072)
根据华北地区某再生水厂的实际水质特点,通过实验比较了加氯消毒后水中TOC、2NO-对余氯消耗的影响;使用平行一级反应模型分析实验结果,发现折点氯化后亚硝酸盐耗氯反应的速率常数显著高于有机物耗氯反应,亚硝酸盐成为再生水中重要耗氯物质.为稳定再生水中余氯浓度,提出了2个方案:再生水中加氨或调节pH值,分别进行了模型拟合和实验效果分析.通过对比加氨和调pH值方案的余氯成分和所需药剂投量,得出调节水体至弱碱性(pH值为8.3)是更好的途径.本研究对再生水厂消毒工艺的设计、运行具有一定的借鉴意义,对保证再生水水质安全具有较高的实用价值.
再生水;余氯;亚硝酸盐;pH值
污水再生利用是解决我国目前水资源紧缺的重要途径,其关键问题是水质安全保障[1].再生水消毒工艺为污水再生利用中必不可少的环节,液氯以其强大的杀菌力、低廉的价格和很长的持续消毒时间,成为再生水厂最常用的消毒剂,国内外的各项再生水水质标准一般也以余氯作为消毒工艺控制指标[2-3];而如何使加氯消毒后水中余氯浓度在足够长时间内保持在标准限值以上,则成为再生水厂运行中普遍关注的问题.
为了保证水厂出水余氯浓度,有必要对水体中余氯衰减原因进行研究.在这一领域,已经有大量文献将水中有机物作为耗氯物质进行了长期深入的研究报道.然而,Vikesland等[4]的研究指出,饮用水氯化消毒时,水中还原性无机阴离子会通过一系列的歧化反应消耗水中余氯,而且上述反应的速率常数通常很高;Duirk等[5]则发现,水中还原性无机阴离子产生的氯消耗,占水体氯化消毒过程中余氯总衰减量的比例较高,且这一比例会随着水体pH值的降低而继续升高.再生水由污水处理而来,所含无机和有机物质的浓度和种类往往更高(相对于天然水体)[1,3],但目前再生水中还原性无机离子对余氯衰减影响的研究还鲜有报道.
本研究针对华北地区某再生水厂实际水质特点,比较分析了水体中亚硝酸根离子和有机物对再生水消毒效果的影响,并根据对比结果提出了保证再生水中余氯浓度的方案,以期为水厂消毒工艺的合理运行提供依据.
1 材料与方法
1.1 实验水样
本研究的实验水样取自再生水厂清水池入口,其水质检测数据显示,水中阴离子主要包括硫酸根离子、氯离子、硝酸根离子和亚硝酸根离子;而文献调研结果显示:上述阴离子中,只发现余氯与亚硝酸根离子会发生化学反应[4],所以本文中的还原性无机阴离子研究对象设定为亚硝酸根离子.
通过在清水池前多次采样并进行化验,选择具有代表性的3组水样进行实验,其主要水质信息如表1所示.

表1 原水样水质Tab.1 Water quality of initial water samples
1.2 实验药剂和检测方法
实验中通过投加NH4Cl贮备液和NaNO2贮备液改变水样氨氮和亚硝酸盐氮浓度,使用磷酸盐贮备液调节实验水样pH值[6],消毒剂采用蒸馏水稀释的分析纯次氯酸钠溶液,加氯量为8,mg/L(该厂采用液氯消毒、试运行期间根据水量水质状况投氯量为8,mg/L).
实验中水样容器均为1,L棕色窄口玻璃瓶(棕瓶),为保证实验所用棕瓶不消耗有效氯,在实验前使用有效氯含量20,mg/L溶液注满棕瓶,密闭静置24,h,之后用蒸馏水洗净棕瓶并静置晾干.实验时各棕瓶皆密闭置于20,℃恒温箱中.
水中总余氯采用HACH DR890余氯仪测定,使用前经过DPD/FAS滴定法[6]校核;氨氮测定采用纳氏试剂比色法[6];pH采用Sartorius PB-10酸度计测定;TOC采用岛津TOC-ⅤCPH分析仪测定;亚硝酸盐氮浓度则先用戴安DX600离子色谱仪测定亚硝酸根离子浓度,再核算成亚硝酸盐氮浓度.
1.3 模型拟合
采用平行一级反应模型,即
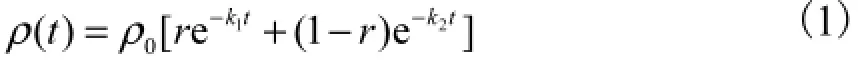
式中:ρ(t)为任意时刻t的氯浓度;ρ0为反应初始时刻的氯浓度;r为与亚硝酸盐反应的氯在总投氯量中的比例,本研究中,假定亚硝酸盐和有机物消耗余氯是2个平行反应;k1、k2分别为亚硝酸盐、有机物与余氯反应的速率常数.
用式(1)拟合水样检测数据,拟合结果将用来比较各平行反应对余氯的消耗.
根据文献[7-8]的研究结果,分别计算游离氯、结合氯(一氯胺)与亚硝酸盐在不同条件下反应的速率常数范围,然后进行模型拟合.
2 结果与讨论
2.1 亚硝酸盐和有机物消耗氯的比较
将水样S1、S2和S3的pH值调节至6.8后,向各水样中迅速投加氯并即刻开始检测余氯浓度变化(由于试运行期间水厂产水量尚未达到设计值,消毒接触时间一般不低于10,h,所以本文中各组实验皆检测了较长时间内水样余氯浓度的变化),实验后采用式(1)进行数据拟合,结果如表2所示,其中R2为拟合结果的“判定系数”,可以用来判定模型拟合结果的优劣.该值在0~1之间,越大说明拟合得越好.

表2 模型拟合后的参数结果Tab.2 Parameter values after model fitting
由表2可见,各水样中亚硝酸盐的耗氯反应速率常数都明显高于有机物耗氯反应速率常数.同时,水样S1、S2、S3中与亚硝酸盐反应的氯分别占总量的78%、44%、70%,这就导致亚硝酸盐比有机物明显消耗更多氯.
图1所示为亚硝酸盐和有机物消耗余氯的比较.可以看出,随着氯化接触时间的延长,水样S1、S2、S3曲线都出现了快速而明显的下降,即各水样中的余氯消耗都较快.还可以注意到,在水样S1、S3中,2NO-消耗了水中绝大部分氯;水样S2中,虽然由于水样中2NO-N质量质量浓度较低而使其耗氯比例有所降低,但2NO-仍是重要的耗氯物质.
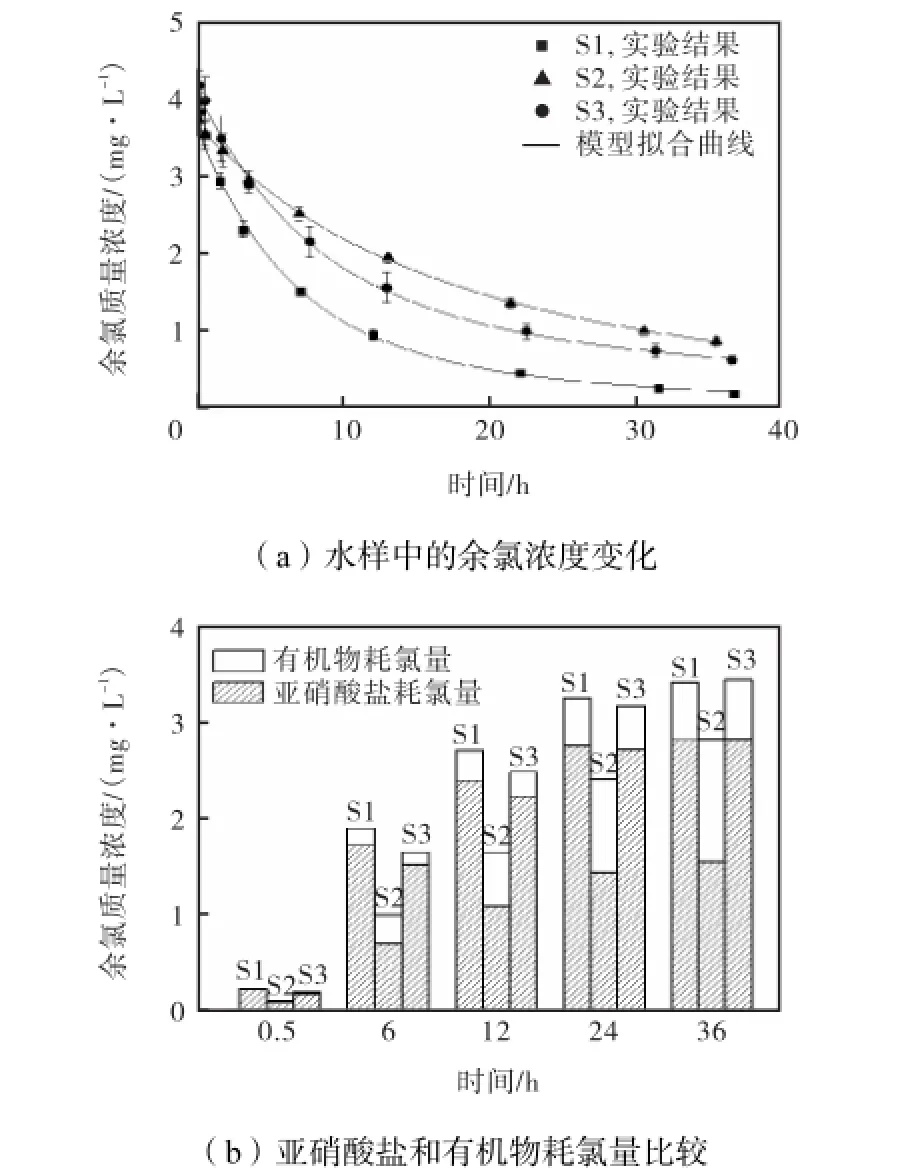
图1 亚硝酸盐和有机物消耗余氯的比较Fig.1 Comparison of chlorine consumed by nitrite and organic matter
水厂监测数据显示,清水池进水NO2-N质量浓度在2.4~5.2,mg/L之间波动,TOC浓度在7~18,mg/L之间变化,那么根据实验水样水质、图1中的实验和模型拟合结果,该厂清水池进水中所含的可能对其实际氯化消毒工艺有着明显影响.
根据前述实验结果,选择并比较了2个控制再生水体余氯衰减的方案,以期在较长时间内保证消毒后再生水中的余氯浓度.
2.2 加氨对余氯衰减的影响
在水处理工程中,为了保证水体氯化消毒后余氯的浓度(以控制细菌的重新滋生),可以向水体中适量加氨,使游离氯转化为结合氯,从而控制消毒后水体余氯的衰减.这一方法在提高消毒工艺出水余氯浓度的同时,又可有效控制消毒副产物的生成,在消毒工艺中已有较多应用[9-10].本研究即首先选择在水样中加氨的方式,研究其对提高再生水(氯化消毒后)余氯浓度的效果.
根据城市污水再生利用国家标准GB/T 18920—2002中对氨氮浓度的控制要求(冲厕、道路清扫、消防、车辆冲洗用水中的质量浓度小于等于10,mg/L;城市绿化、建筑施工用水中的质量浓度小于等于20,mg/L),将水样调至氨氮质量浓度为4.3,mg/L,pH= 6.8进行实验和模型分析,结果如图2所示.

图2 加氨对余氯衰减的影响Fig.2 Effects of ammonia addition on chlorine decay
将水样S1、S2、S3在图2中的余氯衰减曲线与图1中的进行对比,可以看出:当氨氮质量浓度升至4.3,mg/L后,水中余氯衰减速度明显降低,各组水样在投氯接触10,h后余氯质量浓度仍高于4,mg/L,此时即使再生水厂的出水经较长时间(如25,h)后才到达用户点,加氨法也可有效保证再生水中总余氯浓度和管网末梢处的用水水质安全.
在2.1节实验中,水样氨氮质量浓度皆低于1.0,mg/L,在指定加氯量下(8,mg/L)将发生折点氯化反应,余氯将主要以游离态(HOCl)存在[11],亚硝酸盐成为水样中的主要耗氯物质;在2.2节中,水样氨氮浓度较高,余氯几乎都以一氯胺形式存在[12],观察表3的参数估计结果可以发现,一氯胺与亚硝酸盐的反应速率常数很低,与亚硝酸盐反应的氯的比例也明显降低,水样中亚硝酸盐耗氯量几乎为0(如图2(b)所示).

表3 加氨后模型拟合结果Tab.3 Model results of ammonia addition experiments
加氨至氨氮质量浓度为4.3,mg/L后,水样中余氯的衰减主要取决于其中的有机物浓度,水样S1中有机物浓度约为S3的2倍,S1的耗氯反应速率常数及耗氯量也同样接近S3的2倍,有机物成为各水样中最主要的耗氯物质.
2.3 调节pH值对余氯衰减的影响
许多研究指出,水中不同形态的氯与无机离子反应的速率常数有着较大差异[4,7-8,13],而水体pH值则影响着水中氯的形态[14].所以,本文实验比较了不同pH值下各水样中余氯衰减的变化,以期为在较长时间内稳定再生水中余氯浓度再寻一种解决方法.
根据城市污水再生利用国家标准GB/T 18920—2002中对水体pH值的控制要求(pH=6.0~9.0),取水样(包括S1、S2和S3)在pH=6.8、7.7、8.3下进行氯化实验.发现调节pH至8.3,对各水样余氯衰减的控制最明显.pH=8.3时各水样的实验和模拟结果如图3所示.
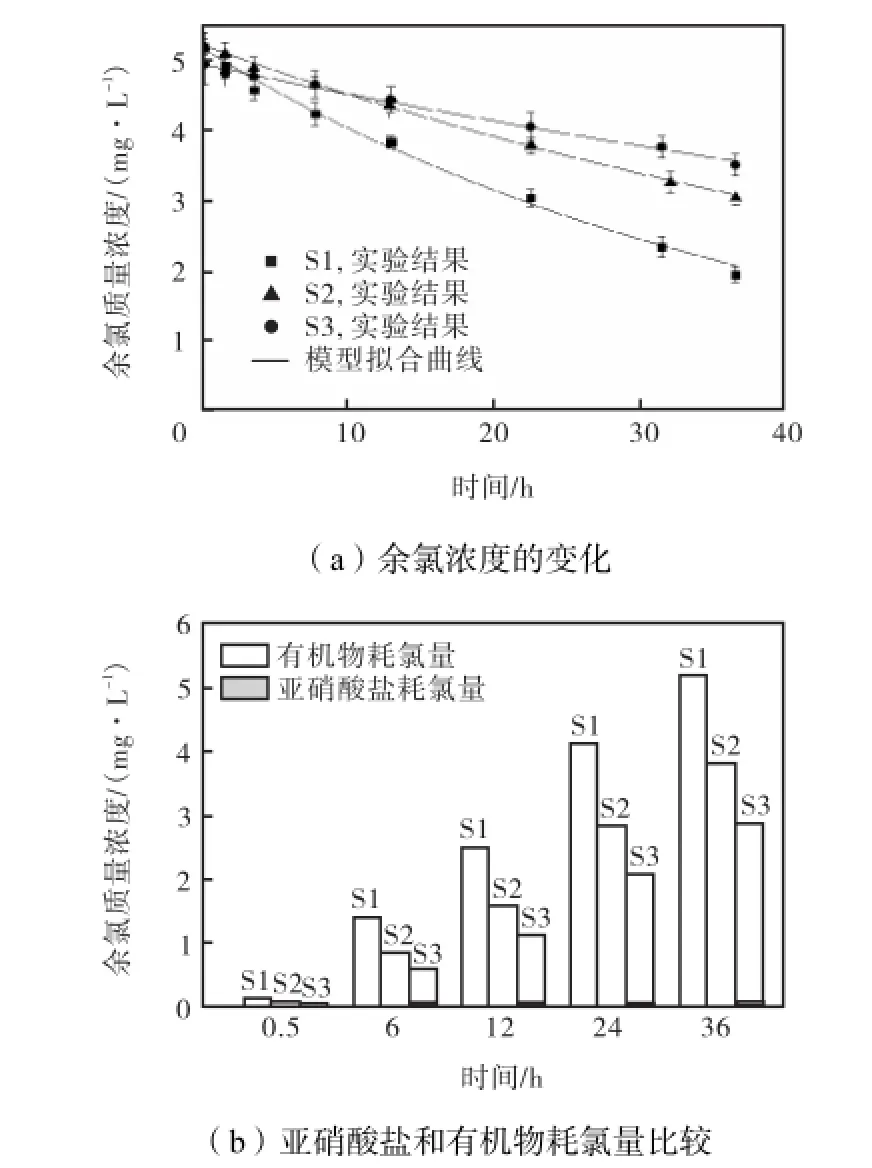
图3 调节pH值至8.3时对余氯衰减的影响Fig.3 Effects of adjusting pH to 8.3 on chlorine decay
观察并比较水样pH=6.8(见图1)和pH= 8.3(见图3)时的实验结果可以看出,当各组水样pH值由6.8增至8.3后,水中余氯衰减速率皆出现显著降低:投氯10,h后,各水样的余氯质量浓度由1.0~2.5,mg/L增至4,mg/L以上;接触35,h后,各水样的余氯仍高于1.5,mg/L.即实际生产中,调节再生水至弱碱性(pH=8.3),不仅出厂时(以接触10,h计)水中余氯质量浓度可以得到保证,而且较长时间后(如35,h后),再生水中余氯质量浓度仍然较高,再生水的水质安全性得到较大提升.
同时,水样pH值增加后,S1、S2、S3中亚硝酸盐、有机物耗氯关系也发生明显变化:亚硝酸盐耗氯量变得很低,有机物成为水样中的主要耗氯物质.这是因为在2.3节所示实验中,各水样加氯后会发生折点氯化反应,水中余氯主要以游离态存在[11],此时水体中余氯主要包括次氯酸根离子ClO-和次氯酸分子HClO.根据次氯酸的解离平衡[14](Ka为酸度系数)
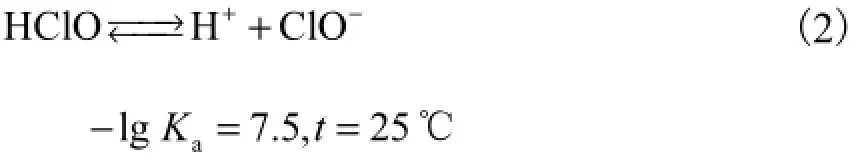
显然,水体pH会对游离氯的成分产生明显影响.而Lahoutifard等[7]的研究指出,水相中与ClO-反应的速率常数远低于其与HClO反应的速率常数,这意味着折点氯化后HClO在余氯(此时包括ClO-和HClO)中所占的比例将是影响氯衰减的重要因素.根据模型拟合结果(见表4),调节pH值至8.3时,亚硝酸盐耗氯反应的速率常数不但远低于其在表2中的数值,且同样明显低于pH=8.3时有机物耗氯反应的速率常数.所以当pH升高、水样中HClO所占比例降低时,对余氯的消耗量就出现了显著下降,有机物成为了各水样中的主要耗氯物质.此时,有机物浓度决定了各水样的余氯衰减曲线形态以及耗氯量.

表4 水样调至弱碱性后模型拟合结果Tab.4 Model results when water samples were alkalescent
2.4 加氨与调节pH值方法的比较
2.4.1 余氯成分比较
有研究指出:当pH≥6.5时,水体中氯胺80%以上的成分是一氯胺(NH2Cl)[15],所以本文在研究加氨后实验水样中的余氯成分时,通过HClO与NH2Cl之间的反应平衡关系(见式(3)[12],k1=2.63×106L/ (mol·h),t=25℃[16];,t=25℃)进行分析.
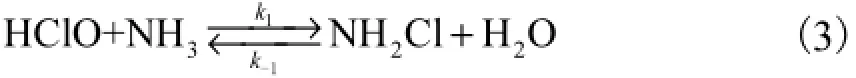
根据上述反应平衡关系,可有

式中:ρNH3、ρHClO、ρNH2Cl分别为反应平衡时NH3、HClO和NH2Cl的质量浓度,mg/L;MNH3、MHClO、MNH2Cl分别为NH3、HClO和NH2Cl的摩尔质量,g/mol.可以算得.根据这一结果,若加氨至氨氮质量浓度为4.3,mg/L时,投氯后水样中2NHCl浓度都将远高于HClO浓度,水中余氯几乎全以氯胺形式存在.
在2.3节中,如果以水中HClO浓度为ρ1、ClO-浓度为ρ2,当pH=8.3时(H+的浓度为10-8.3mol/L),根据HClO解离平衡方程,有,可以算得,即水中HClO所占余氯比例约为14%.根据图3所示实验结果,以接触消毒10,h后水样S1、S2、S3余氯质量浓度高于4,mg/L计,则HClO质量浓度高于0.56,mg/L;以接触消毒35,h后余氯质量浓度高于1.5,mg/L计,则HClO质量浓度高于0.21,mg/L.可以看出,调整水体pH至弱碱性后,HClO在余氯中的含量较高、浓度较高.据此,可以继续进行生产性实验,以合理降低加氯量.
2.4.2 药剂投量比较
如果用质量分数28%的工业用氨水作为加氨法所用药剂,根据水厂清水池进水的氨氮浓度变化情况(7月—10月水体氨氮浓度很低,低于1,mg/L;1月—6月、11月和12月份水体氨氮浓度较高),在每年7月—10月(以每月30,d计)将水体氨氮质量浓度从1,mg/L调至4.3,mg/L,则每年需要氨水
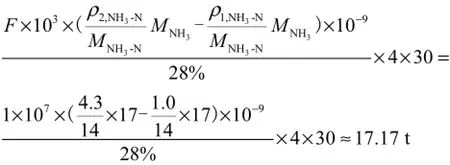
式中:F为水厂日产水量,F=1×104,m3/d;ρ2,NH3-N为水体目标氨氮质量浓度,ρ2,NH3-N=4.3,mg/L;ρ1,NH3-N为水体当前氨氮浓度,ρ1,NH3-N=1.0,mg/L;MNH3为NH3摩尔质量,MNH3=17,g/mol;MNH3-N为NH3-N摩尔质量,MNH3-N=14,g/mol.
水厂清水池进水pH值一年中普遍低于7.0,即需要全年调节氯化前水体pH值.以年内清水池进水pH均值6.8作为起点,采用水厂调节pH值的常用药剂(质量分数99%的工业级烧碱)将水体pH值调至8.3,则每年(以365,d计)需要烧碱
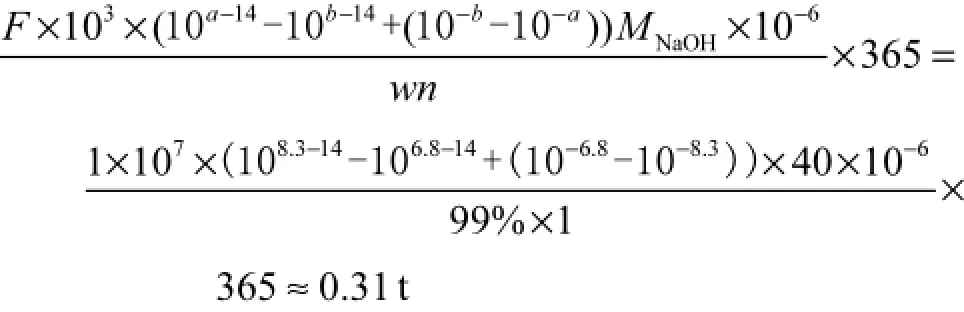
式中:a为水体目标pH值,a=8.3;b为水体pH年均值,b=6.8;MNaOH为NaOH摩尔质量,MNaOH= 40,g/mol;w为烧碱中NaOH质量分数,w=99%;n为NaOH溶于水产生的OH-离子,mol/mol.
显然,理论计算中调节水体至弱碱性所需药剂量远低于水中加氨所需氨水量.在水厂实际生产中,由于再生水中某些离子对pH值改变的缓冲作用,实际加碱量可能会更高;水厂在运行时也可能会适当降低加氨量.但理论计算中(加氨至4.3,mg/L与调节pH至8.3)巨大的药剂投量差值,意味着实际生产中调节pH所需药剂量可能仍然较少.同时,市场实际调研结果显示,质量分数28%的工业级氨水约900~1,400元/吨、99%的工业级烧碱约3,000元/吨,根据药剂投量核算,采用调节水体pH的方法同样更加经济.
有研究表明,在管网配水过程中,低pH值会增加管网水中氧化剂浓度、加快管道腐蚀速度;而水体弱碱性则有利于金属管材表面钝化膜的形成,可以起到降低腐蚀速度、保护管道的作用[17-18].说明调节水体至弱碱性对再生水输配管道的防腐也是有利的.
综合2.4.1节和2.4.2节的比较结果,再生水厂调节清水池进水至弱碱性,有助于在较长时间内保证水中余氯浓度,提高了出水余氯中HOCl含量,所需药剂投量少经济性较明显,对再生水输配管网防腐也有着积极作用.所以,调节水体pH值至弱碱性来稳定再生水厂出水余氯浓度的方案相对更优.
3 结 论
(1) 实验和模型结果证明,折点氯化后的水样中,亚硝酸盐是影响余氯量的主要因素,其耗氯量明显高于有机物耗氯量.
(2) 实验证明,加氨至3NH-N质量浓度为4.3,mg/L和调节水体pH值至弱碱性(pH=8.3)都可在较长时间内保证再生水中余氯浓度.
(3) 与加氨法相比,调节水体pH值至弱碱性后,余氯中的HOCl成分更高,药剂投量更少更经济,对管道防腐也有积极意义,再生水厂可以优先考虑.
[1] 李大鹏. 城市水社会循环中的水质安全保障[J]. 环境科学学报,2009,29(1):50-53.
Li Dapeng. Water quality security ensuring during social cycle of urban water[J]. Acta Scientiae Circumstantiae,2009,29(1):50-53(in Chinese).
[2] 国家标准化管理委员会.GB/T 18920—2002 城市污水再生利用:城市杂用水水质[S]. 北京:中国标准出版社,2003.
Standardization Administration of the People′s Republic of China. GB/T 18920—2002 Reuse of Recycling Water for Urban:Water Quality Standard for Urban Miscellaneous Water Consumption[S]. Beijing:China Biaozhun Publishing House,2003(in Chinese).
[3] 美国环保局. 污水再生利用指南[M]. 胡洪营,魏东斌,王丽莎,等译. 北京:化学工业出版社,2008.
USEPA. Guidelines for Water Reuse[M]. Hu Hongying,Wei Dongbin,Wang Lisha,et al,Trans. Beijing:Chemical Industry Publisher,2008(in Chinese).
[4] Vikesland P J,Ozekin K,Valentine R L. Monochloramine decay in model and distribution system waters[J]. Water Research,2001,35(7):1766-1776.
[5] Duirk S E,Gombert B,Croué J,et al. Modeling monochloramine loss in the presence of natural organic matter[J]. Water Research,2005,39(14):3418-3431.
[6] 国家环境保护总局. 水与废水分析检测方法[M]. 4版.北京:中国环境科学出版社,2002.
National Environmental Protection Agency. Water and Wastewater Examination Standard Methods[M]. 4th ed. Beijing:China Environmental Science Press,2002(in Chinese).
[7] Lahoutifard N,Lagrange P,Lagrange J. Kinetics and mechanism of nitrite oxidation by hypochlorous acid in the aqueous phase[J]. Chemosphere,2003,50(10):1349-1357.
[8] Margerum D W,Schurter L M,Hobson J,et al. Water chlorination chemistry:Nonmetal redox kinetics of chloramine and nitrite ion[J]. Environmental Science and Technology,1994,28(2):331-337.
[9] 刘 静,陈 超,张晓健,等. 两点短时游离氯后转氯胺的顺序氯化消毒工艺研究[J]. 环境科学,2008,29(12):3365-3371.
Liu Jing,Chen Chao,Zhang Xiaojian,et al. Use of two-points-short-term free chlorine plus chloramines disinfection process in conventional treatments of water supply[J]. Environmental Science,2008,29(12):3365-3371(in Chinese).
[10] 刘 静,陈 超,张晓健. 组合氯化消毒工艺的卤代消毒副产物生成特性[J]. 环境科学,2009,30(9):2538-2542.
Liu Jing,Chen Chao,Zhang Xiaojian. Disinfection byproducts reduction of combined disinfection by chlorine and monochloramines in distribution system[J]. Environmental Science,2009,30(9):2538-2542(in Chinese).
[11] Pressley T A,Bishop D F,Roan S G. Ammonianitrogen removal by breakpoint chlorination[J]. Environmental Science and Technology,1972,6(7):622-628.
[12] Morris J C,Isaac R A. A critical review of kinetic and thermodynamic constants for the aqueous chlorineammonia system[C]//Water Chlorination:Environmental Impact and Health Effects. Ann Arbor,USA,1983.
[13] Deborde M,von Gunten Urs. Reactions of chlorine with inorganic and organic compounds during water treatment-Kinetics and mechanisms:A critical review[J]. Water Research,2008,42(1/2):13-51.
[14] Snoeyink V L,Jenkins D. Water Chemistry[M]. New York:John Wiley,1980.
[15] Palin A. A study of the chloro derivatives of ammonia[J]. Water and Water Engineering,1950,54:248-258.
[16] Qiang Z,Adams C D. Determination of monochloramine formation rate constants with stopped-flow spectrophotometry[J]. Environmental Science and Technology,2004,38(5):1435-1444.
[17] 赵洪宾. 给水管网系统与分析[M]. 北京:中国建筑工业出版社,2003:4-34.
Zhao Hongbin. Drinking Water Network System and Analysis[M]. Beijing:China Architecture and Building Press,2003:4-34(in Chinese).
[18] 田一梅,刘 扬,赵 鹏,等. 海水淡化水在既有管网输配的铁释放控制研究[J]. 环境科学,2012,33(4):1216-1220.
Tian Yimei,Liu Yang,Zhao Peng,et al. Research on controlling iron release of desalted water transmitted in existing water distribution system[J]. Environmental Science,2012,33(4):1216-1220(in Chinese).
Influence and Resolution of Nitrite-Leaded Chlorine Decay in Reclaimed Water
Zhou Guangyu,Zhao Xinhua,Zhang Lei,Shan Jinlin
(School of Environmental Science and Engineering,Tianjin University,Tianjin 300072,China)
Based on the water samples collected from a reclaimed water treatment plant (RWTP) in North China, the effect of nitrite and TOC on chlorine decay was investigated and a parallel first-order decay model was used to simulate the experimental data. The result indicated that the reaction constant between nitrite and chlorine was higher than that between organic matter and chlorine; and nitrite consumed much more chlorine than organic matter after breakpoint chlorination. In order to stabilize the chlorine concentration in reclaimed water, two methods were proposedto restrain nitrite-leaded chlorine decay: adding ammonia and adjusting water to be alkaline before chlorination, each of which was tested by experiments and simulated with parallel first-order decay models. It is proven that the two methods were both effective in stabilizing residual chlorine concentration. And then the residual-chlorine composition and chemical dosage of the two proposed methods were compared, and the result showed that adjusting water to be alkalescent (pH=8.3) was better than ammonia addition, and thus the former method was recommended to be applied in the plant.
reclaimed water;residual chlorine;nitrite;pH value
X703.1
A
0493-2137(2013)05-0423-06
DOI 10.11784/tdxb20130507
2012-04-19;
2012-06-18.
国家自然科学基金资助项目(51178303);国家水体污染控制与治理科技重大专项资助项目(2009ZX07317-005-01).
周广宇(1986— ),男,博士研究生,zgy_1204@163.com.
张 蕾,zhanglei@tju.edu.cn.
