肝功能状态对晚期肝癌介入治疗生存期的影响
2013-06-23刘纪营金洁管生马南李明省胡小波陈振刘朝王子博
刘纪营,金洁,管生,马南,李明省,胡小波,陈振,刘朝,王子博
目前,肝动脉化疗栓塞术(TACE)被认为是不可切除肝癌的标准治疗方法之一[1],但是,用于进展期肝细胞癌(BCLC-C)的治疗,看法不一。TACE有潜在的导致部分患者肝功能不全的可能,最终难以延长该期患者整体生存期,因此未能被美国肝病协会推荐用于肝癌BCLC-C的治疗,但有报道显示,与最好的保守治疗相比,即使肝细胞癌出现肝外转移或血管侵犯,TACE亦能够使部分患者获益[2-5]。因此,为了使BCLC-C患者从TACE治疗中获益,TACE与其他治疗后生存期的调查和对比研究就有重要临床意义。
1 材料与方法
1.1 临床资料
回顾性分析我科2009年1月至2010年6月,经临床诊断BCLC-C并行TACE治疗的患者74例。其中男59例,女15例。年龄20~74岁,平均<56岁。术前Child-Pugh A级62例(平均TACE治疗2.1次),Child-Pugh B级12例(平均TACE治疗1.2次)。Child-Pugh A级中12例曾接受TACE、2例接受过外科治疗。Child-Pugh B级中2例接受过TACE、1例接受过外科治疗。两组患者临床特征对比见表1。生存期定义为从确诊肝癌晚期,并行TACE治疗开始至患者死亡。入组患者同时满足以下条件:①BCLC-C;②Child-Pugh A或B级;③血小板计数>60×109/L;④无活动性感染。有以下任何一项均予排除:①凝血功能下降严重且不能纠正。②门脉血流为离肝血流或者门静脉闭塞且无充分的侧支代偿。③广泛转移,预期生存期不能延长。④肿瘤体积超过肝脏体积的70%。⑤同时合并其他恶性肿瘤。术前常规查转氨酶、血清胆红素、PT、AFP、吲哚菁绿15 min滞留率(ICG-R15),以及增强CT或增强MRI。肝癌TACE后肝功能衰竭定义为TACE后2周Child-Pugh评分上升≥2,血清胆红素上升≥34μmol/L,并新近形成腹水,或出现肝性脑病[6]。

表1 不同Child-Pugh肝功患者临床特点对比一览表
1.2 方法
1.2.1 TACE根据增强CT和MRI及术中DSA造影,明确肿瘤所有供血血管,分别超选择栓塞。术中用药按照吡柔比星、顺铂、丝裂霉素和超液化碘化油40 mg∶40 mg∶4 mg∶20 ml比例混合,制成混悬液,然后把混悬液缓慢注入肿瘤供血血管。依据肿瘤的大小、数目,血管状态及肝功能储备情况,追加碘化油(术中最大剂量不超过30 ml)、栓塞颗粒或明胶海绵,直至肿瘤供血动脉血流中断。术中,首先处理明显的动静脉瘘,然后进行化疗栓塞,或者把微导管超选择至动静脉瘘远端先化疗栓塞,最后行动静脉瘘治疗。
1.2.2 随访所有患者TACE后,均进行了随访。全部患者均在TACE术后每1~2个月检查肝功能、PT、AFP、增强CT或MRI。根据患者AFP变化、肝功能储备及病灶残存及复发情况,决定是否再次TACE治疗。Child-Pugh A级组平均TACE治疗2.1次,Child-Pugh B级平均TACE治疗1.2次。随访至患者死亡或截止至末次随访日期2012年8月。
1.3 统计分析
Child-Pugh A和B两组临床特点应用均值±标准差表示。两组参数差异性用χ2检验。Kaplan-Meier计算生存曲线。P<0.05认为有统计学差异。采用SPSS17版本统计软件处理所有数据。
2 结果
74例患者平均随访7.1个月(范围1~46个月),68例死亡。随访期病死率为91.9%,中位生存期为8.2个月(范围7~1 380 d),两组生存曲线如图1所示。Child-Pugh A级 与B级中位生存期分别是8.5个月(95%CI:7.7~9.3个月)和2.5个月(95%CI:2.4~2.6个月),P=0.002。A、B两组3、6、9、12和24个月生存率分别为85%、60%、31%、17%、11%和33%、17%、17%、8%、0%。
Child-Pugh A与B组患者肝功能衰竭的发生率分别为4.8%(3/62)和75%(9/12),ICG-R15<20%与≥20%患者出现肝功能衰竭的发生率分别为6.9%(4/58)和56.3%(8/16)。Child-Pugh B与ICG-R15≥20%预测BCLC-C TACE治疗后肝功能衰竭的价值如表2所示。1例肝功能衰竭患者于TACE后1个月内死亡,其相关病死率为8.3%(1/12)。

表2 Child-Pugh与ICG-R15预测进展期肝癌TACE治疗后肝功能衰竭的价值
3 讨论
目前,肝癌的临床治疗现状仍然是许多患者在初诊时已属晚期[1]。临床上口服索拉菲尼已为晚期肝癌的标准治疗[6-7]。TACE是BCLC-C治疗可选择的方法[8]。晚期肝癌虽经同样治疗,但其预后生存期差异颇大[5,9-15],探其原因与患者肿瘤负荷和肝功能储备有关[11]。
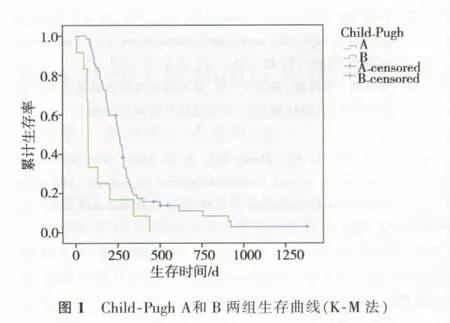
在BCLC-C TACE治疗中,依据肝功储备再加以分层,值得探索。TACE最常用的评价肝功能标准是Child-Pugh分级[12],通常认为Child-Pugh A和B级患者能够耐受TACE手术。同时,Child-Pugh又是预测肝细胞癌预后的较可靠指标[13]。董家鸿等[14]对门脉癌栓的BCLC-C进行生存期的研究,发现Child-Pugh分层是非常有意义的预测因子。因此,利用Child-Pugh分层是必要的。
我们对BCLC-C TACE治疗的回顾性研究显示,Child-Pugh A级与Child-Pugh B级中位生存期的差异明显。本研究中TACE治疗BCLC-C,Child-Pugh A级患者生存期长于索拉菲尼治疗BCLC-C的生存期,提示Child-Pugh A级的BCLC-C患者,通过TACE治疗能够生存获益,但是,Child-Pugh B级患者生存期则相比很低。
尽管本研究中Child-Pugh B级患者较少,结果有一定的局限性,但是,此类进展期肝癌患者行TACE仍应当谨慎。据Chen等[15]报道,Child-Pugh B级患者肝动脉化疗栓塞术后导致肝功能不全的发生率较高,平均应用11.8 ml碘油时发生率为84.2%,平均应用28.3 ml时发生率为92.3%,而在Child-Pugh A级患者中发生率分别为5.5%和5.9%。因此,能够推断TACE对Child-Pugh B级的患者造成肝功能的损伤较大,预后自然受到限制。
由于TACE造成术后肝功能衰竭,导致生存显著差异,Grieco等[12]报道对TACE后无肝功能衰竭发生与出现肝功能衰竭患者随访12个月,病死率分别为16/17和47/81(P<0.001),本研究结果也显示BCLC-C患者,TACE前筛选较好的肝功能储备,避免术后肝功能衰竭,对提高患者生存有重要价值。我们回顾性分析Child-Pugh与ICG-R15预测肝功能衰竭的价值见表2,Child-Pugh B敏感度、特异度及准确度略优于ICG-R15≥20%,对于二者及二者结合后能否作为BCLC-C TACE后肝功能衰竭的预测因子以及效果如何,有待于以后进一步的研究。
[1]Nishikawa H,Osaki Y,Kita R,et al.Hepatic arterial infusion chemotherapy for advanced hepatocellular carcinoma in Japan[J].Cancers(Basel),2012:165-183.
[2]Yoo DJ,Kim KM,Jin YJ,et al.Clinical outcome of 251 patients with extrahepatic metastasis at initial diagnosis of hepatocellular carcinoma:does transarterial chemoembolization improve survival in these patients?[J].J Gastroenterol Hepatol,2011,26:145-154.
[3]Chung GE,Lee JH,Kim HY,et al.Transarterial chemoembolization can be safely performed in patients with hepatocellular carcinoma invading the main portal vein and may improve the overall survival[J].Radiology,2011,258:627-634.
[4]Kim KM,Kim JH,Park IS,et al.Reappraisal of repeated transarterial chemoembolization in the treatment of hepatocellular carcinoma with portal vein invasion[J].J Gastroenterol Hepatol,2009,24:806-814.
[5]Pinter M,Hucke F,Graziadei I,et al.Advanced-Stage hepatocellular carcinoma:transarterial chemoembolization versus sorafenib[J].Radiology,2012,263:590-599.
[6]Huang YS,Chiang JH,Wu JC,et al.Risk of hepatic failure after transcatheter arterial chemoembolization for hepatocellular carcinoma:predictive value of the monoethylglycinexylidide test[J].Am J Gastroenterol,2002,97:1223-1227.
[7]Cheng AL,Kang YK,Chen Z,et al.Efficacy and safety of sorafenib in patients in the Asia-Pacific region with advanced hepatocellular carcinoma:a phaseⅢrandomised,doubleblind,placebo-controlled trial[J].Lancet Oncol,2009,10:25-34.
[8]Llovet JM,Ricci S,Mazzaferro V,et al.Sorafenib in advanced hepatocellular carcinoma[J].N Engl J Med,2008,359:378-390.
[9]Ministry of Health of the People's Republic of China.Diagnosis,management,and treatment of hepatocellular carcinoma[J].J Clin Hepatol,2011,27:1141-1159.
[10]Qu XD,Chen GS,Wang JH,et al.The efficacy of TACE combined sorafenib in advanced stages hepatocellullar carcinoma[J].BMC Cancer,2012,12:263.
[11]Chern MC,Chuang VP,Cheng T,et al.Transcatheter arterial chemoembolization for advanced hepatocellular carcinoma with inferior vena cava and right atrial tumors[J].Cardiovasc Intervent Radiol,2008,31:735-744.
[12]Grieco A,Pompili M,Caminiti G,et al.Prognostic factors for survival in patients with early-intermediate hepatocellular carcinoma undergoing non-surgical therapy:comparison of Okuda,CLIP,and BCLC staging systems in a single Italian centre[J].Gut,2005,54:411-418.
[13]Kiely JM,Rilling WS,Touzios JG,et al.Chemoembolization in patients at high risk:results and complications[J].J Vasc Interv Radiol,2006,17:47-53.
[14]董家鸿,郑树森,陈孝平,等.肝切除术前肝脏储备功能评估的专家共识(2011版)[J].中华消化外科杂志,2011,10:20-25.
[15]Chen MS,Li JQ,Zhang YQ,et al.High-dose iodized oil transcatheter arterial chemoembolization for patients with large hepatocellular carcinoma[J].World J Gastroenterol,2002,8:74-78.
