125I粒子持续照射对Sw1990及Panc-1细胞生物学效应的影响
2013-06-23蒋奡王忠敏张丽云茅爱武刘芬菊
蒋奡,王忠敏,张丽云,茅爱武,刘芬菊
胰腺癌是一种高度恶性的肿瘤,放射治疗是目前治疗胰腺癌、预防术后复发、延长患者生存期及提高生活质量的重要手段之一[1]。临床上用于内照射治疗的放射性粒子包括125I、103Pd等,Nath等[2]、Wang等[3]和Reniers等[4]分别使用103Pd及125I粒子行细胞照射实验,得出103Pd比250 KvpX线及125I比60Coγ射线的相对生物学有效性分别为1.24和1.39。125I主要发射27.4 keV和31.4 keV的X线和35.5 keV的γ射线,可使乏氧细胞再氧化,增加了肿瘤细胞的放射敏感性,且不易损伤正常组织[5-6],125I的t1/2为60.1 d,可提供约200 d的持续照射,以上特点使125I粒子在我国得到了临床医师的认可和广泛应用[7-8]。
目前胰腺癌细胞种类很多,如Panc-1、Sw1990、P3、Capan-1、Capan-2、Aspc-1、Hs766T等[9]。根据美国模式培养物保藏所(ATCC)资料显示,Sw1990细胞来源于人胰腺癌的脾脏转移灶,Panc-1细胞是人胰腺导管上皮癌。本研究采用125I粒子持续照射,通过集落形成实验、细胞凋亡率检测、细胞周期检测、3H-TDR掺入实验比较照射后两种细胞增殖抑制的主要机制及生物学效应是否存在差异。
1 材料和方法
1.1 材料
人胰腺癌Sw1990细胞株及Panc-1细胞由中科院上海细胞库提供。BT-125-1型125I粒子由上海欣科医药有限公司提供。DMEM培养基购自美国Gibco公司,胎牛血清购自德国Biotrom公司,0.25%胰酶购自美国HyClone公司、AnnexinV/PI凋亡试剂盒购自美国Invitrogen公司。
1.2 细胞培养
Sw1990及Panc-1细胞体外培养于DMEM培养基中,培养基内加入10%胎牛血清,细胞倍增时间分别为64 h和52 h,用0.25%胰酶传代。细胞传代后生长至指数生长期时进行照射。
1.3 照射装置
根据文献报道,采用Gray实验室125I粒子离体照射模型[10],模型为抽屉式结构,分为两层,下层放置125I粒子,14枚粒子以35 mm为直径环形排布,上层为细胞培养板,放置直径为35 mm的细胞培养皿(图1)。细胞培养平面的吸收剂量以及照射所需的时间通过测量和计算得出。实验照射使用平均初始活度为111 MBq(3 mCi)的125I粒子,细胞培养平皿的初始剂量率为12.13 cGy/h,分别给予2、4、6、8 Gy的照射,在持续照射期间,粒子照射模型放置在铅盒内以防止放射性污染,铅盒放置在孵育箱内培养。另设一组空白对照,照射组及对照组均设3个平行样本。

图1 125I粒子持续照射装置
1.4 克隆形成实验
Sw1990及Panc-1细胞培养至指数生长期时,用含EDTA的胰酶消化成单细胞,分别接种于不同细胞数的培养皿中,加入2 ml培养液,待细胞贴壁后分别行0、2、4、6、8 Gy照射,照射后细胞置孵育箱培养14 d,培养过程中3 d换1次新鲜培养液。14 d后用甲醇固定,吉姆萨染色后显微镜下计数(50个细胞以上为1个集落形成单位),实验重复3次,每个剂量点设3个平行样本,计算集落形成率(PE)及细胞存活率(SF)。
1.5 细胞凋亡率及细胞周期检测
1.5.1 凋亡率检测Sw1990及Panc-1细胞照射达到相应吸收剂量(2、4、6、8 Gy)后,与对照组(0 Gy)一起继续培养48 h,收集细胞,离心洗涤后重悬,加入AnnexinV及PI染色后,置冰上送流式细胞仪检测。每组均设3个平行样本并重复3次实验。
1.5.2 细胞周期检测两种细胞照射达到相应吸收剂量(2、4、6、8 Gy)后,与对照组一起继续培养24 h,收集细胞,离心洗涤,加入体积分数为70%乙醇固定过夜。流式细胞仪检测前离心去掉乙醇,加入RNA酶分解RNA,并行PI染色,上机检测。每组均设3个平行样本并重复3次实验。
1.6 3H-TDR掺入实验
细胞增殖时需要利用胸腺嘧啶核苷酸(TDR),若将合成DNA的前体物质胸腺嘧啶核苷酸用放射性同位素3H标记,合成3H-TDR,加入到培养体系中,即可被细胞摄取而掺入到DNA分子中。培养终止后,测定肿瘤细胞内3H-TDR的掺入量,与对照组比较,反映出照射后细胞DNA合成情况。分别计数Sw1990及Panc-1细胞,接种相同的细胞数(1×105个细胞)至35 mm培养皿中,贴壁后行125I放射性粒子持续照射,照射剂量分别为2、4、6、8 Gy。照射后3 h每个照射皿注入10μl的3H-TDR,加入后24 h收获细胞,加入2 ml闪烁液,用液体闪烁计数仪检测细胞放射量。每个剂量设3个平行样,另设3个对照皿。
1.7 统计学处理
采用SAS9.1(NC,USA)软件进行统计学分析并拟合细胞存活曲线,Excel 2007(CA,USA)绘图。P<0.05为差异有统计学意义。
2 结果
2.1 细胞克隆形成率
14 d后计数各剂量点克隆数(计数50个细胞以上的为1个集落形成单位),计算各剂量点的SF(照射组PE/对照组PE×100%),根据线形二次模型对SF与剂量之间的关系进行拟合,拟合方程为SF=e-αD-βD^2,求出SF2(2 Gy时的SF拟合值),结果见图2。经计算,Sw1990细胞的SF2为0.766±0.063,Panc-1细胞的SF2值为0.729±0.045,经独立样本t检验,两种细胞的SF2差异无统计学意义(P>0.05)。
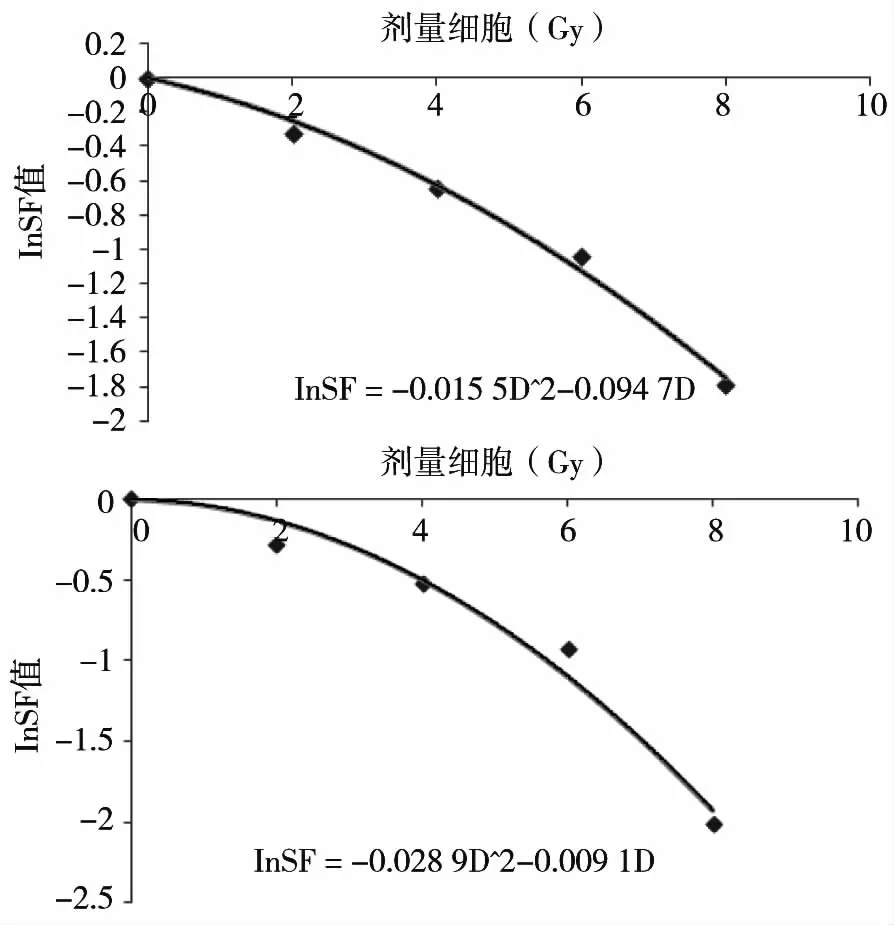
图2 细胞拟合存活曲线
2.2 细胞凋亡率
照射结束后继续培养48 h,染色并上机送检,结果见图3。

图3 随照射剂量增高,两种胰腺癌细胞凋亡率逐渐增高
2.3 两种细胞照射后的细胞周期
见表1。
表1 两种细胞照射后的细胞周期(±s)

表1 两种细胞照射后的细胞周期(±s)
?
2.4 3H-TDR掺入实验
经液体闪烁计数器测定,Sw1990细胞的3HTDR放射量随照射剂量增高逐渐降低,6 Gy时达到最低,8 Gy时放射量增高,但明显低于4 Gy。Panc-1细胞的3H-TDR放射量也随照射剂量增高逐渐降低,6 Gy时达到最低。计算细胞DNA合成率,设对照组3H-TDR放射量为1(图4)。

图4 两照射组DNA合成率
经方差分析,Sw1990及Panc-1细胞在2 Gy剂量照射下,3H-TDR放射量与对照组差异无统计学意义(P>0.05),表明2 Gy的累积照射剂量可能不足以抑制这两种细胞的DNA合成。两种细胞3HTDR放射量在4 Gy比6 Gy、4 Gy比8 Gy时差异均有统计学意义(P<0.05),但6 Gy比8 Gy的差异则无统计学意义(P>0.05),两种细胞各剂量组之间差异亦无统计学意义(P>0.05)。Sw1990、Panc-1细胞在8 Gy剂量照射后的3H-TDR放射量均比6 Gy时高,且Sw1990细胞增幅更为明显,可能是因为Sw1990细胞倍增周期更长,在累积剂量达8 Gy时,细胞已完成了部分DNA修复工作。
3 讨论
放射治疗是治疗肿瘤的有效手段,临床上常用的放射性粒子包括125I、103Pd、131Cs等,具有剂量率低,可反复植入、适形照射的特点,与外照射相比提高了肿瘤靶区的照射剂量,降低了周围正常组织的照射损伤,减少了并发症的发生。
肿瘤细胞放射致死主要是发生了增殖性死亡,即细胞经过照射后虽然形态依然存在,但已不能无限分裂,克隆形成实验能很好地反映离体细胞的分裂增殖特性。目前的研究认为,照射所致的细胞凋亡及G2/M期阻滞是其抑制肿瘤生长的主要方式,这与我们的研究结果相符。研究125I治疗前列腺癌患者的学者认为其是通过下调抑制细胞凋亡的Bcl-2蛋白的表达及影响Caspase家族从而产生抑制作用[11],也有学者认为改变DNA甲基转移酶类型也是机制之一[12]。3H标记的胸腺嘧啶核苷酸作为DNA合成的原料之一,当DNA受到损伤时其合成能力下降,因此3H-TDR掺入率也会下降,但修复细胞DNA损伤时也需使用3H-TDR,其掺入量又会有所升高,测定肿瘤细胞内的3H-TDR的放射量可以反映细胞DNA合成量。但总的放射量是由细胞DNA合成抑制和DNA损伤修复共同作用的结果。究竟何种剂量下DNA合成抑制程度最大尚少见报道。本实验使用125I粒子完成0、2、4、6、8 Gy剂量的照射后,采用克隆形成实验检测照射后细胞体外分裂能力、凋亡率及细胞周期以及3H-TDR掺入实验探究照射后的细胞DNA合成情况。结果表明,在0~8 Gy的持续照射下,Panc-1及Sw1990细胞克隆形成率随照射剂量增加而逐渐减少,反映细胞放射敏感性指标SF2在两者间差异无统计学意义。Panc-1细胞在剂量为6 Gy时G2/M期阻滞达到最大,而Sw1990细胞则在8 Gy时达到最大,这可能与Sw1990细胞倍增周期更长有关(52 h比64 h),该范围内两种胰腺癌细胞的放射敏感性无显著差异,作为实验对象选择时无差异性。
放射性粒子组织间近距离照射已被证明在抑制肿瘤生长方面有显著疗效,进一步探究其产生作用的分子机制以及治疗不同肿瘤时的最适剂量是未来亟待解决的问题。
[1]吴巍巍,赵玉沛,廖泉,等.人胰腺癌细胞株放射敏感性的体外研究[J].中华肝胆外科杂志,2004,10:821-823.
[2]Nath R,Bongiorni P,Chen Z,et al.Dose rate dependence of the relative biological effectiveness of103Pd for continuous low dose rate irradiation of BA1112 rhabdomyosarcoma cells in vitro relative to acute exposures[J].Int J Radiat Biol,2005,81:689-699.
[3]Wang J,Wang J,Liao A,et al.The direct biologic effects of radioactive125I seeds on pancreatic Cancer cells PANC-1,at continuous low-dose rates[J].Cancer Biother Radiopharm,2009,24:409-416.
[4]Reniers B,Verhaegen F.The microdosimetry of low-energy photons in radiotherapy[J].Radiat Prot Dosimetry,2006,122:401-403.
[5]Dale R,Carabe-Fernandez A.The radiobiology of conventional radiotherapy and its application to radionuclide therapy[J].Cancer Biother Radiopharm,2005,20:47-51.
[6]Roeder F,Timke C,Uhl M,et al.Aggressive local treatment containing intraoperative radiation therapy(IORT)for patients with isolated local recurrences of pancreatic Cancer:a retrospective analysis[J].BMC Cancer,2012,12:295.
[7]卓水清,陈林,张福君,等.125I放射性粒子植入术后患者周围辐射剂量的监测[J].癌症,2007,26:666-668.
[8]王忠敏,陈克敏,金冶宁,等.CT引导下植入125I放射性粒子治疗胰腺癌的临床应用[J].临床放射学杂志,2008,27:1730-1735.
[9]Zhang Y,Li M,Wang H,et al.Profiling of 95 microRNAs in pancreatic Cancer cell lines and surgical specimens by real-time PCR analysis[J].World J Surg,2009,33:698-709.
[10]王济东,王俊杰.放射性125I粒子离体照射模型建立及持续照射对胰腺癌细胞PANC-1抑制作用的研究[C].2007第六届全国放射肿瘤学学术年会论文集,2007.
[11]廖安燕,王俊杰,赵勇,等.125I粒子照射诱导人前列腺癌细胞凋亡的实验研究[J].中华放射医学与防护杂志,2007,27:311-313.
[12]Ma JX,Jin ZD,Si PR,et al.Continuous and low-energy125I seed irradiation changes DNA methyltransferases expression patterns and inhibits pancreatic cancer tumor growth[J].J Exp Clin Cancer Res,2011,30:35.
