通过奥沙利铂抑制PI3K/Akt通路以增强TRAIL诱导结肠癌RKO细胞凋亡敏感性的实验研究
2013-06-22徐明昊孙明华李恩泽朱志图
徐明昊,张 悦,孙明华,李恩泽,朱志图
肿瘤坏死因子相关凋亡诱导配体 (TRAIL)能特异地诱导肿瘤细胞凋亡,既往研究认为肠癌细胞对TRAIL不敏感[1];近年研究发现,PI3K/Akt通路的活化可能与肠癌细胞的敏感性有关[2-3]。奥沙利铂 (L-OHP)是第三代铂类化疗药物,目前已广泛应用于消化道肿瘤的治疗,尤其是结肠癌的一线治疗。本研究通过亚毒性剂量奥沙利铂抑制PI3K/Akt通路以增强TRAIL诱导结肠癌RKO细胞凋亡的敏感性,探讨其作用机制,为结肠癌的治疗提供新思路。
1 材料与方法
1.1 材料 人结肠癌RKO细胞株由中国医科大学惠赠;重组人TRAIL购于美国Cytolab/Peprotech Asia公司;奥沙利铂购自江苏恒瑞医药股份有限公司。碘化丙啶 (PI)、甲基偶氮唑蓝(MTT)、RPMI 1640培养基、RNAse购于Sigma公司;胎牛血清购于中国医学科学院血液学研究所;兔抗人p-Akt、兔抗人Akt、兔抗人Caspase-3及鼠抗人actin抗体购自Santa Cruz公司;羊抗兔和羊抗鼠辣根过氧化物酶标记的二抗购于北京中杉金桥生物技术有限公司。
1.2 细胞培养 人结肠癌RKO细胞株常规传代培养,生长于含10%灭活胎牛血清、青霉素 (100 U/ml)及链霉素 (100 mg/ml)的RPMI 1640培养基,于37℃、5%CO2、饱和湿度的培养箱内培养。
1.3 细胞增殖率 采用MTT法进行检测,取对数生长期的细胞,0.25%胰酶消化,制成单细胞悬液,调整密度为3×104/ml,接种于96孔培养板中。空白对照组加入RPMI 1640培养基,每孔终体积为200 μl。对照组加入RPMI 1640培养基继续培养24、48、72 h,终止培养前4 h每孔加入 MTT液20 μl,到预定时间后加入二甲基亚砜 (DMSO)液200 μl;TRAIL单药组加入25、50、100、200、400 ng/ml的TRAIL继续培养24 h;奥沙利铂单药组加入10、20、40、80 μg/ml奥沙利铂继续培养24、48、72 h;联合用药组加入100 ng/ml TRAIL和40 μg/ml奥沙利铂继续培养24 h;各组培养完成后振荡,采用酶联免疫检测仪测定570 nm处各孔吸光度值,各组实验重复3次取平均值。计算细胞增殖率和药物抑制细胞增殖50%的浓度 (IC50)。细胞增殖率 (%)=(处理组平均吸光度值-空白对照组平均吸光度值)/(对照组平均吸光度值-空白对照组平均吸光度值)×100%。
1.4 细胞凋亡率 采用流式细胞术进行检测,分别收集各组细胞,1 000 r/min离心5 min,冷磷酸盐缓冲液 (PBS缓冲液)洗涤,加入70%冷乙醇4℃固定24 h,1 000 r/min离心5 min,加入终浓度为10 mg/ml的PI,避光反应30 min后进行检测。采用Cell Quest法计算各期细胞凋亡率。
1.5 蛋白定量 采用蛋白印迹法 (Western blot)检测各组细胞蛋白变化,分别收集各组细胞,冷PBS缓冲液洗涤2次后加入1%Triton裂解液〔1%Triton X-100,50 mmol/L Tris-Cl(pH 7.4),150 mmol/L NaCl,10 mmol/L乙二胺四乙酸(EDTA),100 mmol/L氟化钠 (NaF),1 mmol/L钒酸钠(Na3VO4),1 mmol/L苯甲基磷酰氟 (PMSF),2 μg/ml aprotinin〕,冰上裂解30 min,之后高速离心 (15 000 r/min)30 min,取上清液,Lowry法进行蛋白定量。将样品与3×样品缓冲液混合后煮沸5 min,于10%SDS-聚丙烯凝胶中电泳,之后电转移至硝酸纤维素膜上,5%脱脂牛奶封闭2 h,加入一抗p-Akt、Akt、Caspase-3及actin,4℃孵育过夜。TBST〔10 mmol/L Tris(pH 7.4),150 mmol/L NaCl,0.1%Tween20〕洗涤4次,加入辣根过氧化物酶标记的二抗,室温下孵育30 min,TBST冲洗,采用ECL法显色,GIS凝胶图像分析系统成像并分析处理。
1.6 细胞形态 采用瑞氏-吉姆萨染色法,将细胞种于6孔板中,调整浓度为2.5×104/孔,培养箱内过夜后收集各组细胞,2 000 r/min离心机甩片3 min制成细胞涂片,瑞氏-吉姆萨染液 (Sigma)染色,15 min后流水冲洗,干燥后光学显微镜下观察细胞形态并拍照。
1.7 统计学方法 应用SPSS 13.0统计软件进行分析,计量资料以 (x±s)表示,组间比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
2.1 细胞增殖率 TRAIL单药组24 h时细胞增殖率分别为(108.8±6.4)%、 (113.2±12.1)%、 (101.5±5.8)%、(96.8±5.0)%、(90.2±7.2)%,与对照组比较,差异均无统计学意义 (对照组细胞增殖率均为100%,t值分别为1.231、1.385、0.074、0.998、1.976,P >0.05,见图 1A)。奥沙利铂单药组24、48、72 h时 IC50分别为 (44.3±7.6)ng/ml、(22.3 ±6.1)ng/ml、 (9.8 ±4.5)ng/ml,与对照组比较,差异均有统计学意义 (对照组IC50均为0,t值分别为10.096、6.332、3.772,P<0.05,见图1B)。联合用药组24 h时细胞增殖率为 (30.6±2.7)%,40 μg/ml奥沙利铂单药组为 (48.4±5.2)%,差异有统计学意义 (t=9.607,P<0.05,见图1C)。
2.2 细胞凋亡率及蛋白定量 对照组细胞凋亡率为 (0.9±2.7)%,100 ng/ml TRAIL组为 (2.5±2.1)%,40 μg/ml奥沙利铂组为 (9.6±1.9)%,联合用药组为 (23.5±3.5)%(见图2A)。100 ng/ml TRAIL组细胞凋亡率与对照组比较,差异无统计学意义 (t=0.956,P>0.05);40 μg/ml奥沙利铂组、联合用药组细胞凋亡率与对照组比较,差异均有统计学意义 (t值分别为4.971和8.856,P<0.05)。
100 ng/ml TRAIL组1、3、6、12、24 h时 p-Akt活化性逐渐增强,于6 h和12 h时达到高峰,24 h时开始减弱 (见图2B),没有观察到活化的Caspase-3(见图2C);40 μg/ml奥沙利铂组和联合用药组p-Akt活化性被明显抑制,可以观察到活化的Caspase-3(见图2C)。

图1 TRAIL和奥沙利铂对结肠癌RKO细胞增殖率的影响Figure 1 Effects on cell proliferation rate of colon cancer RKO treated by TRAIL and oxaliplatin
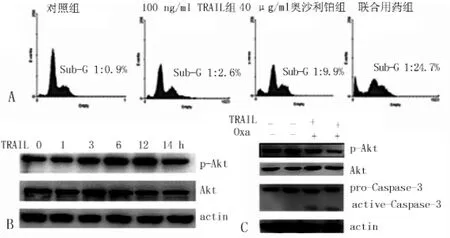
图2 TRAIL和奥沙利铂对结肠癌RKO细胞PI3K/Akt通路的影响Figure 2 Effects on PI3K/Akt pathway of colon cancer RKO treated by TRAIL and oxaliplatin
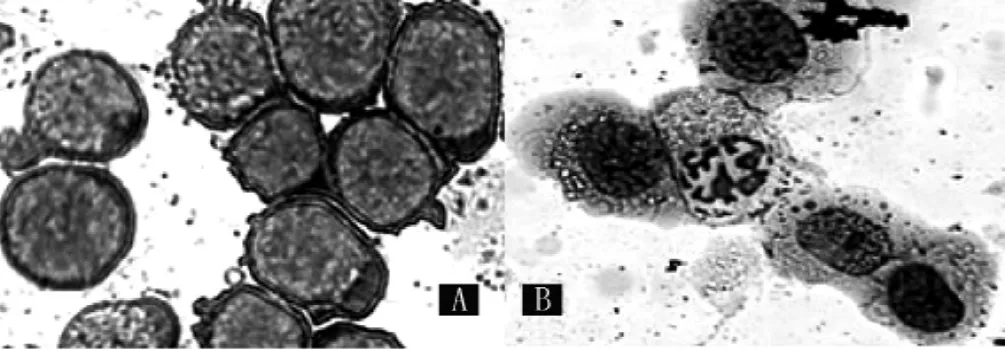
图3 奥沙利铂作用结肠癌RKO细胞形态学的影响 (瑞氏-吉姆萨染色,×200)Figure 3 Effects on cell morphology of colon cancer RKO treated by oxaliplatin
2.3 细胞形态 对照组细胞形态正常 (见图3A),40 μg/ml奥沙利铂组可见典型的凋亡小体 (见图3B)。
3 讨论
结肠癌是世界第3常见恶性肿瘤[4-5],近年来其发病率呈上升趋势,虽然结肠癌的外科治疗已取得巨大进步,但因早期诊断率不高,多数患者就诊时已属晚期。第三代化疗新药和分子靶向药物的应用可显著提高结肠癌患者的生存期,但其5年生存率仍不能令人满意,究其原因,可能是肿瘤患者异质性及化疗药物耐药而导致化疗失败。因此,寻找新型抗肿瘤药物已成为国内外研究热点。
目前,诱导肿瘤细胞凋亡是治疗肿瘤的研究热点之一,而新近发现的TRAIL可不影响正常细胞的生长与分化,选择性地诱导多种肿瘤细胞凋亡[6-7],在肿瘤的靶向治疗中具有良好的应用前景[8]。但部分体外实验研究显示,肿瘤细胞对TRAIL诱导的凋亡作用不敏感甚至完全耐受[9-10],而获得性耐药严重妨碍着其临床应用[11]。本实验研究结果显示,采用MTT法检测的不同浓度TRAIL作用于结肠癌RKO细胞的细胞抑制率与对照组比较,均无明显差异,表明TRAIL对结肠癌RKO细胞不敏感。如何有效地增强肿瘤细胞对TRAIL的敏感性就成为首要解决的问题。
有研究发现PI3K/Akt信号通路高度活化是结肠癌细胞对TRAIL不敏感的重要原因[12]。PI3K/Akt信号通路广泛存在于细胞中,通路活化可以抑制癌细胞凋亡、促进癌细胞增殖,与结直肠癌的发生发展密切相关。本实验研究蛋白定量结果提示,TRAIL参与结肠癌RKO细胞PI3K/Akt的通路活化,可导致结肠癌RKO细胞对TRAIL不敏感。研究表明,紫杉醇、顺铂等化疗药物可增强TRAIL的敏感性[13-15]。奥沙利铂作为继顺铂和卡铂之后的第三代铂族金属抗肿瘤药物,能够抑制结肠癌细胞PI3K/Akt通路活化[16-17],PI3K/Akt通路可能是奥沙利铂的作用靶点。本研究结果显示,40 μg/ml奥沙利铂作用结肠癌RKO细胞24 h,细胞凋亡率为 (9.6±1.9)%,明显高于对照组,且抑制了p-Akt活化性,可以观察到活化的Caspase-3。联合用药组细胞凋亡率提到 (23.5±3.5)%,且同样抑制了p-Akt活化性,可以观察到活化的Caspase-3,且其作用较40 μg/ml奥沙利铂单药组略有增强,提示奥沙利铂可引起结肠癌RKO细胞凋亡,并通过抑制Akt的活化而提高结肠癌RKO细胞对TRAIL的敏感性。
综上所述,奥沙利铂可通过抑制PI3K/Akt通路活化而增强TRAIL诱导结肠癌RKO细胞凋亡的敏感性,提高结肠癌细胞对TRAIL的敏感性,为结肠癌的靶向治疗提供了新的思路。
1 Xu L,Qu X,Zhang Y,et al.Oxaliplatin enhances TRAIL-induced apoptosis in gastric cancer cells by CBL-regulated death receptor redistribution in lipid rafts [J].FEBS Lett,2009,583(5):943-948.
2 Liu J,Qu X,Xu L,et al.Phosphoinositide 3-kinase/Akt and nuclear factor κB pathways are involved in tumor necrosis factor-related apoptosis-inducing ligand resistance in human gastric cancer cells [J].Mol Med Report,2010,3(3):491-496.
3 Wang WQ,Zhang H,Wang HB,et al.Programmed cell death 4(PDCD4)enhances the sensitivity of gastric cancer cells to TRAIL-induced apoptosis by inhibiting the PI3K/Akt signaling pathway [J].Mol Diagn Ther,2010,14(3):155-161.
4 Wentink MQ,Räkers M,Stupart DA,et al.Incidence and histological features of colorectal cancer in the Northern Cape Province,South Africa[J].S Afr J Surg,2010,48(4):109-113.
5 Terhaar Sive Droste JS,Craanen ME,van der Hulst RW,et al.Colonoscopic yield of colorectal neoplasia in daily clinical practice[J].World J Gastroenterol,2009,15(9):1085-1092.
6 Kalb ML,Glaser A,Stary G,et al.TRAIL(+)human plasmacytoid dendritic cells kill tumor cells in vitro:mechanisms of imiquimod-and IFN-alpha-mediated antitumor reactivity [J].Immunol,2012,188(4):1583-1591.
7 Groth A,Salnikov AV,Ottinger S,et al.New gene-immunotherapy combining TRAIL-lymphocytes and EpCAMxCD3 Bispecific antibody for tumor targeting [J].Clin Cancer Res,2012,18(4):1028-1038.
8 Wu GS.TRAIL as a target in anti-cancer therapy [J].Cancer Lett,2009,285(1):1-5.
9 Oh Y,Jeon YJ,Hong GS,et al.Regulation in the targeting of TRAIL receptor 1 to cell surface via GODZ for TRAIL sensitivity in tumor cells[J].Cell Death Differ,2012,19(7):1196-1207.
10 Bangert A,Cristofanon S,Eckhardt I,et al.Histone deacetylase inhibitors sensitize glioblastoma cells to TRAIL-induced apoptosis by c-myc-mediated downregulation of cFLIP [J].Oncogene,2012,31(44):4677-4688.
11 Huang Z,Song L,Wang C,et al.Hypoxia-ischemia upregulates TRAIL and TRAIL receptors in the immature rat brain[J].Dev Neurosci,2011,33(6):519-530.
12 Plastaras JP,Dorsey JF,Carroll K,et al.Role of PI3K/Akt signaling in TRAIL-and radiation-induced gastrointestinal apoptosis[J].Cancer Biol Ther,2008,7(12):2047-2053.
13 Asakuma J,Sumitomo M,Asano T,et al.Selective Akt inactivation and tumor necrosis actor-related apoptosis-inducing ligand sensitization of renal cancer cells by low concentrations of paclitaxel[J].Cancer Res,2003,63(6):1365-1370.
14 Wu XX,Jin XH,Zeng Y,et al.Low concentrations of doxorubicin sensitizes human solid cancer cells to tumor necrosis factor-related apoptosis-inducing ligand(TRAIL)-receptor(R)2-mediated apoptosis by inducing TRAIL-R2 expression [J].Cancer Sci,2007,98(12):1969-1976.
15 Woods DC,Alvarez C,Johnson AL.Cisplatin-mediated sensitivity to TRAIL-induced cell death in human granulose tumor cells [J].Gynecol Oncol,2008,108(3):632-640.
16 Rakitina TV,Vasilevskaya IA,O'Dwyer PJ.Additive interaction of oxaliplatin and 17-Allylamino-17-demethoxygeldanamycin in colon cancer cell lines results from inhibition of nuclear factor kappaB signaling [J].Cancer Res,2003,63(24):8600-8605.
17 Prewett M,Deevi DS,Bassi R.Tumors established with cell lines selected for oxaliplatin resistance respond to oxaliplatin if combined with cetuximab [J].Clin Cancer Res,2007,13(24):7432-7440.
