脑源性多器官功能障碍综合征大鼠下丘脑内FOS、NOS、P 物质的表达及意义
2013-06-21王兴邦郭洪志屈传强
王兴邦,麻 琳,郭洪志,屈传强
(1山东大学齐鲁医院,济南250012;2山东省立医院)
脑源性多器官功能障碍综合征(CMODS)是急性重症脑组织损伤引起的多器官功能障碍。既往我们通过对急性脑血管病、下丘脑、垂体、靶腺轴进行的相关研究[1,2],并结合国内外资料认为,迷走神经及其递质乙酰胆碱和相应受体参与构成的胆碱能抗炎通路[3]在CMODS的发病中具有重要作用。但是,下丘脑在不同迷走神经状态下对CMODS的作用及机制尚不清楚。2010年10月~2011年1月,我们通过制作CMODS大鼠模型对此问题进行了研究。
1 材料与方法
1.1 材料
1.1.1 实验动物与分组 成年健康雄性Wistar大鼠(清洁级)100只,体质量250~300 g,由山东大学实验动物中心提供。用随机数字表将大鼠分为假手术组、脑出血组(CH组)、迷走神经切断组(SDV组)、脑出血+迷走神经切断组(CH+SDV组)和脑出血+迷走神经刺激组(CH+SIV组)各20只。
1.1.2 试剂与仪器 兔抗—氧化氮合酶(NOS)抗体,兔抗P物质抗体,兔抗FOS抗体,生物素标记的羊抗兔IgG,生物素卵蛋白辣根过氧化酶复合物(以上均购自武汉博士德有限公司);Ⅶ型胶原酶(美国Sigma公司),显微图像分析仪(Meta.MarPh/DP10/BX51型),照相显微镜(OLYMPUS)。
1.2 方法
1.2.1 动物模型制作 大鼠禁食12 h,禁水4 h,以1%戊巴比妥溶液40 mg/kg腹腔注射麻醉。参照Rosenberg等所述方法和大鼠CMODS模型法,以Ⅶ型胶原酶0.8 IU和3.2 IU肝素钠注射液共2μL尾状核内立体定向注射。假手术组注射同体积生理盐水,余步骤同出血组。
1.2.2 迷走神经切断及刺激术 SDV大鼠麻醉后行剖腹术,于胃小弯处暴露迷走神经左右两干支,在距离迷走神经各分支(胃支、肝支和腹腔支)约5 mm处用丝线结扎左右两干支并切断。SIV组大鼠手术暴露双侧颈部迷走神经;将银质电极做成套圈柄,套圈柄及外侧刷绝缘漆,套圈内侧为电极面,将套圈扣住迷走神经,灌入石蜡油与周围组织绝缘,从颈部后面穿出皮肤,缝合切口。CH+SDV组和CH+SIV组迷走神经干预术4周后制作脑出血模型。CH+SIV组大鼠脑出血术后24 h内给予5 V、1 Hz、2 ms的持续电刺激迷走神经,每次20 min,4 h 1次,共6次。
1.2.3 血液学与病理学检查 脑出血术后24 h,经颈静脉抽血 2 mL,进行 ALT、AST、BUN、Cr、LDH 检测;行肝脏、肾脏、肺脏、小肠组织病理学检查。
1.2.4 下丘脑内递质表达检测 采用免疫组化ABC法检测NOS、FOS蛋白、P物质表达,操作步骤严格按照免疫组化试剂盒说明书进行。照相显微镜拍照,经显微图像分析仪处理,计算下丘脑内FOS蛋白阳性细胞总和以及NOS、P物质阳性神经元单位面积内灰度值。
1.2.5 统计学方法 应用SPSS15.0统计软件包进行处理,数据以¯x±s表示,组间均数比较采用方差分析,两两比较采用q检验。P≤0.05为差异有统计学意义。
2 结果
2.1 各组肝肾功能、心肌酶学指标比较 脑出血术后24 h,各组肝肾功能、心肌酶学指标比较见表1。
2.2 各组器官组织病理改变 假手术组、SDV组大鼠各器官组织病理大致正常。CH组肺脏、肝脏、肾脏、小肠均可见非特异性炎症改变;CH+SIV组主要脏器炎性改变均较CH组和CH+SDV组减轻。CH+SDV组除肾脏外其余脏器病理改变均较CH组明显。
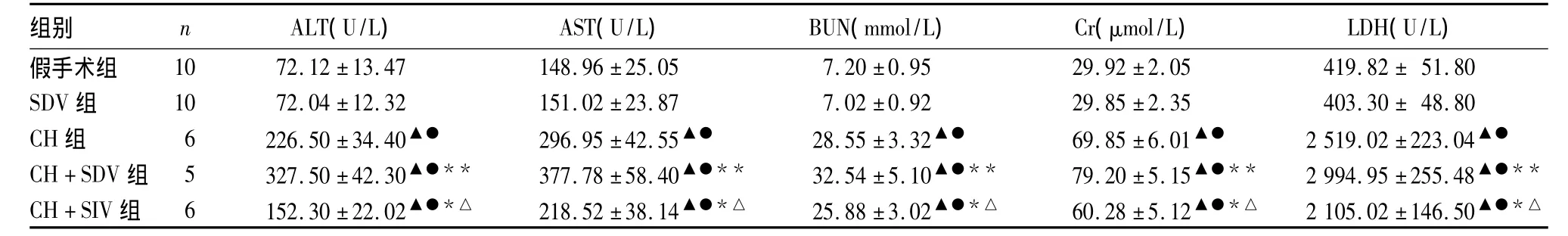
表1 各组肝肾功能、心肌酶学指标比较(¯x±s)
2.3 各组下丘脑内NOS、FOS、P物质阳性表达假手术组下丘脑内发现少数浅染的FOS蛋白阳性细胞及NOS、P物质表达,SDV组下丘脑内FOS蛋白阳性细胞及NOS、P物质表达较假手术组略多,但无统计学差异(P均>0.05)。CH+SDV组大鼠下丘脑内FOS蛋白阳性细胞及NOS、P物质表达主要集中在前部(视前区和视上区)、中部(结节区)。CH+SIV组下丘脑内FOS蛋白阳性细胞及NOS、P物质表达广泛分布于下丘脑各部。各组大鼠下丘脑内FOS、NOS、P物质表达比较见表2。
表2 各组下丘脑内FOS、NOS、P物质表达比较±s)
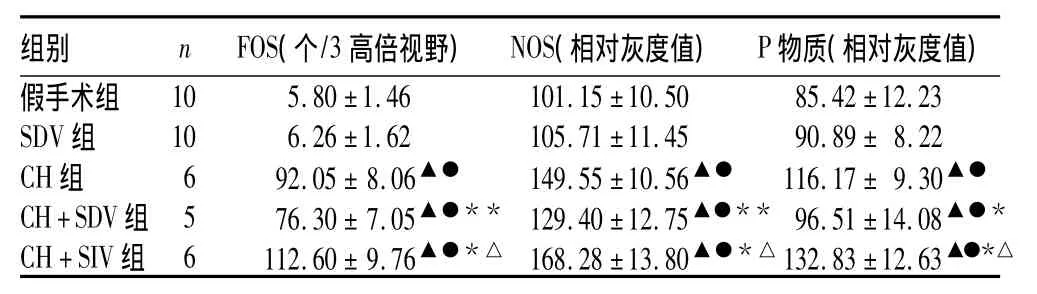
表2 各组下丘脑内FOS、NOS、P物质表达比较±s)
注:与假手术组比较,▲P<0.01;与 SDV 组比较,●P<0.01;与CH组比较,*P <0.05,**P <0.01;与 CH+SDV 组比较,△P <0.01
组别 n FOS(个/3高倍视野) NOS(相对灰度值) P物质(相对灰度值)假手术组10 5.80 ±1.46 101.15 ±10.50 85.42 ±12.23 SDV 组 10 6.26 ±1.62 105.71 ±11.45 90.89± 8.22 CH组 6 92.05±8.06▲● 149.55±10.56▲● 116.17± 9.30▲●CH+SDV组 5 76.30±7.05▲●** 129.40±12.75▲●** 96.51±14.08▲●*CH+SIV 组 6 112.60±9.76▲●*△ 168.28±13.80▲●*△132.83±12.63▲●*△
3 讨论
下丘脑是神经内分泌及自主神经系统的整合中枢,是维持机体内环境稳定和控制内分泌功能活动的重要结构,与脑内各部位有广泛的突触联系,其神经递质比较复杂,损害后可产生严重的内脏功能紊乱。其中,下丘脑室旁核(PVN)在调节血压时发挥重要作用,通过下行通路与延髓迷走神经运动背核和孤束核(NTS)、脊髓外侧角等部位联络而影响内脏自主活动。同时,孤束核也发出神经纤维投射到下丘脑,内脏器官受到刺激后可经迷走神经传入活化 NTS、PVN、视上核等部位[4],引起神经—内分泌—免疫反应。目前已知多种神经递质和受体集中在下丘脑、垂体、延髓区(单胺类物质、肽类物质为最主要的神经递质),广泛参与神经内分泌免疫活动[5,6]。我们前期研究显示,CMODS 过程中乙酰胆碱、血管活性肠肽等递质在延髓内脏带中表达增加,与急性重症疾病有着密切联系;基于此,我们探索下丘脑在CMODS中的作用以及其可能的途径。
FOS蛋白是 c-fos基因的表达产物[7],c-fos基因参与细胞的生长、分化、信号传导等生理功能,脑损伤及脑血管病等颅脑应激因素可诱发细胞核内cfos基因迅速大量表达产生FOS蛋白,故而FOS蛋白作为一种有效反映神经元对外界伤害性刺激发生反应的标志而被广泛应用。既往研究显示,大鼠盲肠穿孔术模型平均动脉压进行性下降,血浆TNF-α显著升高,肝脏炎性病理改变明显;给予迷走神经电刺激后,症状及生化、病理结果均明显改善[8]。我们前期研究已证实,内毒素及肝脏、肠道内毒素受体异常表达在CMODS发生中起重要作用[9],且延髓内脏带及迷走神经在CMODS大鼠中具有中枢炎症信号的传出和外周炎症信息传入的双向通路作用,增强传出迷走神经的活性能明显减轻外周脏器的功能损害和病理改变[10]。本实验中切断迷走神经后大鼠各脏器非特异性病理表现较CH组明显加重,下丘脑内NOS、P物质表达减少,刺激迷走神经则能增加其表达,其表达与大鼠脏器功能改变呈相反的变化趋势。这表明急性脑血管病致CMODS时,作为神经—内分泌中枢的下丘脑,其内递质发生变化,随迷走神经干预状态不同,递质变化不同,内脏功能随之相应变化。在下丘脑发挥中枢调控作用的过程中,迷走神经递质变化是重要的神经机制之一,当然可能还有许多其他神经内分泌免疫途径,但NOS、P物质可能是发挥调控作用复杂环节的基础。
由此推测,急性脑血管病、脑外伤等脑源性应激时,颅内结构直接或间接破坏,可以直接或间接损伤下丘脑,导致功能紊乱。脑底部中线结构移位造成垂体柄及门脉血管的牵拉与损伤,垂体损害后,神经递质调节障碍而引起相关应激激素异常分泌,进而兴奋植物神经系统;另一方面过度活化脑区的激素受体以及神经纤维、神经递质的联络异常而引起交感神经、副交感神经平衡失调,导致内分泌、心血管、胃肠、呼吸等系统调控紊乱,甚至引起多器官功能衰竭。因此,研究急性重症脑损伤所致CMODS时下丘脑的作用及机制,对指导临床意义重大。下丘脑及延髓内脏带作为内脏活动调节的中枢[11],迷走神经通过向下丘脑传递炎症信息和接收下丘脑发出的命令而调节炎症反应的变化,在此过程中,FOS、NOS、P物质和乙酰胆碱一样发挥了重要作用[12,13]。如果迷走神经通路被阻断而不能完成双向传递的作用,就会引起一系列炎症因子的改变进而导致炎症失衡,增加机体主要脏器的损害,进而发生全身炎症反应乃至MODS。如果顺利完成循环通路,就可能会使原本严重的炎症反应达到平衡,从而改善机体状态。当给予迷走神经刺激时,机体全身炎症反应减轻,炎症因子瀑布减轻或阻断,向更有利于自身免疫平衡方向发展,尽量避免或减少形成MODS的可能,从而改善预后。因此,神经免疫调节将来可能是全身炎症反应综合征的治疗方向之一[14]。当然,下丘脑的中枢调控作用机制异常复杂,更多问题有待深入研究。
[1]王松,郭洪志.急性脑梗死诱发全身炎症反应综合征致多器官功能障碍综合征的临床研究[J].临床神经病学杂志,2004,17(6):411-414.
[2]贺雅婷,郭洪志,屈传强,等.大鼠脑出血致多器官功能障碍综合征模型下丘脑、延髓内脏带与迷走神经的作用[J].中华神经科杂志,2011,44(3):190-195.
[3]Song JG,Li HH,Cao YF,et al.Electroacupuncture improves survival in rats with lethal endotoxemia via the autonomic nervous system[J].Anesthesiology,2012,116(2):406-414.
[4]Michl T,Jocic M,Heinemann A,et al.Vagal afferent signaling of a gastric mucosal acid insult to medullary,pontine,thalamic,hypothalamic,and limbic,but not cortical,nuclei of the rat brain[J].Pain,2001,92(1-2):19-27.
[5]Zhao DQ,Lu CL,Ai HB.The role of catecholaminergic neurons in the hypothalamus and medullary visceral zone in response to restraint water-immersion stress in rats[J].Physiol Sci,2011,61(1):37-45.
[6]Mazzone SB,Geraghty DP.Respiratory actions of tachykinins in the nucleus of the solitary tract:characterization of receptors using selective agonists and antagonist[J].Br J Pharmacol,2000,129(6):1121-1131.
[7]李慧,张玉玉,艾洪滨.切断膈肌下迷走神经对应激大鼠延髓、下丘脑FOS表达的影响[J].神经解剖学杂志,2010,26(2):107-111.
[8]Song XM,Li JG,Wang YL,et al.The protective effect of the cholinergic anti-inflammatory pathway against septic shock in rats[J].Shock,2008,30(4):468-472.
[9]孙海荣,郭洪志,张金彪,等.脑出血大鼠肝、肠组织中内毒素及其受体CD14的基因表达与多器官功能障碍综合征的关系[J].山东医药,2012,52(37):30-32.
[10]Pavlov VA,Parrish WR,Rosas-Ballina M,et al.Brain acetylcholinesterase activity controls systemic cytokine levels through the cholinergic and antiinflammatory pathway[J].Brain Behav Immun,2009,23(1):41-45.
[11] Silberstein S,Vogl AM,Bonfiglio JJ,et al.Immunology,signal transduction,and behavior in hypothalamic-pituitary-adrenal axisrelated genetic mouse models[J].Ann NY Acad Sci,2009,1153(1):120-130.
[12]Oliveira-Pelegrin GR,de Azevedo SV,Yao ST,et al.Central NOS inhibition differentially affects vasopressin gene expression in hypothalamic nuclei in septic rats[J].J Neuroimmunol,2010,227(1-2):80-86.
[13]Parrish WR,Rosas-Ballina M,Gallowitsch-Puerta M,et al.Modulation of TNF release by choline requires Alpha7 subunit nicotinic acetylcholine receptor-mediated signaling[J].Mol Med,2008,14(9-10):567-574.
[14]Kumar V,Sharma A.Is neuroimmunomodulation a future therapeutic approach for sepsis[J].Int immunopharmacol,2010,10(1):9-17.
