TACE联合RFA治疗原发性肝癌的临床疗效
2013-06-21王颖超厚瑞萍张梅娟刘长虹许翠萍
王 华,王颖超,厚瑞萍,张梅娟,刘长虹,许翠萍
(山东大学附属千佛山医院,济南250014)
为探讨肝动脉化疗栓塞(TACE)联合经皮射频消融(RFA)治疗原发性肝癌(PHC)的疗效及安全性,2008年3月 ~2010年3月,我院对35例 PHC患者行TACE+RFA联合治疗,并与29例单纯TACE治疗比较,观察患者近期疗效及生存期。现报告如下。
1 资料与方法
1.1 临床资料 同期本院收治PHC患者64例,男50 例、女14 例,年龄(50.9 ±9.5)岁;患者均经临床表现、生化及CT检查确诊为PHC,并排除其他恶性转移性肿瘤。具体选择标准为:①由于各种原因不能行手术切除者;②非弥漫性肝癌,经CT或DSA检查证实肿瘤数目不超过4个,最大肿瘤直径不超过10 cm;③患者一般状况好,KPS≥70分;④肝功能Child-Pugh分级属A级或B级;⑤不伴有下腔静脉或门静脉癌栓(PVTT);⑥未发现肝外转移,无黄疸、腹水;⑦治疗方案征得患者及家属知情同意。64例中,HBsAg阳性5例、阴性59例,Child-Pugh分级A级41例、B级23例,肿瘤单发44例、多发20例,肿瘤长径≤5 cm 12例、>5 cm 52例,血清AFP≤400 ng/mL 41例、>400 ng/mL 23例,Okuda分期Ⅰ期43例、Ⅱ期21例。64例随机分为TACE+RFA联合治疗组35例(观察组)和单纯TACE组29例(对照组),两组临床资料比较无统计学差异(P>0.05)。
1.2 方法
1.2.1 治疗方法 两组均先行 TACE治疗2~3次,间隔2周对观察组定位开始RFA治疗1~2次,治疗前做好各种术前准备。①TACE治疗:采用Seldinger法,经皮股动脉穿刺,导管选择性插入肝动脉行DSA造影了解肿瘤的大小、位置、供血动脉、肿瘤血管分布、有无动静脉瘘等,使用微导管超选择性插入靶血管,并经导管缓慢注入超液态碘化油5~20 mL+MMC 4~10 mg+CBP 25~100 mg+E-ADM 10~30 mg混悬液,药物剂量根据病灶大小及患者肝功能状况确定。栓塞后再次造影显示肿瘤血供中断,拔除导管鞘,穿刺部位加压包扎。术后定期监测肝肾功能、AFP及CT等,间隔3~4周重复治疗1次。②RFA治疗:观察组TACE治疗结束后2周复查CT,观察碘油沉积及肿瘤血供阻断情况,再行RFA治疗。根据CT所示肿瘤位置,患者取适当体位,超声定位选择穿刺点、进针方向和进针深度。局麻下经皮肝穿刺至肿瘤中心,根据肿瘤大小和形状布针,选择相应的消融功率,逐步展开消融针至合适直径进行消融,每次消融时间为10~15 min。对直径≤3 cm的小病灶采取单点单次治疗,对直径>3 cm的病灶采取多针、多点、由深至浅多层面叠加治疗。
1.2.2 随访与疗效观察 采取电话随访与门诊相结合的方式,以第1次TACE治疗为起点,至2013年3月为观察终点,或以死亡或随访截止时间为终点。全部治疗结束后,定期复查血常规、血生化、AFP、CT,观察病情变化情况。按照WHO实体肿瘤疗效报告标准评定近期疗效,分为完全缓解(CR)、部分缓解(PR)、稳定(SD)、进展(PD),有效率(RR)以CR+PR计算,以3年内生存率评价远期疗效,生存时间自第1次TACE开始计算。
1.2.3 统计学方法 采用SPSS17.0统计学软件,计量资料以¯x±s表示,组间比较采用t检验;计数资料以百分比表示,组间比较采用χ2检验;应用Kaplan-Meier法进行生存分析,Log-Rank检验比较两组生存率差异。P≤0.05为差异有统计学意义。
2 结果
2.1 两组近期疗效比较 观察组RR为77.1%,对照组为51.7%,两组比较差异有统计学意义(χ2=4.542,P <0.05)。见表1。
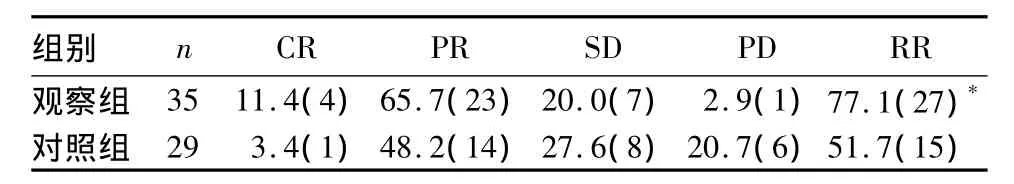
表1 两组近期疗效比较[%(例)]
2.2. 两组生存率比较 随访时间至2013年3月,未出现因治疗导致死亡的病例;死亡原因主要为肿瘤未控制引起的肝癌破裂出血、远处转移、肝功能衰竭及门脉高压导致的上消化道大出血等。观察组1、2、3 年生存率分别是 79.7%、52.3%、23.0%,中位生存期为25个月,平均生存期为24.8个月。对照组 1、2、3 年生存率分别为 59.4%、20.3%、6.8%,中位生存期为15个月,平均生存期为16.5个月。采用Log-Rank检验,两组生存率有统计学差异(χ2=6.827,P <0.05)。两组生存曲线见图 1。
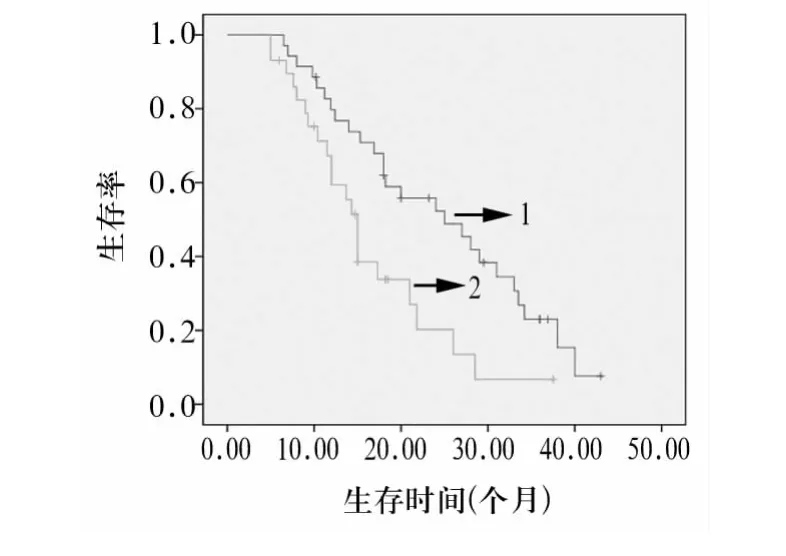
图1 两组生存曲线比较
2.3 不良反应 两组均出现与治疗相关的不良反应,主要表现为发热、消化道反应(腹痛、纳差、恶心、呕吐)、一过性肝功能损害和骨髓抑制等,经退热、保肝、护胃、升白细胞等积极治疗后均逐渐缓解。两组不良反应发生情况见表2。
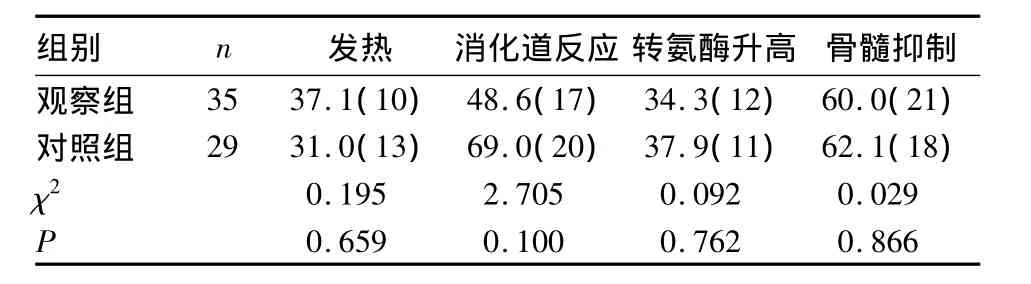
表2 两组不良反应发生率比较[%(例)]
3 讨论
肝癌的非手术治疗主要包括TACE、放射治疗、免疫治疗、射频消融、海扶刀、氩核刀及无水酒精注射等,其中TACE是非手术治疗中、晚期肝癌的首选方法[1]。TACE治疗通过碘油栓塞靶血管,阻断肿瘤血供,使肿瘤区域发生选择性缺血、坏死,同时经肝动脉注入化疗药杀死癌细胞。由于局部化疗药浓度较高,避免了全身大剂量用药和首过清除效应,降低了化疗不良反应。此外,由于肿瘤血管栓塞,血流相对缓慢,延长了药物作用时间,一定程度上也增强了治疗效果。同时TACE治疗可刺激机体的免疫反应,起到抗肿瘤协同作用[2]。但是,由于肿瘤供血的双重性、侧支循环形成、栓塞不完全或栓塞血管再通等原因,单纯TACE治疗肝癌,肿瘤完全坏死率仅为20%,特别是在肿瘤与正常肝组织交界处,残留癌细胞仍保持活性[3],极易引起复发。临床研究还发现[4],TACE术后患者外周血中血管内皮生长因子表达上调,也可能促进肿瘤血管再生成,导致肿瘤复发。本文单纯TACE治疗组RR以及1、2、3年生存率与文献报道相一致[5],说明TACE可明显延长PHC患者的生存期。
肝癌细胞对热的耐受能力比正常组织细胞差,局部加温至39℃可使肿瘤细胞停止分裂,达到41℃可杀死癌细胞或引起DNA损伤。通过特制的射频能激发组织细胞进行等离子震荡,离子相互撞击产生热量可使温度达80~100℃,组织脱水导致局部凝固性坏死,同时肿瘤周围血管凝固形成反应带,不能继续向肿瘤供血,有利于防止转移[6]。本文联合治疗组RR以及1、2、3年生存率均较单纯TACE组明显提高,其原因为:①RFA通过离子震荡产热,直接引起肿瘤细胞凝固性变性,协同TACE直接引起肿瘤细胞坏死;②肿瘤组织坏死吸收后成为内源性致热源[7],激发机体抗肿瘤免疫功能;③肿瘤热消融治疗后合成一种应激性蛋白——热休克蛋白HSP70[8],增强肿瘤特异性抗原提呈作用;④高温灭活的肿瘤组织因其细胞免疫表型变化而产生瘤苗作用[6],刺激机体产生特殊的抗肿瘤免疫效应。此外,肿瘤组织的灭活解除了机体的免疫抑制,患者全身情况的改善也有助于免疫功能的恢复。
[1]Llovet JM,Bruix J.Systematic review of randomized trials for unresectable hepatocellular carcinoma:chemoembolization improves survival[J].Hepatology,2003,37(2):429-442.
[2]WLu,YH Li,XF He,et al.Necrosis and apoptosis in hepatocellular carcinomafollowing low-dose versus high-dose preoperative chemoembolization[J].Cardiovascul interven radiology,2008,31(6):1133-1140.
[3]Nakao N,Kamino K,Miura K,et al.Transcatheter arterial embolization in hepatocellular carcinoma:a long-term follow-up[J].Radiation Medicine,1992,10(1):13.
[4]李欣,郑传胜,冯敢生,等.化疗栓塞后VEGF的表达及其与微血管密度和细胞增殖关系的实验研究[J].临床放射学杂志,2004,23(2):162-165.
[5]Takayasu K,Arii S,Ikai I,et al.Prospective cohort study of transarterial chemoembolization for unresectable hepatocellular carcinoma in 8510 patients[J].Gastroenterology,2006,131(2):461-469.
[6]陈自平,杨宏丽.肝癌射频消融治疗现状[J].山东医药,2008,48(16):103-104.
[7]韩治宇,董宝玮,梁萍.肝癌射频和微波热消融治疗的肿瘤免疫学进展[J].中国医学影像学杂志,2007,15(2):139-141.
[8]杨文茹,王悦华,李非.肝癌射频消融治疗对机体免疫功能的影响[J].临床外科杂志,2009,17(1):41-42.
