美沙拉嗪对2,4,6-三硝基苯磺酸诱导溃疡性结肠炎大鼠脾脏组织NF-κB p65表达的影响
2013-06-21柯金山柯琴梅
柯金山,吴 霁,柯琴梅,范 恒
(1上海杨思医院,上海200126;2南昌大学第三附属医院;3华中科技大学同济医学院附属协和医院)
目前认为,免疫因素在溃疡性结肠炎的发病中起重要作用[1]。NF-κB是具有多向转录调节作用的蛋白质,NF-κB活化后,可促使巨噬细胞、中性粒细胞、树突状细胞分泌细胞因子(如IL-1、IL-6、IL-8、TNF-α等)、黏附分子、急性期蛋白分子,在溃疡性结肠炎的发生及在免疫反应中起重要作用[1,2]。美沙拉嗪是一种新型5-氨基水杨酸控释剂,对溃疡性结肠炎有良好的疗效而无明显不良反应。已有研究表明,美沙拉嗪可抑制大鼠结肠组织NF-κB的表达发挥治疗溃疡性结肠炎的作用[3]。脾脏是T细胞居住场所以及细胞免疫应答场所,在固有免疫和适应性免疫反应中都起着重要作用[4],有研究表明,脾脏T细胞数目及功能与机体免疫反应呈正相关[5,6]。目前尚未见关于美沙拉嗪治疗对脾脏组织NF-κB表达影响的相关报道。因此,2010年4月~2011年8月,我们应用2,4,6-三硝基苯磺酸(TNBS)诱导大鼠溃疡性结肠炎,观察美沙拉嗪治疗对脾脏组织NF-κB mRNA和蛋白表达的影响。
1 材料与方法
1.1 材料 雄性SD大鼠46只,SPF级,体质量(250±20)g,由华中科技大学同济医学院动物中心提供,在湿度为50% ~70%、温度为20℃动物房内饲养;实验动物质量合格证为 SCXK(鄂)2004-0007,使用许可证为 SYXK(鄂)2004-0028。5%的TNBS购于美国Sigma公司;Trizol购于Invitrogen公司;RNA提取试剂盒DP430、cDNA第一链合成试剂盒KR104-02、RNase抑制剂DP418购于天根公司;引物合成于金斯瑞公司;SYBR Green PCR Master Mix(2X)#K0242购于Fermentas;实时荧光定量PCR仪ABI7500。引物由Primer6.0软件设计,每对引物序列如下:NF-κB p65上游引物5'-GACCTGGAGCAAGCCATTAG-3', 下 游 引 物 5'-ATCTTGAGCTCGGCAGTGTT-3';扩增产物片段长度为215 bp,退火温度 51℃。内参 β-actin上游引物:5'-GTCCCTCACCCTCCCAAAAG-3',下游引物:5'-GCTGCCTCAACACCTCAACCC-3';扩增片段长度为265 bp,退火温度55.7℃。RIPA裂解液(强)、BCA蛋白浓度测定试剂盒购于碧云天公司;PVDF膜购于Millipore;相关一抗购于Bioworld;二抗购于博士德公司;ECL底物液购于Thermo;电泳槽、Millipore电转仪购于北京六一仪器厂;美沙拉嗪(0.5 g×10袋/盒)为法国爱的发制药集团产品。
1.2 方法
1.2.1 模型建立及药物干预 将42只大鼠随机分为空白对照组、结肠炎模型组和美沙拉嗪治疗组,每组14只。除空白对照组外,其他组大鼠均在禁食不禁饮24 h后给予5%的TNBS灌肠。首先用10%的水合氯醛以3 mL/kg腹腔注射麻醉后,将内径2 mm的橡胶导尿管缓缓插入大鼠肛门约8 cm,将50%的乙醇溶液0.25 mL注入后继续注入5%的TNBS液0.3 mL。使药液缓慢进入肠道,将大鼠提尾倒置30 s,然后让大鼠平躺,待其清醒后自由饮食,自由进水。模型建成后,观察各组大鼠精神状态,大便颜色、形状、皮毛等变化2 d,美沙拉嗪组大鼠用含美沙拉嗪0.5 g/kg的蒸馏水溶液3 mL灌胃,每天1次,连续15 d;空白对照组和结肠炎模型组每天用蒸馏水3 mL灌胃,每天1次,连续灌胃15 d。每组大鼠死亡4只,因此每组实验大鼠最后各剩10只。第16天大鼠禁食不禁水24 h后处死,取大鼠的脾脏,每个脾脏分为2份,装于EP管中,用液氮冰冻保存。取3组大鼠中有明显病变的结肠组织石蜡包埋切片并HE染色,镜下观察3组大鼠结肠组织病理学改变。
1.2.2 RT-PCR法检测结肠炎大鼠脾脏组织中NF-κB p65mRNA的表达 按RNA提取试剂盒DP430的方法提取脾脏组织的RNA,并用分光光度计测量RNA的浓度,取5μL模板RNA、Oligo(dT)15(10 μmol/L)2μL、ddH2O(Rnase free)6μL混匀后放入PCR仪中,70℃ 5 min,立即置于冰上1 min;然后瞬时离心(1 200 r/min,3 s)并加入以下试剂:5×RT buffer 4 μL、HRP(RRI)/RNase Inhibitor 0.5 μL、M-MLV 0.5 μL、dNTP(2.5 mmol/L)2 μL,总体积为20μL的反应体系。逆转录条件:42℃ 30 min,99℃ 5 min,4℃ 5 min。各对引物序列见前文。扩增条件:95℃60 s预变性,进入PCR循环95℃15 s,51℃ 15 s,72℃ 45 s,40个循环,以β-actin为内参,对DOR、β-arrestin1、Bcl-2的产物相对定量,读取CT值,使用2-△△CT方法进行相对定量分析。
1.2.3 Western blot检测脾脏标本中 NF-κB p65 蛋白表达 取适量脾脏组织(250~500 mg),剪碎加1 mL RIPA裂解液(强),匀浆抽提总蛋白,并按BCA蛋白质定量试剂盒操作说明操作,测定NF-κB p65蛋白浓度。取70μg总蛋白上样电泳,用10%的PAGE胶,根据预染Marker的显示,判断目的蛋白得到充分分离后,停止电泳。取出凝胶,根据Marker切下目的条带,用蒸馏水冲洗,剪与PAGE凝胶相同大小的PVDF膜和滤纸,PVDF膜用甲醇浸泡数秒后和滤纸一同浸泡于电转缓冲液中。按照黑色板→纤维垫→滤纸→凝胶→PVDF膜→滤纸→纤维垫→白色板依次放好,夹紧板后放入转膜仪内,黑色板的一面对照黑色负极。转膜条件:200 mA,120 min;用含5%脱脂奶粉的TBST(封闭液)浸泡PVDF膜,室温摇床封闭2 h。用封闭液1∶700稀释NF-κB p65、1∶1 000 稀释 GAPDH 相应一抗,使PVDF膜浸泡于一抗孵育液中,4℃ 孵育过夜。TBST充分洗涤PVDF膜5~6次,每次5 min,用封闭液1∶10 000稀释羊抗兔二抗,使PVDF膜浸泡于二抗孵育液中,室温摇床孵育2 h,显色曝光。TBST充分洗涤PVDF膜5~6次,结果采用光密度扫描灰度值分析。
1.2.4 统计学方法 应用国际标准统计软件SPSS17.0统计分析,计量数据采用¯x±s表示,多组间两两比较采用SNK-q检验。P≤0.05为差异有统计学意义。
2 结果
2.1 大鼠结肠组织病理改变 结肠炎模型组中固有层和黏膜层内可见弥漫性中性粒细胞、淋巴细胞、浆细胞浸润,结肠黏膜腺体排列紊乱,杯状细胞减少。正常结肠组织黏膜和固有层结构完整,腺体排列较整齐。美沙拉嗪治疗组淋巴细胞等炎性细胞浸润较模型组减轻,黏膜及固有层结构相对完整,杯状细胞较模型组多,腺体排列相对整齐。见图1。
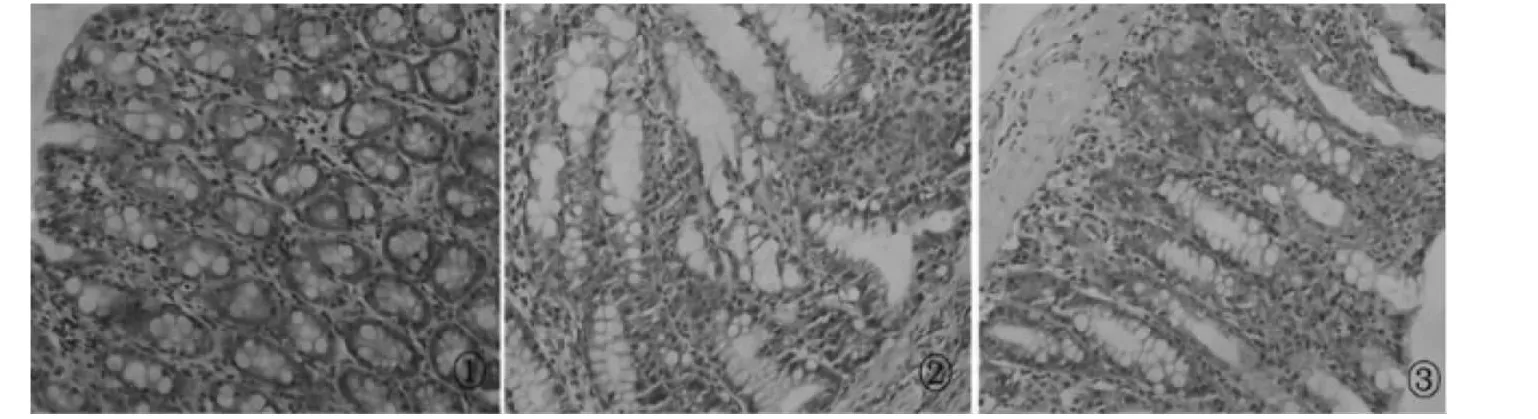
图1 大鼠结肠黏膜组织病理变化(HE,×400)
2.2 大鼠脾脏组织中NF-κB p65 mRNA的相对表达 各组大鼠脾脏组织中NF-κB p65 mRNA表达见图2。与空白对照组相比,结肠炎模型组 NF-κB p65 mRNA 表达升高(1.76 ± 0.04 vs 1.02 ±0.04,P<0.05);与结肠炎模型组相比,美沙拉嗪治疗组NF-κB p65 mRNA 表达下降(1.26 ±0.03 vs 1.76 ±0.04,P<0.05);且美沙拉嗪治疗组与空白对照组NF-κB p65 mRNA表达差异无统计学意义(1.26±0.03 vs 1.02 ±0.04,P >0.05)。
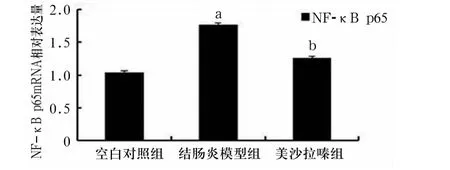
图2 各组大鼠脾脏组织NF-κB p65mRNA的表达
2.3 各组大鼠脾脏组织中NF-κB p65蛋白相对表达 各组大鼠脾脏组织中NF-κB p65的蛋白表达见图3。与空白对照组相比,结肠炎模型组 NF-κB p65 蛋白表达升高(1.65 ±0.40 vs 0.94 ±0.08,P <0.05);与结肠炎模型组相比,美沙拉嗪治疗组NF-κB p65 的蛋白表达下降(1.03 ±0.16 vs 1.65 ±0.40,P<0.05);且美沙拉嗪治疗组与空白对照组NF-κB p65的蛋白表达差异无统计学意义(1.03±0.16 vs 0.94 ±0.08,P >0.05)。
3 讨论
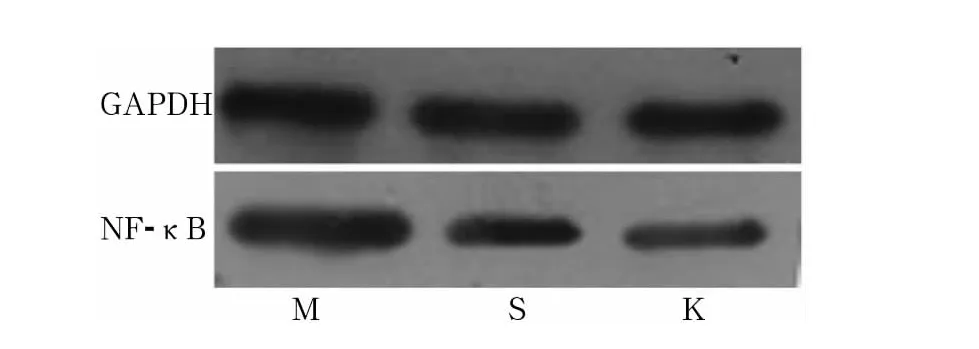
图3 各组大鼠脾脏组织中NF-κB p65蛋白的表达
溃疡性结肠炎是一种慢性非特异性肠道炎症性疾病,其病因和发病机制仍不清楚。目前大多数研究认为溃疡性结肠炎的发病机制主要由免疫反应介导,并与遗传、感染、环境因素等密切相关的慢性炎性疾病,其中细胞因子在溃疡性结肠炎发病中起着重要作用。
NF-κB是具有多向转录调节作用的细胞因子。许多与炎症和免疫反应关系密切的细胞因子基因的启动子部位均含有κB位点,活化的NF-κB能与特定的κB位点结合,启动调节参与炎症反应、免疫反应有关基因的转录,在机体的炎症、免疫反应方面发挥重要作用[7]。正常情况下,机体免疫系统处于一种平衡状态:一方面通过T细胞活化与增殖去除病毒、细菌等抗原,另一方面通过T细胞凋亡抑制T细胞过度增殖和活化,从而使T细胞凋亡受抑。体内T细胞将过度活化与增殖,并分泌炎性因子如IL-4、IL-5、IL-13、TGF-β 等[1],导致局部炎症发生。因此,细胞因子、T细胞凋亡与炎症的发生关系密切。
研究表明,NF-κB与细胞凋亡存在双向调节关系,既可抑制细胞凋亡,也可促进细胞凋亡。是抑制凋亡还是促进凋亡依赖于细胞类型和刺激因素的不同,但具体机制还不十分清楚[8~10]。
美沙拉嗪为近年研制的一种新型5-氨基水杨酸剂,对溃疡性结肠炎有良好的疗效而无明显不良反应。已有研究表明,美沙拉嗪清除氧自由基,抑制肠黏膜的脂肪酸氧化,降低肠上皮通透性,减轻肠道炎症[11],抑制大鼠结肠组织NF-κB的表达发挥治疗溃疡性结肠炎的作用[12,13]。最近廖奕等[14]研究提示,氧化苦参碱可抑制结肠组织Delta阿片受体-βarrestin1-Bcl-2的信号转道,促进效应性T细胞凋亡和抑制效应性T细胞活化,改善溃疡性结肠炎的症状。
脾脏是T细胞居住及细胞免疫应答场所,在免疫反应中起着重要作用[4],而且研究表明脾脏T细胞数目及功能与机体免疫反应呈正相关[5,6]。为了研究美沙拉嗪治疗是否抑制脾脏组织NF-κB的表达而发挥治疗溃疡性结肠炎的作用,本研究应用TNBS诱导大鼠溃疡性结肠炎,观察美沙拉嗪治疗对大鼠脾脏组织NF-κB表达的影响,。结果提示美沙拉嗪可抑制溃疡性结肠炎大鼠脾脏组织NF-κB p65的表达,改善溃疡性结肠炎的症状。美沙拉嗪治疗溃疡性结肠炎的机制可能是:第一,直接作用于结肠组织(如清除氧自由基,抑制肠黏膜的脂肪酸氧化,降低肠上皮通透性,减轻肠道炎症;下调结肠组织NF-κB p65的表达,减少结肠局部炎性细胞因子的表达。第二,可能通过下调作为T细胞居住场所以及细胞免疫应答场所的脾脏组织NF-κB p65的表达,减轻T细胞的凋亡抑制,减少体内T细胞过度活化与增殖,从而减少炎性因子的分泌,最终减轻肠道炎症,发挥治疗溃疡性结肠炎的作用。第三,通过影响其他细胞因子或信号传导途径发挥治疗溃疡性结肠炎的作用。未来以CD+4T细胞及NF-κB为靶向,研制相关的单克隆抗体或者其他药物降低T及NF-κB p65的数目和反应性,可望为治疗结肠炎提供更好的方法。
[1]Shih DQ,Targan SR.Immunopathogenesis of inflammatory bowel disease[J].World J Gastroenterol,2008,14(3):390-400.
[2]Liang Y,Zhou Y,Shen P.NF-κB and its regulation on the immune system[J].Cell Mol Immunol,2004,1(5):343-350.
[3]Fan H,Shen L,Tang Q,et al.Effect of Wumeiwan on cytokines TNF-alpha,IL-6,IL-8,IL-10 and expression of NF-kappaBp65 in rats with ulcerative colitis[J].J Huazhong Univ Sci Technolog(Med Sci),2009,29(5):650-654.
[4]Velásquez-Lopera MM,Correa LA,García LF.Human spleen contains different subsets of dendritic cells and regulatory T lymphocytes[J].Clin Exp Immunol,2008,154(1):107-114.
[5] Strober W,Fuss IJ,Blumberg RS.The immunology of mucosal models of inflammation[J].Annu Rev Immunol,2002,20:495-549.
[6]Neurath MF,Finotto S,Glimcher LH.The role of Th1/Th2 polarization in Mucosal immunity[J].Nat Med,2002,8(6):567-573.
[7]梁海清,李俊玲,王世和.NF-κB在溃疡性结肠炎中的作用[J].国际消化病杂志,2008,28(1):40-41,78.
[8]於亮亮,于皆平,罗和生,等.核因子-kB与细胞凋亡关系的研究进展[J].世界华人消化杂志,2003,11(10):1628-1631
[9]苏剑东,吴灵飞.NF-κB与细胞凋亡[J].世界华人消化杂志,2007,15(12):1411-1416.
[10]Chen X,Kandasamy K,Srivastava RK.Differential roles of RelA(p65)and c-Rel subunits of nuclear factor kappa B in tumor necrosis factor-related apoptosis-inducing ligand signaling[J].Cancer Res,2003,63(5):1059-1066.
[11]郝悦,黄裕新,王景杰.美沙拉嗪对溃疡性结肠炎粘膜MDA及SOD 的影响[J].第四军医大学学报,2002,23(1):42.
[12]罗南,颜玉.美沙拉嗪对大鼠溃疡性结肠炎NF-κB和TGF-β表达的影响[J].黑龙江医药科学,2010,33(4):11-12.
[13]梁丽,范恒,段雪云.β 2AR、β -arrestin2、NF-κ B p65在溃疡性结肠炎大鼠中的表达及乌梅丸的干预作用[J].世界华人消化杂志,2010,18(16):1650-1655.
[14]廖奕,范恒,陈小艳,等.β-arrestin1在实验性大鼠结肠炎发生机制中的作用及氧化苦参碱的干预作用[J].中国中西医结合杂志,2010,30(10):1067-1072.
