电镀酸锡废水中不同金属离子的分离工艺
2013-06-17汪葵蒋小友阮树堂
汪葵,蒋小友,阮树堂, *
(1.江西环境工程职业学院,江西 赣州 341000;2.广州市龙源环保科技有限公司,广东 广州 511483)
据不完全统计,我国约有规模不等的电镀厂点2 万 余家,年排电镀废水约40 亿m3[1]。电镀废水给环境带来不可估量的污染和损失。目前,处理电镀废水多采用化学沉淀法、蒸发浓缩法、电解法、离子交换法、吸附法、膜分离法等[1]。笔者在实验室中采用化学方法成功地处理了某电镀厂的光亮酸锡废水。该厂所产生的酸锡废水的pH 为0.45,主要含有Sn、Fe、Co、Ni、Na 等几种金属阳离子,阴离子主要为,废水中含量最多的金属阳离子是锡离子,其质量浓度是137.3 mg/L,Ni、Fe、Co 分别为46.1、11.4 和8.6 mg/L,Na 为微量。
1 实验原理
处理废水的流程如图1所示。
利用溶液中各种金属离子在不同的pH(见表1)下沉淀,达到分离金属、去除杂质的目的。表1说明不同金属离子浓度随溶液pH 不同,沉降情况不同。另外,若溶液pH 太高,部分金属离子的氢氧化物会出现溶解。
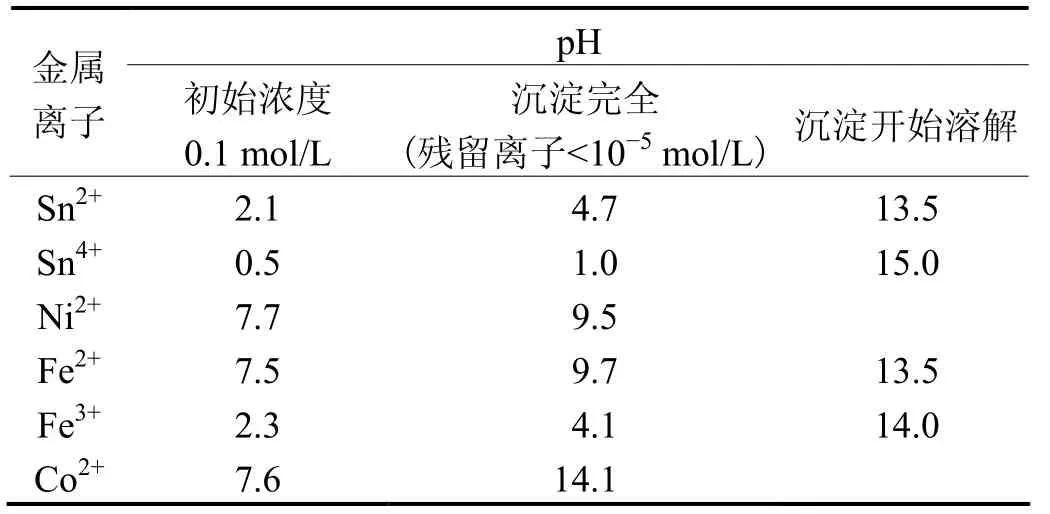
表1 不同金属离子沉降的pH Table 1 pHs for precipitation of different metal ions
1.1 金属离子的分离
由于废水溶液的pH <0.5,为强酸性,锡、铁以Sn2+、Fe2+形式存在,用10%的氢氧化钠溶液调pH = 4.7,充分搅拌、过滤,得到Sn(OH)2沉淀,再用硫酸溶解Sn(OH)2沉淀,便得到较纯净的硫酸亚锡和硫酸溶液,可以直接加入到酸锡镀缸中,实现资源再利用。
1.2 除铁

图1 处理电镀酸锡废水的工艺流程 Figure 1 Process flow for treatment of acid tin plating wastewater
除去锡后的溶液pH 约为4.7,在此pH 下,Fe、 Co、Ni、Na 等金属在溶液中仍然以离子状态存在。将该溶液加热到80 ~ 90 °C,加入10%的H2O2后充分搅拌,溶液中Fe2+完全被氧化成Fe3+,Fe3+形成Fe(OH)3絮状沉淀,冷却、过滤,便可以把废水中的铁分离并且除去。
1.3 分离镍、钴
经过除锡、铁后的水质pH 约为4.7,溶液中含有的金属离子是Co、Ni 和Na。将溶液加热到30 ~ 40 °C,调节溶液的pH = 5 ~ 6,加入NaClO 溶液,完成镍、钴的分离。由标准电极电位表可以查出,镍和钴的电极电位分别为φ(Co3+/Co2+)= 1.84 V,φ(Ni3+/Ni2+)= 1.95 V,而次氯酸根反应生成氯离子的反应的标准电极电位为φ(ClO-/Cl-)= 1.49 V。由此可知,在标准状态下,NaClO 难以把二价的钴氧化成三价的钴;但是在φ(Co3+/Co2+)≤1.49 V 的情况下,ClO-就可以把二价的钴氧化成三价的钴,而Ni2+比较稳定,因此使Co2+氧化并生成Co(OH)3沉淀,可以达到镍、钴的分离。分离了钴后的溶液只含有Ni、Na 金属离子,用10%的氢氧化钠溶液调pH = 9.5 后充分搅拌,过滤即得Ni(OH)2沉淀,用硫酸溶解Ni(OH)2沉淀,就会得到硫酸镍溶液,再经进一步浓缩,并对浓缩溶液的纯度进行取样分析,经过电解除杂,即可得到符合电镀要求的硫酸镍溶液。因此所得到的硫酸镍也可以直接用于镀镍的缸中,实现资源的再利用。
1.4 废水脱盐
电镀车间所产生的酸锡废水,经过除去Sn、Fe、Co、Ni 后,其中主要含有硫酸钠,这部分废水处理的方案相当广泛:(1)废水经过反渗透机后,浓水进行晒盐,反渗透后出水的电导率在10 μS/cm 以下,可以直接返回电镀车间再利用或者排入河流;(2)因水中含很高的钠,可以用其作为离子交换柱再生,从而达到降低盐分的目的。
2 实验过程及结果讨论
此工艺主要是利用各金属离子在不同的pH 条件下形成沉淀而从废水中除去相应的金属离子,控制的主要条件为废水的pH,调节废水至不同的pH,再加入相应的氧化剂、还原剂或沉淀剂,最终达到分离金属离子的目的。
2.1 金属锡的分离
每次取废水500 mL,用10% NaOH 调节其pH 分别为1.0、2.0、3.0、4.0、4.5、5.0、5.5、6.0 进行试验。试验后过滤,取上清液用北京谱析TAS-986 型原子吸收分光光度计检测废水中金属离子浓度,结果见表2。

表2 金属离子浓度在不同pH 条件下的变化情况 Table 2 Variation of concentrations of metal ions at different pHs
从实验数据来看,调节废水的pH <6 对镍、铁、钴的影响不大,但是对锡的影响较大,特别是废水的pH从4.01变化到4.91时,废水中锡的含量从58.9 mg/L迅速下降到3.6 mg/L。对pH = 4.0 ~ 5.0 的范围再进行细化实验,观察废水中锡离子浓度的变化,实验如下:取废水各1 000 mL,调节成不同pH 后考察金属离子浓度变化情况,结果列于表3。

表3 金属离子浓度在pH = 4.0 ~ 5.0 范围内的变化情况 Table 3 Variation of concentrations of metal ions in pH range of 4.0-5.0
从表3可以明显看出,二价锡离子在pH = 4.0 ~ 5.0的范围内变化明显。当废水的pH 低于4.71 时,二价锡离子浓度随着pH 的升高而降低;当废水的pH 高于4.71 时,二价锡离子浓度随着pH 的升高而升高,说明二价锡离子沉淀后又发生部分溶解。因此,最佳沉淀二价锡离子的pH 为4.71。
2.2 金属铁的分离
将分离锡后的废水加热至不同温度,并同时加入10%的H2O26 mL,充分搅拌后二价铁迅速转变成三价铁,然后冷却、过滤,取上清液,用原子吸收分光光度计检测废水中金属离子浓度,结果见表4。
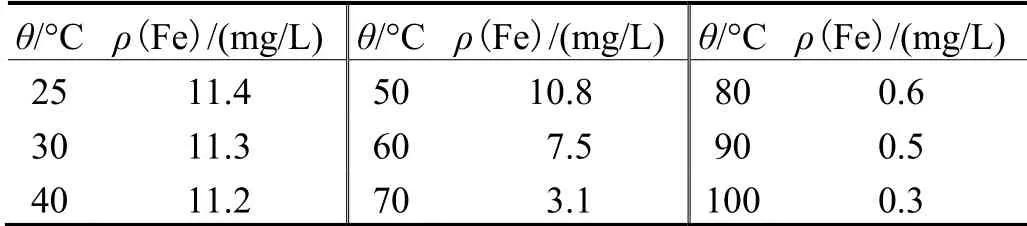
表4 温度对废水中铁离子浓度的影响 Table 4 Effect of temperature on concentration of iron ion in wastewater
从表4可以看出,在加热的过程中不断搅拌,铁离子浓度随着废水温度的升高而降低,除去铁离子的最佳温度范围是80 ~ 90 °C。此时既能去除铁离子,又使能耗不至于过高。
2.3 金属镍、钴分离
在废水去除锡、铁之后,对于有回收价值的钴与镍资源,需要重点分离。向除去锡和铁的废水中添加含有效氯10%的次氯酸钠,氧化废水中的二价钴为三价钴。各取废水100 mL,分别加入1、2、3、4、5、6、7 和8 mL 的次氯酸钠溶液,并调节废水的pH 为5 ~ 6,充分搅拌后分别检测上清液中钴的含量,结果列于表5。

表5 次氯酸钠用量对钴沉降的影响 Table 5 Effect of NaClO dosage on precipitation of cobalt
表5说明,二价钴可被次氯酸钠氧化生成三价钴,随后调节pH 可使三价钴完全沉降,从而除去了废水中的钴,得到比较纯净的氢氧化钴沉淀。再调节除去钴后废水的pH 至9.5 以上,镍形成Ni(OH)2沉淀,过滤得到纯净的镍渣,进而用硫酸溶解得到硫酸镍产品,并直接用于镀镍过程中,实现了镍资源的回收利用。
3 结论
采用化学的方法对光亮酸锡废水中不同的金属离子进行分别回收,实现了变废为宝。其过程如下:
(1) 用10%的氢氧化钠溶液调节废水的pH 为4.7,废水中锡元素形成氢氧化亚锡沉淀,过滤后得到的氢氧化亚锡固体以浓硫酸进行溶解,就可以把硫酸与硫酸亚锡的混合溶液补充到镀锡槽中。
(2) 往分离锡元素后的废水中加10%的双氧水,加热到80 ~ 90 °C,此时亚铁完全被氧化成三价铁,再调节废水的pH 为4.1,三价铁完全沉淀,从而除去铁元素。
(3) 向分离铁元素后的废水加入10%的次氯酸钠40 mL,把废水中的二价钴完全转化成三价钴,再调节废水pH 为5 ~ 6,分离钴元素。
(4) 调节废水pH 至9.5,对废水中的镍元素进行分离。
根据废水中各金属元素在不同pH 条件下的沉淀特性,对废水中的不同金属离子进行了分离,并实现资源化。
[1]胡翔,陈建锋,李春喜.电镀废水处理技术研究现状及展望[J].新技术新工艺,2008 (12): 5-10.
[2]王犇,孟韵,原建国.从钴镍切削废料中回收有价金属的方法[J].无机盐工业,2006,38 (5): 45-46,59.
