一个基于NBD-NH2荧光团的增强型pH荧光探针及其细胞造影研究
2013-06-14朱成成何卫江
李 静 朱成成 何卫江
(南京大学化学化工学院配位化学国家重点实验室,南京 210093)
许多细胞生理过程如细胞增殖和凋亡[1]、黏附[2]以及胞内离子输运与动态平衡[3]等都涉及到质子化或去质子化过程,并因细胞微环境pH的改变而发生变化,因此精确检测细胞内pH(pHi)对于理解细胞的生理和病理过程非常重要。相比于其他pH测定方法,荧光探针法进行pHi检测由于灵敏度高、选择性好、无损伤等优点已成为pHi检测的主要手段。由于该方法可对pHi进行实时原位检测,为理解胞内快速生理过程提供更为真实可靠的信息,因此pH荧光探针技术已是细胞生物学研究的重要工具之一,而发展高性能pHi荧光探针则将为该技术的应用奠定良好基础。
文献中已经报道的pH荧光探针大多是荧光素[4]、罗丹明[5]和氟硼二吡咯甲川类(BODIPY)荧光分子的衍生物[6]。这些探针主要通过识别基团的质子化/去质子化来改变信号团的荧光而实现pH响应。然而许多具有pH荧光响应能力的探针由于生物相容性低、细胞膜透过性差和激发/发射波长短等不足难以实现pHi的荧光造影[7-9]。由于细胞内pH大多在近中性,生理和病理条件下的pH变化也往往发生在近中性或弱酸性范围内,因此发展响应范围在近中性或弱酸性范围内的pH探针十分重要。前述的荧光素、罗丹明和BODIPY是细胞研究中最常用的几种荧光团,因此发展基于其他荧光团的pH探针也有利于进行细胞多重共染研究。由于4-氨基-7-硝基-1,2,3-苯并呋咱(NBD-NH2)荧光团是基于分子内电荷转移机制(ICT)的荧光团,其较大的Stokes位移有利于克服造影中激发光的干扰。其激发和发射波长都在可见光区域,有利于克服细胞造影过程中的自发荧光干扰和光毒性等问题。该荧光团同时具有合适的量子产率、良好的生物相容性和光 稳定性[10-11],已被用于氨基酸[12]、羧甲基纤维素[13]、Zn2+[14]、Hg2+[15]等荧光探针的构建。因此本研究拟利用NBDNH2荧光团来构建在弱酸或近中性条件下具有pH响应能力的荧光探针。
本研究中我们选用NBD-NH2作为荧光团、N-(4-吡啶甲基)乙二胺作为质子的响应基团设计合成了一个基于光致电子转移(PET)机制的pH荧光探针NBD-Py,它的合成路线如式1所示。研究同时还合成了该探针不含吡啶的类似物NBD-en,用以对比它们的pH荧光响应行为。Taliani等曾合成该类似物作为中间体与苯基吲哚二酮偶联作为外周型苯二氮卓类受体的荧光探针[16]。探针NBD-Py中的N-(4-吡啶甲基)乙二胺作为质子受体,其吡啶N和二烷基胺N均可通过PET效应猝灭NBD-NH2的荧光[17]。该受体质子化时可阻断PET效应并导致探针荧光增强。设计中选择4-吡啶甲基而非常见的2-吡啶甲基的连接方式,目的是尽量避免形成适于金属配位的1,4-螯合结构以降低金属对探针pH响应行为的干扰。其类似物NBD-en的质子受体为乙二胺,质子化乙二胺的pKa约为10.66,但NBD-en本身的pKa约在8.29,无法应用于中性或弱酸性pH的检测。虽然质子化吡啶的pKa约为5.19,本研究发现吡啶与乙二胺在NBD-Py中的组合可以使整个受体质子化后的表观pKa接近7.0,从而获得对弱酸和近中性pH响应的能力。
1 实验部分
1.1 试剂和仪器
合成NBD-Cl的原料2,6-二氯苯胺为国内工业品,4-吡啶甲醛购买于Sigma公司。NBD-en根据文献合成[16]。合成实验中所用溶剂和其他试剂均来自南京大学化学化工学院采购的国产试剂,使用前未做进一步纯化。所有光谱测试中使用的溶剂都是购自Aldrich公司的光谱纯溶剂,所用水是MILIPORE处理的超纯水。核磁共振谱在Bruker DRX-500核磁仪 (500 MHz)上采集,高分辨质谱由Bruker AutoflexⅡMALDI-TOF测定。荧光光谱由Fluoromax-4荧光光谱仪记录,紫外-可见光谱用Perkin Elmer Lambda 35紫外可见分光光度计测定。pH值用Sartorius PB-10精密pH计测定。荧光造影用OLYMPUS IX81激光共聚焦荧光显微镜完成。
1.2 NBD-Py的合成和表征
NBD-Py的合成路线如式1所示,其中NBD-Cl和N-(4-吡啶甲基)乙二胺分别根据文献方法在本实验室合成[18-19]。将 10 mL NBD-Cl(400 mg,2 mmol)甲醇溶液搅拌下逐滴加入到N-(4-吡啶甲基)乙二胺(300 mg,2 mmol)的甲醇溶液中(10 mL)。在室温条件下维持反应并用TLC(VCH2Cl2/VCH3OH=20)跟踪至原料反应完全。减压脱去溶剂后残余物通过硅胶柱层析
(VCH2Cl2/VCH3OH=25)分离得到橘黄色固体NBD-Py(106 mg,yield 16.9%)。1H NMR(500 MHz,(CD3)2SO)δ:2.84(t,J=6.2,2H),3.60(t,J=6.2,2H),3.78(s,2H),6.45 (d,J=8.9,1H),7.34 (d,J=5.7,2H),8.47 (d,J=5.7,2H),8.51(d,J=8.9,1H)。13C NMR(125 MHz,(CD3)2SO) δ:43.92,47.02,51.70,99.73,121.04,123.41,138.32,144.60,144.94,145.90,149.82and150.23。ESI-HRMS(positive mode,m/z):calcd.315.1206;Found 315.1201 for[M+H]+。
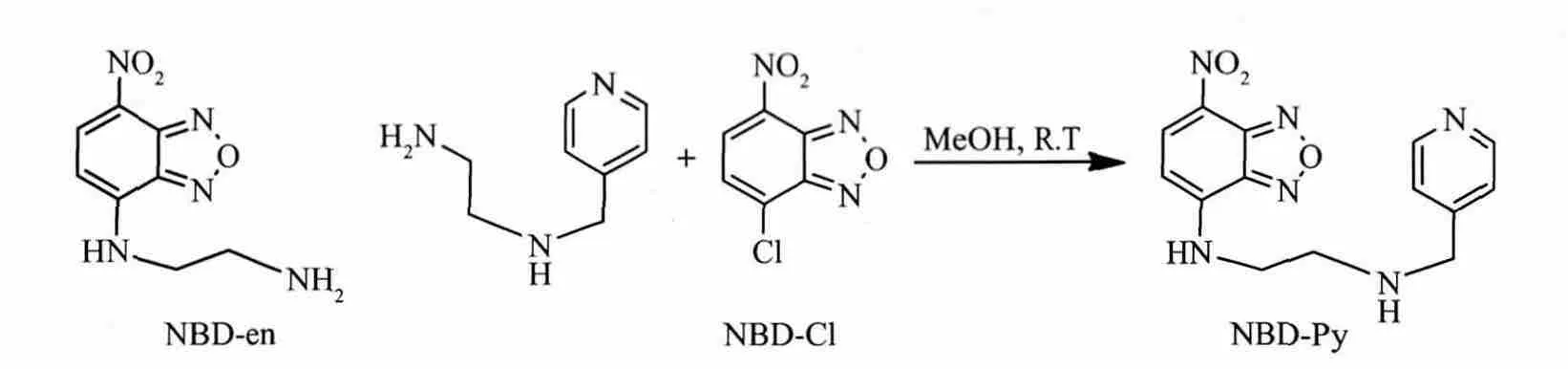
式1 化合物NBD-en和探针NBD-Py的合成Scheme 1 Compound NBD-en and the synthesis of NBD-Py
1.3 NBD-Py和NBD-en的光谱测试
将NBD-Py的储备液用HEPES缓冲溶液(50 mmol·L-1HEPES,100 mmol·L-1KNO3;pH 7.40)稀释成 10 μmol·L-1溶液(VDMSO∶VHEPES=1∶99),然后分别测量探针的荧光光谱和紫外-可见吸收光谱。量子产率测定时选用 4-甲氨基-7-硝基-1,2,3-苯并呋咱(NBD-NHCH3)作为基准物[20],以其最大激发波长458 nm为NBD-Py探针的激发波长,对基准物和探针分别进行紫外吸收测定与荧光光谱测定。量子产率通过如下公式进行计算[21]:

Φf表示量子产率,公式中下标R与S分别代表基准物与样品,A表示相应激发波长处的吸光度,n为样品溶液的折射系数,F表示化合物溶液荧光发射光谱的积分面积。
NBD-Py的pH滴定和响应可逆性实验在含1%DMSO的水溶液中进行。储备液用H2O稀释成10 μmol·L-1。溶液pH的调节是通过加入少量(几微升)的HCl或NaOH水溶液,在迅速测定pH后快速完成紫外-可见吸收光谱或荧光光谱测试。NBD-Py对金属离子的荧光响应性能在DMSO/HEPES(1∶99,V/V,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.40)中测试,测试浓度是 10 μmol·L-1,其中碱金属和碱土金属的离子浓度是探针浓度的1 000倍,而其他金属离子和探针浓度相等。
1.4 NBD-Py探针的细胞造影研究
利用荧光共聚焦显微镜考察了NBD-Py对HeLa细胞内pH的造影能力。细胞内pH的调节是通过在孵育介质中加入尼日利亚菌素 (10 ng·mL-1)使细胞内外pH一致,再通过调节孵育介质的pH实现的[22]。具体操作为室温下将HeLa细胞与探针NBD-Py(10 μmol·L-1)共同孵育 30 min,孵化的介质为含有尼日利亚菌素且具有不同pH(4.0,4.5,5.0,5.5,6.0,6.5和7.0)的PBS缓冲溶液。造影直接用Olympus IX81激光共聚焦荧光显微镜完成。通过和溶酶体荧光染色试剂 (Lysotracker Red DND-99)对HeLa细胞共染确定了NBD-Py探针的溶酶体靶向性能。
2 结果与讨论
2.1 NBD-Py和NBD-en的紫外和荧光光谱
首先我们研究了NBD-Py探针在DMSO/HEPES(1∶99,V/V,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.40)体系中的光谱行为。如图1所示,NBD-Py探针最大紫外吸收波长为475 nm(消光系数6.5×104L·mol-1·cm-1),在 344 nm 处还有一弱吸收峰(消光系数 2.1×104L·mol-1·cm-1)。它们可以分别指认为探针分子4-氨基与7-硝基间的ICT效应所引起的吸收峰(ICT带)和NBD荧光团本身的π-π*跃迁吸收带。其类似物NBD-en的ICT和π-π*吸收峰的位置与NBD-Py基本相似,消光系数也相似(467 nm,4.5×104L·mol-1·cm-1;336 nm,1.5×104L·mol-1·cm-1)。探针NBD-Py的最大激发波长与最大发射波长分别为465和539 nm,均处于可见光区,其较大的Stokes位移(74 nm),有助于降低造影过程中激发光的干扰。其类似物NBD-en的最大激发和发射波长分别为464和533 nm。从图1可以看出NBD-Py的量子产率要小于NBD-en,而实际以NBD-NHCH3作为基准物进行的量子产率测定也表明NBD-Py的量子产率为0.011,而NBD-en则为0.028。

图1 NBD-en(10 μmol·L-1,实线)和 NBD-Py(10 μmol·L-1,虚线)在含1%DMSO HEPES缓冲溶液(50 mmol·L-1,100 mmol·L-1KNO3,pH 7.40) 中 的 紫外-可见吸收光谱和荧光发射光谱Fig.1 UV-Vis absorption and emission spectra of NBD-en(10 μmol·L-1;solid line)and NBD-Py(10 μmol·L-1;dashed line)in HEPES buffer(50 mmol·L-1,100 mmol·L-1KNO3,pH 7.40)containing 1%DMSO
2.2 NBD-Py的紫外可见和荧光pH滴定

图2 NBD-Py(10 μmol·L-1,VDMSO/VH2O=1/99)水溶液在不同pH条件下的吸收光谱Fig.2 UV-vis absorption spectra of NBD-Py(10 μmol·L-1)obtained in aqueous solution(VDMSO/VH2O=1/99)at different pH values
NBD-Py探针的pH紫外-可见光谱滴定实验是在含1%DMSO的水溶液中进行的。如图2所示,NBD-Py探针的吸收光谱在pH 3.4~10.97范围内变化不明显,474 nm处吸收有微弱的下降,而344 nm处的吸收有微弱上升,同时未观察到吸收峰的移动。作为ICT荧光团,其稳定的吸收光谱表明其作为电子给体的4-氨基在此pH范围内没有发生质子化或去质子化效应,然而这不能排除侧链氨基或吡啶发生质子化或去质子化作用。
NBD-Py的pH荧光滴定在同样的溶液中完成。如图3(a)所示,NBD-Py在pH 3.0~5.0之间具有较强的荧光,并且相对稳定。当pH进一步升高时NBDPy的荧光强度逐渐降低,直至当pH>8.0时,NBDPy的荧光强度再次趋于稳定。在pH逐渐升高的过程中其荧光发射波长未见移动,这也表明pH变化过程中NBD-NH2荧光团的ICT效应没有变化,也表明给电子基4-氨基未发生质子化,这也与紫外pH滴定的结果相一致。显然,NBD-Py在pH 5.0~8.5范围内显示的pH依赖的荧光强度变化与探针质子受体中侧链氨基或吡啶的质子化有关。当pH>8.0时,侧链氨基和吡啶均未质子化,相应N原子上的孤对电子可以发生光致电子转移(PET)而猝灭荧光团的荧光,NBD-Py显示较弱的荧光。当pH逐渐降低时,侧链氨基和吡啶逐渐发生质子化,相应的PET效应被抑制并导致荧光团荧光逐渐恢复,荧光强度逐渐增强。当pH<5.0时,侧链氨基和吡啶已被完全质子化,PET效应完全被阻断,荧光达到最强。NBD-Py荧光的pH依赖行为表明该探针是一个基于PET机制的pH荧光探针,其质子化导致的荧光增强倍数达到~9.0(FpH5.0/FpH8.5)。利用NBD-Py探针最大发射波长539 nm处的荧光强度对pH作图,得到图3(b)显示的荧光pH滴定曲线。利用Henderson-Hasselbach方程对该滴定曲线进行拟合的结果表明NBD-Py探针的pKa为~6.48[23]。这一数值表明该探针适合于中性到弱酸性pH的检测,达到了研究的设计目的。

图3 (a)NBD-Py水溶液(10 μmol·L-1,VDMSO/VH2O=1/99,λex=465 nm)在不同pH条件下的荧光发射光谱;(b)基于539 nm处荧光强度的pH滴定曲线(■)及pKa拟合曲线Fig.3 (a)Emission spectra of NBD-Py(10 μmol·L-1)in aqueous solution(VDMSO/VH2O=1/99)obtained at different pH values(pH 3.79~10.97);(b)Fluorescent pH titration profile based on the normalized emission intensity at 539 nm(■)and the related pKasimulation profile;λex=465 nm

图4 NBD-en 水溶液(10 μmol·L-1,VDMSO/VH2O=1/99,λex=465 nm)在不同pH的荧光发射光谱。插图为基于533 nm处荧光强度的pH滴定曲线(■)及pKa拟合曲线Fig.4 Emission spectra of NBD-en(10 μmol·L-1)in aqueous solution(VDMSO/VH2O=1∶99)obtained at different pH values(pH 3.10~12.04);Inset is the fluorescent pH titration profile based on the normalized emission intensity at 533 nm and the related pKasimulation profile;λex=465 nm
NBD-en的pH荧光滴定表明其荧光在pH<7.0时最强,而且其强度在此范围内不受pH影响。在pH 7.0~10.5范围时,该化合物的荧光强度随着pH值的升高而逐渐降低,而发射波长没有明显的移动。在pH高于10.0以上时荧光趋于稳定。在pH 7.0~10.5范围内pH依赖的荧光变化同样可以归结为侧链氨基在较低pH时(pH<10.0)发生质子化有效阻断侧链氨基的PET效应所致。NBD-en探针侧链氨基质子化导致的荧光强度增强倍数约为16(FpH6.91/FpH9.88)。拟合发现NBD-en的pKa约为8.29。比较NBD-Py与NBD-en的pKa可以发现吡啶的引入有效地将荧光分子中质子受体的pKa从8.29降低到6.48。一般认为仲胺的碱性要强于伯胺,所以NBDPy结合质子能力低于NBD-en的原因是吡啶结构本身的影响而非伯胺转变为仲胺所致。实际上在NBD-Py探针中存在着侧链氨基和吡啶的两个质子化过程,这两个质子化过程相互影响,导致了居中的表观pKa。显然,这一调节质子受体pKa的策略应可作为调节pH荧光探针pH响应范围的有效手段。
2.3 NBD-Py探针pH响应行为的抗金属干扰能力和可逆性
细胞中存在大量高浓度的化学物种,它们均可能与探针发生相互作用而影响探针的pH响应行为,尤其胞内的阳离子往往会与质子相竞争。其中高浓度的 Na+、K+、Ca2+、Mg2+和一些其他常见的过渡金属离子的影响往往比较明显。实用的胞内pH造影探针其pH响应行为应不受胞内其他金属离子的干扰。本研究对NBD-Py的抗金属干扰能力也进行了测试。测试的介质为pH 7.40的HEPES缓冲溶液,测试中引入高浓度的碱金属或碱土金属离子是为模拟细胞内环境。由图5(a)可以看出,当与探针等量的过渡金属离子如 Fe3+、Zn2+、Cu2+、Hg2+、Cd2+等加入到NBD-Py探针溶液中时,其荧光强度及发射波长均未发生明显的变化。另外加入探针1 000倍量的 Na+、K+、Ca2+或 Mg2+同样未影响探针的荧光。这一结果表明NBD-Py探针能专一地响应pH而不受胞内常见金属离子的干扰。这一优点应与设计中选择4-吡啶甲基修饰乙二胺尽量减少质子受体对金属的螯合作用有关。这些结果表明NBD-Py具有胞内pH造影的前景。

图5 (a)NBD-Py(10 μmol·L-1)在 HEPES 缓冲体系(VDMSO/VHEPES=1/99,50 mmol·L-1HEPES,100 mmol·L-1KNO3,pH 7.40)中对各种金属离子的荧光响应(根据 535 nm处荧光强度绘制,过渡金属离子浓度为10 μmol·L-1,K+、Na+、Ca2+、Mg2+浓度为 10 mmol·L-1);(b)NBD-Py 在 pH 4.50~9.45 间振荡时在 535 nm 处的荧光变化;λex=465 nmFig.5 (a)Fluorescence responses of NBD-Py(10 μmol·L-1)in aqueous solution(VDMSO/Vwater,1/99;50 mmol·L-1 HEPES,100 mmol·L-1KNO3;pH=7.40)to different metal cations based on the emission at 535 nm.The final concentration of Na+,K+,Ca2+and Mg2+is 10 mmol·L-1,respectively,while those for other cations are 10 μmol·L-1;(b)Fluorescence intensity of NBD-Py at 535 nm upon adjusting pH between 4.50 and 9.45 pH in a reversible manner;λex=465 nm
由于细胞内pH值往往发生振荡变化,并且非均匀分布,因此pH探针具有可逆响应能力十分重要。因此我们还对NBD-Py对pH响应的可逆性进行了测试。实验中我们循环调节测试溶液的pH使其pH在4.50和9.45之间振荡,并反复测试其荧光光谱。如图5(b)所示,NBD-Py的荧光至少在4个循环内在相同的pH下保持稳定,表明该探针具有较好的可逆响应pH的能力,可以实现对细胞内pH振荡变化的有效响应。
2.4 NBD-Py细胞造影研究

图6 NBD-Py对HeLa细胞内pH的激光共聚焦荧光造影图。HeLa细胞分别用含NBD-Py(10 μmol·L-1)的具有不同pH的PBS缓冲溶液孵育30min(25℃)进行造影测试。介质中同时含有尼日利亚菌素(10 ng·mL-1);(a)、(b)、(c)、(d)、(e)、(f)、(g)分别是在pH 4.0,4.5,5.0,5.5,6.0,6.5,7.0条件下孵育的细胞造影图,造影荧光通道为500~600 nm,激发波长为488 nm;(h)为经归一化后细胞内平均荧光强度对pH的变化曲线Fig.6 Confocal pHiimaging of HeLa cells stained by NBD-Py(10 μmol·L-1)at different pH values;The cells were incubated for 30 min with NBD-Py in PBS buffers of different pH at 25C,which containing nigericin(10 ng·mL-1);(a)pH 4.0;(b)pH 4.5;(c)pH 5.0;(d)pH 5.5;(e)pH 6.0;(f)pH 6.5;(g)pH 7.0;Band path:500~600 nm;excitation,488 nm;(h)Normalized average intracellular fluorescent intensity versus pHi

图7 在 pH 为 4.0室温条件下,用 10 μmol·L-1NBD-Py和 1 μmol·L-1LysoSensor Red DND-99孵化 30 min后的HeLa细胞共聚焦造影图;(a)HeLa细胞明场图;(b)488 nm激发时下由500到600 nm造影通道获得的造影图;(c)565 nm激发时下由570到600 nm造影通道获得的造影图;(d)为(b)和(c)的叠合图Fig.7 Confocal imaging of HeLa cells constained by 10 μmol·L-1NBD-Py and 1 μmol·L-1LysoSensor Red DND-99 after incubation for 30 min at 25℃(pH 4.0):(a)Bright field image;(b)image obtained with a band path from 500 to 600 nm upon excitation at 488 nm(NBD-Py);(c)image obtained with a band path from 570 to 600 nm upon excitation at 565 nm(LysoSensor Red DND-99);(d)overlay of(b)and(c)
利用共聚焦荧光显微镜我们进一步考察了NBD-Py细胞内pH造影能力。造影使用的HeLa细胞与探针 NBD-Py(10 μmol·L-1)共同孵育 30 min,孵育的介质为加入了尼日利亚菌素(10 ng·mL-1)的具有不同pH的PBS缓冲溶液。孵育结束后进行单通道模式共聚焦造影。如图6所示,当孵育溶液pH为4.0时,HeLa细胞内显示的平均荧光强度较强。当pH逐渐升高时,胞内荧光逐渐减弱,直至pH7.0时荧光强度趋于稳定。胞内pH的荧光响应图(图6h)表明该探针在HeLa细胞内可在pH 4.0~6.5内线性响应pHi。这一响应趋势和行为类似于溶液中观察到的现象,但显然其响应的线性范围与溶液中略有不同,胞内环境与溶液模拟环境之间的区别可能是导致这一差异的原因。胞内pH造影表明NBD-Py具有良好的细胞膜透过能力,并且具有pHi响应能力,是一个可对弱酸性胞内环境进行pH造影的良好探针。同时该探针具有良好的细胞相容性,在测试过程中未见明显的细胞凋亡现象。同时从图6(a~g)可以看出,探针主要分布于胞浆中,显示了清晰的点状荧光分布,表明探针可能具有特定细胞器的选择性结合能力。为了进一步确定NBD-Py探针的亚细胞分布,我们利用溶酶体荧光染色试剂Lysotracker Red DND-99和NBD-Py探针对HeLa细胞进行了共定位研究。由图7d可知,NBD-Py和Lysotracker Red DND-99的荧光在细胞中有很好的重叠,两者的共定位系数达90%以上。因此可以认为NBD-Py具有较好的溶酶体靶向能力,可以有效地检测溶酶体的pH变化。
3 结 论
本文将4-吡啶甲基修饰乙二胺形成的质子受体与NBD-NH2荧光团偶联构建了一个具有在弱酸性和近中性pH范围内敏感响应细胞内pH的荧光探针NBD-Py。该探针在pH 5.0~8.5范围内显示随pH降低导致的荧光增强响应,并且显示了良好的可逆响应能力和抗金属干扰性能,pKa约为6.48。研究表明探针质子受体中吡啶的引入是导致其弱酸和近中性pH响应的关键。细胞造影研究不仅证实了其pHi造影能力,而且发现了其良好的溶酶体靶向性能,为研究细胞溶酶体pH相关生理和病理过程提供了可靠工具。
[1](a)Gottlieb R A,Giesing H A,Zhu J Y,et al.Proc.Natl.Acad.Sci.,1995,92:5965-5968(b)Gottlieb R A,Dosanjh A.Proc.Natl.Acad.Sci.U.S.A.,1996,93:3587-3588
[2]Yuli I,Oplatka A.Science.,1987,235:340-342
[3](a)Liang E,Liu P,Dinh S.Int.J.Pharm.,2007,338:104-109(b)Montrose M H,Friedrich T,Murer H.J.Membr.Biol.,1987,97:63-78
[4](a)Donoso P,Beltran M,Hidalgo C.Biochemistry,1996,35:13419-13425(b)Hille C,Walz B.J.Exp.Biol.,2008,211:568-576
[5](a)Tang B,Yu F,Li P,et al.J.Am.Chem.Soc.,2009,131:3016-3023(b)Zhu H,Fan J L,Xu Q L,et al.Chem.Commun.,2012,48:11766-11768
[6](a)Hecht M,Kraus W,Rurack K.Analyst.,2013,138:325-332(b)WANG Yan-Wei(王艳玮),LI Min(李敏),SHEN Zhen(沈珍),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2008,24:1247-1252
[7]Hutt J T,Jo J,Olasz A,et al.Org.Lett.,2012,14:3162-3165
[8]Hecht M,Krausb W,Rurack K.Analyst.,2013,138:325-332
[9](a)LIU Chao(刘超),SUN Hui(孙辉),YANG Xiao-Liang(杨晓亮),et al.Chinese J.Inorg.Chem.(Wuji Huaxue Xuebao),2011,27:2121-2127(b)Percivalle C,Mahmood T,Ladame S.Med.Chem.Commun.,2013,4:211-215
[10]de Silva A P,Gunaratne H Q N,Gunnlaugsson T,et al.Chem.Rev.,1997,97:1515-1566
[11]Ishiguro K,Ando T,Goto H.Biotechniques,2008,45:465-468
[12](a)Andrews W W,Hill F C,Allison W S.J.Biol.Chem.,1984,259:14378-14382(b)Santa T,Matsumura D,Huang C Z,et al.Biomed.Chromatogr.,2002,16:523-528
[13]Wang Q,Lawrence D S.J.Am.Chem.Soc.,2005,127:7684-7685
[14]Qian F,Zhang C L,Zhang Y M,et al.J.Am.Chem.Soc.,2009,131:1460-1468
[15](a)Kim S H,Youn N J,Park J Y,et al.Bull.Korean Chem.Soc.,2006,27:1553-1556(b)WANG Pi(王丕),CHEN Ma-Liang(陈马亮),GUO Wei(郭炜).J.Shanxi Univ.:Nat.Sci.Ed(Shangxi Daxue Xuebao:Ziran Kexue Ban),2011,34:73-76
[16]Taliani S,Simorini F,Sergianni V,et al.J.Med.Chem.,2007,50:404-407
[17]Bissell R A,de Silva A P,de Silva S A,et al.J.Chem.Soc.Perkin Trans.,1992,2:1559-1564
[18]HE Juan(何娟),CHANG Jun-Biao(常俊标),CHEN Rong-Feng(陈荣峰),et al.Chin.J.Pharmaceut.(Zhongguo Yiyao Huagong Zazhi),2012,33:425-426
[19]Wang K,Cui J,Xie L,et al.Heteroatom Chemistry,2009,20:418-424
[20]Parker C A,Rees W T.Analyst,1960,85:587-600
[21]Lakowicz J R.Principle of Fluorescence Spectroscopy.New York:Klumer Academic,1999:52-53
[22]Thomas J A,Buchsbaum R N,Zimniak A,et al.Biochemistry,1979,18:2210-2218
[23](a)Henderson L J.Am.J.Physiol.,1908,21:173-179(b)Hasselbalch K A.Biochem.Z,1917,78:112-144
