蟾蜍灵对白血病K562细胞生长抑制机制
2013-06-12贾彩云王艳鸽呼文亮马远方
贾彩云,王艳鸽,呼文亮,马远方
(1.河南大学 免疫学研究所,河南 开封 475004;2.武警医学院 生物化学教研室,天津 300612)
近年来研究[1]发现,含有蟾蜍毒素成分的中药复合制剂在体外能抑制多种肿瘤细胞生长,诱导白血病的分化。临床观察提示,含蟾蜍毒素的中药制剂对肝癌、肺癌、食管癌、直肠癌及白血病等有明显的抑制作用。Numazawa等[2]研究表明,蟾蜍毒素的各种成分以剂量依赖诱导白血病K562细胞分化。在所有的蟾蜍毒素中,蟾蜍灵是诱导白血病细胞分化最有效的成分。蟾蜍灵在较低浓度(1×10-8~1×10-9mol/L)能够在较宽的范围内(有较宽的白血病谱)引起人白血病的分化[3],在较高的浓度(≥1×10-7mol/L)诱导人白血病细胞凋亡[3]。我们的实验以蟾蜍灵单体作用K562细胞株,研究其抑制白血病细胞生长和凋亡作用。
1 资料和方法
1.1 试剂
蟾蜍灵购自天津药物研究所,用无水乙醇配成1mol/L的贮存液,使用前用完全培养基稀释到所需浓度;四甲基偶氮唑蓝(MTT)为美国sigma公司产品;TUNEL(末端转移酶介导的缺口末端标记法)凋亡试剂盒为德国Roche 公司产品;Trizol为美国Gibco BRL 公司产品;RT-PCR 试剂盒为大连宝生物公司产品;其他试剂均为国产分析纯。
1.2 细胞株和细胞培养
K562(人髓性白血病细胞株)细胞由天津市血液病研究院惠赠。K562 细胞用内含体积分数为10%的灭活胎牛血清、80U/mL的庆大霉素、20mmol/L HEPEs、质量分数为0.2% NaHCO3、质量分数为0.01%L-谷氨酰胺的RPMI 1640 培养基培养。
1.3 倒置光显微镜下细胞形态学变化
分别计数不同时间点对照组和处理组(1.00μmol/L)活细胞数,每个时间点每组细胞各计数3次,取其平均值。
1.4 荧光显微镜下细胞形态学变化
分别收集对照组和处理组细胞2×106个,PBS磷酸盐缓冲液重悬,加入Hoechst 33342/PI(1∶1)的染液,37℃孵育8min,离心,弃上清,PBS磷酸盐缓冲液50μL重悬,涂片,荧光显微镜下观察、记录并照相。正常细胞、凋亡细胞着色为蓝色,死亡细胞着色为红色。细胞记数依据上述特点,取连续4个视野,每个视野细胞记数不少于80个。
1.5 透射电镜观察细胞超微结构的变化
收集对照组和处理组(1.00μmol/L)K562细胞2×106个,用预冷体积分数为2%的戊二醛磷酸缓冲液(pH 7.3)先固定12h,质量分数为1%的锇酸后固定2h。乙醇逐级脱水,环氧树脂包埋,超薄切片,醋酸铀-柠檬酸铅双染,在透射电镜下观察并摄像记录。
1.6 MTT 实验
取对数增长期细胞,稀释至1×105/mL,接种96孔板,每孔0.1mL,24h后加入不同浓度的蟾蜍灵,以未经蟾蜍灵作用K562细胞和单纯的培养液作为阴性对照。每种浓度8个复孔,继续培养72h,加入MTT(5g/L),继续培养4~5h,离心,弃上清,加入DMSO,避光震荡约10min。用自动酶标检测仪在570nm 处检测96孔板的光吸收值(A570值)。细胞增殖抑制率(%)=(A阴性对照-A实验组)/(A阴性对照-A空白对照)×100%。
1.7 琼脂糖凝胶电泳分析DNA 片段
用抽提的方法分别提取处理组及对照组K562细胞的DNA,10g/L 琼脂糖凝胶电泳3~4h,电压75V,紫外灯下观察并照相。
1.8 细胞周期分析
体积分数为75% 预冷乙醇固定K562 细胞5×106个,加入PI,避光染色30min,流式细胞仪测定细胞周期,用SSC和FSC 两个参数选取细胞,用PI荧光强度测定DNA 含量,分析G1期、S期、G2期细胞的比例以及亚二倍体峰的DNA的含量。
1.9 统计分析
数据输入Excel进行管理,采用SPSS 10.0软件进行统计学分析。MTT 实验各组间的差异采用方差分析(Post-Hoc LSD 法),组间凋亡率的差异采用卡方检验,取P<0.05作为显著性差异的界值。
2 结果
2.1 倒置光显微镜下细胞的形态学变化
倒置光显微镜下,对照组K562细胞呈悬浮性生长,圆形,透明,折光性好,大小均一,形态一致。蟾蜍灵组K562细胞,细胞悬浮性增高,透明度下降,细胞中出现空泡,并有膜包裹的凋亡小体。见图1。
2.2 Heochst 33342/PI结果
对照组K562 细胞大小一致,荧光均匀,荧光相对较淡。蟾蜍灵各处理组K562细胞出现典型的凋亡形态学改变,细胞体积变小,胞浆浓缩、核固缩、核裂解、凝集染色质荧光强度增强,并有膜包裹的凋亡小体形成。见图2。计算各处理的凋亡率,结果显示,0.10、1.00和10.00μmol/L蟾蜍灵作用K562细胞24h,细胞的凋亡率分别为17.68%、62.74%和88.97%。随着浓度的升高,凋亡率升高,统计分析结果显示,各组间差异显著(P<0.01)。可见蟾蜍灵可在较短时间内引起K562细胞明显凋亡。
2.3 电子透射显微镜观察结果
对照组K562细胞形态比较规则,胞浆内线粒体丰富,分布无规律,排列紊乱;核圆形或椭圆形,核膜清楚,核内染色质分布均匀,电子密度一致。1.00μmol/L的蟾蜍灵处理K562细胞24h,细胞体积缩小,胞核胞浆比减小,胞膜尚完整,核染色质已聚集在核膜下,呈现典型的新月形核凋亡细胞,其余核区电子密度较低。见图3。

图1 加药前后光镜下K562细胞形态学改变(×100)

图2 加药前后荧光显微镜下K562细胞形态学改变(×200)
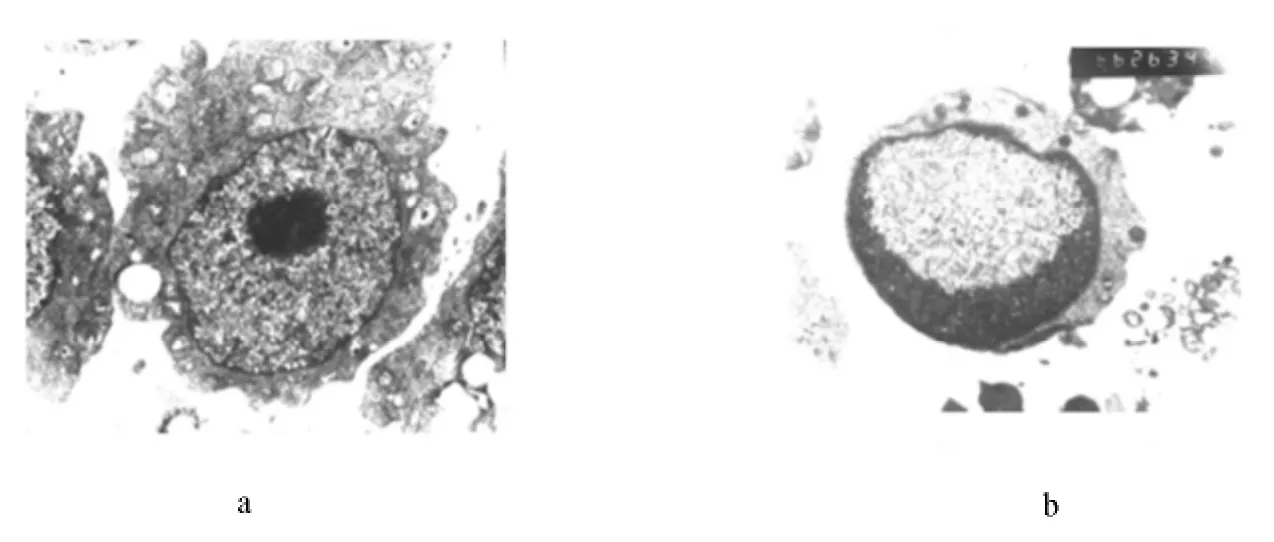
图3 加药前后电子显微镜下K562细胞形态学改变(×4500)
2.4 蟾蜍灵抑制K562细胞生长结果
蟾蜍灵可抑制白血病K562细胞的生长,与对照组相比,各浓度组均能显著抑制白血病K562细胞的生长(P<0.01)。蟾蜍灵对K562 细胞的半数抑制浓度(IC50)约为0.013μmol/L,且蟾蜍灵的生长抑制作用呈时间剂量依赖性,各组间两两比较差异显著(P<0.01)。实验结果显示,在0.001~1.000μmol/L蟾蜍灵均能抑制K562细胞生长。见表1。
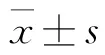
表1 蟾蜍灵对K562细胞的生长抑制作用(,n=6)
2.5 DNA 琼脂糖凝胶电泳结果
0.10、1.00μmol/L和10.00μmol/L 蟾蜍灵作用K562细胞24h,结果显示对照组没有出现梯状带,1.00μmol/L和10.00μmol/L 组出现典型的梯状带。见图4。
2.6 细胞周期分析结果
0.10μmol/L蟾蜍灵作用12h可将K562细胞周期阻滞在G2/M 期,作用24h,K562 细胞G2/M期数量并未明显增加,但凋亡细胞数增加至14.9%,凋亡细胞数量明显增加,出现典型的亚G1峰。见表2、图5。

图4 蟾蜍灵作用下,K562细胞DNA 在电泳上形成梯状带

表2 0.10μmol/L蟾蜍灵对K562细胞周期分布及凋亡的影响(%)
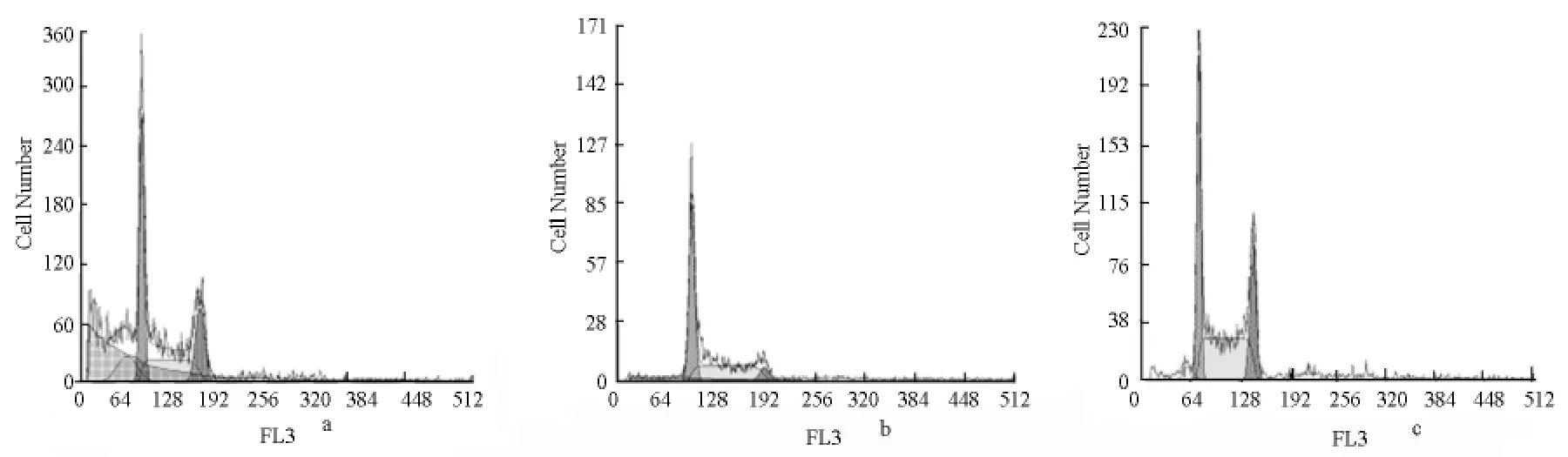
图5 K562细胞的流式细胞图
3 讨论
实验采用MTT 法进行药敏试验判定蟾蜍灵在体外对人髓性白血病K562细胞是否确切有抗增殖作用。结果表明,蟾蜍灵在0.001μmol/L 即可明显地抑制人髓性白血病K562细胞的生长(P<0.01),增加蟾蜍灵浓度抑制作用更加明显(P<0.01)。由此可以得出,人髓性白血病K562细胞对蟾蜍灵敏感性良好。与以前的报道[4-5]相一致,即蟾蜍灵以时间剂量依赖形式抑制急性早幼粒性白血病NB4细胞生长并诱导其凋亡,能够抑制人单核细胞白血病细胞TPH-1细胞生长并诱导其分化。
已有研究[6-7]表明,蟾蜍灵能够引起HL60细胞和U937细胞凋亡。我们研究说明,蟾蜍灵可诱导人K562细胞凋亡,且呈时间和剂量依赖关系。用1.00μmol/L蟾蜍灵作用K562细胞24h,在倒置光相差显微镜下观察到细胞中出现小泡,随即降解消失;荧光双染显示染色质凝集、断裂、凋亡小体形成。透射电镜结果显示,细胞体积缩小,胞核胞浆比减小,胞膜尚完整,核染色质已聚集在核膜下,呈现典型的新月形核凋亡细胞,其余核区电子密度较低。由蟾蜍灵处理的细胞中提取的DNA 琼脂糖凝胶电泳的结果,出现典型核酸断裂的梯状带,被认为是程序性细胞死亡的早期事件,表明蟾蜍灵能以剂量和时间依赖关系诱导人白血病K562凋亡。此结论与以前的报道[7]相一致。尽管蟾蜍灵能够诱导人白血病细胞凋亡,但即使在较高浓度(10-6mol/L)下,也未能观察到蟾蜍灵诱导人正常血液中单核细胞和多形核细胞凋亡。
我们的实验发现,0.10μmol/L 蟾蜍灵可明显阻滞K562细胞于G2/M 期,该效应呈明显的时间依赖关系。此外,K562细胞的G2/M 期阻滞在12h内就很明显,而此时无论是荧光染色还是流式细胞术检测,都仅有少量细胞发生凋亡。随着时间延长,才能检测到明显的细胞凋亡。而细胞周期的阻滞作用无明显升高,说明细胞周期的阻滞抑制了细胞生长,最终引起细胞凋亡。
蟾蜍灵最可能的膜受体为Na+-K+ATP酶,因为在各种肿瘤细胞的细胞膜上,该酶的活性可被蟾蜍灵抑制。蟾蜍灵对人肿瘤细胞的特异作用可归因于人细胞膜上Na+-K+ATP 酶[8]的特异结构。抗凋亡基因survivin[9]表达检测有望进一步阐述蟾蜍灵抑制白血病细胞生长的分子机制。
[1]Yin p H,Liu X,Qiu Y Y,et al.Anti-tumor activity and apoptosis-regulation mechanisms of bufalin in various cancers:new hope for cancer patients[J].Asian Pac J Cancer Prev,2012,13(11):5339-5343.
[2]Numazawa S,Shinoki M,Ito H,et al.Involoement of Na+-K+ATPase inhibitiog in K562cell differentiation induced by bufallin[J].J Cell Physiol,1994,160(1):113-120.
[3]Efferth T,Davev M,Ocbrich A,et al.Activity of drugs from traditional Chinese medicine toward sensitive and MDR1-or MRP1-overexpressing multidrug-resistant human CCRF-CEM leukemia cells[J].Blood Cells Mol Dis,2002,28(2):160-168.
[4]Zhu Z,Li E,Liu Y,et al.Bufalin induces the apoptosis of acute promyelocytic leukemia cells via the downregulation of survivin expression[J].Acta Haematol,2012,128(3):144-150.
[5]Kurosawa M,Tani Y,Nishinura S,et al.Distinct PKC isozymes regulate bufalin-induced differentiation and apoptosis in human monocytic cells[J].Am J Physiol Cell Physiol,2001,280(3):459-464.
[6]Jing Y,Ohizum H,Kawazoe N,et al.Seiective Inhibitory Effect of Bufalin on Growth of Human Tuman Cells in vitro:Association with the Induction of Apoptpsis in Leukemia HL-60Cells[J].Jpn J Cancer Res,1994,85(6):645-651.
[7]Chen A,Yu J,Zhong L,et al.Microarray and biochemical analysis of bufalin-induced apoptosis of HL-60Cells[J].Biotechnol Lett,2009,31(4):487-494.
[8]Kawazoe N,Aiachi T,Masuda Y,et al.Induction of apoptosis by bufalin in human tumor cells is associated with a change of intracellular concentration of Na+ions[J].J Biochem,1999,126(2):278-286.
[9]于庆凯,付怀平,马杰.抗凋亡基因survivin在60例大肠癌中的表达及意义[J].河南大学学报:医学版,2006,25(1):40-42.
