阿托伐他汀钙对过氧化氢致内皮细胞损伤的保护作用*
2013-06-11李红玲石京山孙黔云
李红玲,李 敏,石京山,孙黔云
(1.遵义医学院药理学教研室,贵州遵义 563099;2.贵州省中国科学院天然产物化学重点实验室,贵州贵阳550002;3.贵州省人民医院呼吸疾病研究所,贵州贵阳 550002)
血管内皮细胞是血管平滑肌与血液的生理屏障,具有重要的生理调节功能和分泌功能,与诸多疾病的发生、发展有密切的关系[1]。一系列病理生理刺激因素会导致内皮细胞的活化和损伤,致使内皮细胞功能紊乱。在诸如动脉粥样硬化等病征中,氧化应激损伤是重要的诱因[2-4]。近年来抗氧化应激损伤成为临床治疗相关疾病和新药研究的重要策略。他汀类药物是目前临床上普遍使用的降血脂药。最新研究表明他汀类药物还具有保护内源性抗氧化酶活性的作用[5-6]。既往研究多采用H2O2损伤脐静脉内皮细胞和ECV304来研究他汀类药物的保护作用,而阿托伐他汀钙对H2O2致人微血管内皮细胞损伤的影响作用仍不清楚。为探讨和评价阿托伐他汀钙对氧化应激损伤人微血管内皮细胞的保护作用,本文进行了阿托伐他汀钙对H2O2致内皮细胞损伤的保护作用研究,旨在为临床相关疾病的防治提供参考依据。
1 材料与方法
1.1 材料 人微血管内皮细胞株HMEC由本实验室传代培养;RPMI1640培养基为GIBCO公司产品;胎牛血清(fetal bovine serum,FBS)购自天津灏洋生物;过氧化氢(H2O2)、四甲基偶氮唑蓝(methyl thiazolyl tetrazolium,MTT)、阿托伐他汀钙(atorvastatin calcium,ATV)购自sigma公司;乳酸脱氢酶(lactate dehydrogenase,LDH)试剂盒为南京建成生物研究所产品;人P-selectin和ICAM-1 ELISA试剂盒购自武汉博士德生物工程有限公司;其余试剂均为符合实验要求的进口或国产试剂。
1.2 仪器 Forma 3111型CO2培养箱(美国Thermo公司);Milli Q超纯水系统和Elix纯水系统(美国Millipore公司);Nikon TS100倒置相差显微镜(日本Nikon公司);Molecular Devices Spectra MAX-190连续波长酶标仪(美国MD公司);5810R冷冻离心机(德国Eppendorf公司)。
1.3 方法
1.3.1 HMEC培养 人微血管内皮细胞株HMEC由本实验室传代培养,用含20%胎牛血清的RPMI1640培养基在37℃,5%CO2饱和湿度培养箱内培养,取对数生长期细胞进行实验。
1.3.2 H2O2致 HMEC损伤条件的确定 将HMEC 以1 ×104cells·well-1,接种于96 孔细胞培养板,培养24 h后弃上清,模型组加入不同浓度H2O2,用无血清RPMI 1640培养基补足至200 μL。正常细胞组加入200 μL无血清RPMI 1640培养基。培养24 h后加入MTT,4 h后加入细胞裂解液,次日在570 nm处测定OD值。根据OD值计算细胞活力。细胞活力=(实验组OD值/正常细胞组OD值)×100。根据细胞活力测定结果确定适宜浓度的H2O2作为损伤条件。
1.3.3 实验分组 HMEC 以1×104cells·well-1种于96孔细胞培养板,培养24 h后弃上清,按以下分组:①正常细胞组:加入无血清RPMI1640培养基;②模型组:加入200 μm H2O2继续培养24 h;③阿托伐他汀钙低剂量组(0.2 μm ATV);④阿托伐他汀钙中剂量组(1 μm ATV);⑤阿托伐他汀钙高剂量组(10 μm ATV),分别加入不同浓度阿托伐他汀钙处理24 h后加入200 μm H2O2继续培养24 h。
1.3.3.1 细胞形态学观察 按上述设置加入H2O2处理24 h后在倒置相差显微镜下观察并记录细胞形态学改变。
1.3.3.2 细胞活力测定 按上述设置加入H2O2处理24 h后加入MTT,4 h后加入细胞裂解液,次日在570 nm处测定OD值。根据OD值计算细胞活力。细胞活力=(实验组OD值/正常细胞组OD值)×100。
1.3.3.3 LDH测定 按上述设置加入H2O2处理24 h后,取适量上清加入试剂盒的基质缓冲液和辅酶Ⅰ缓冲液,混匀后置于37℃水浴反应15 min,加入2,4-二硝基苯肼,混匀后置于37℃水浴反应15 min,加入氢氧化钠,静置3 min后取上清在440 nm处测定吸光度(OD值),并计算其活性。
1.3.3.4 P -selectin及 ICAM -1 测定 按上述设置加入H2O2处理24 h后取培养上清,按试剂盒说明书测定P-selectin和ICAM-1。具体检测方法如下:取100 μL稀释的样品于已包被的酶标板中,37℃反应90 min后加入100 μL抗体工作液,37℃反应60 min后用PBS洗板3次,加入亲和素-辣根过氧化物酶复合物工作液100 μL,37℃反应30 min后用PBS洗板5次,加入90 μL TMB显色液37℃避光反应25~30 min后加入终止液,用酶标仪在450 nm处测定吸光度(OD)值。
2 结果
2.1 H2O2损伤内皮细胞条件确定 结果表明,H2O2对HMEC细胞活力有明显的抑制作用(见图1)。

图1 H2O2对细胞生长的抑制作用(n=4)
2.2 细胞形态学观察 正常人微血管内皮细胞呈铺路石样贴壁生长(见图2A)。经H2O2处理后细胞缩小,细胞间连接消失,间隙变大(见图2B)。阿托伐他汀钙能明显减轻H2O2导致的内皮细胞形态改变(见图2C、D)。

图2 各组细胞形态学观察(100×)
2.3 阿托伐他汀钙对H2O2抑制内皮细胞活力的影响 实验结果表明,阿托伐他汀钙能减轻H2O2对HMEC细胞活力的抑制(见图3)。
2.4 阿托伐他汀钙对H2O2致内皮细胞LDH释放的影响 H2O2能导致内皮细胞释放LDH明显增加,而阿托伐他汀钙能明显减轻H2O2导致的LDH释放(见图4)。

2.5 H2O2对内皮细胞 P -selectin、ICAM -1释放的影响 50、100、200、300 μm H2O2刺激 HMEC后,在培养上清中检测到的 P-selectin、ICAM-1的含量变化,与0μm组相比较无统计学差异(P>0.05)(见表1)。
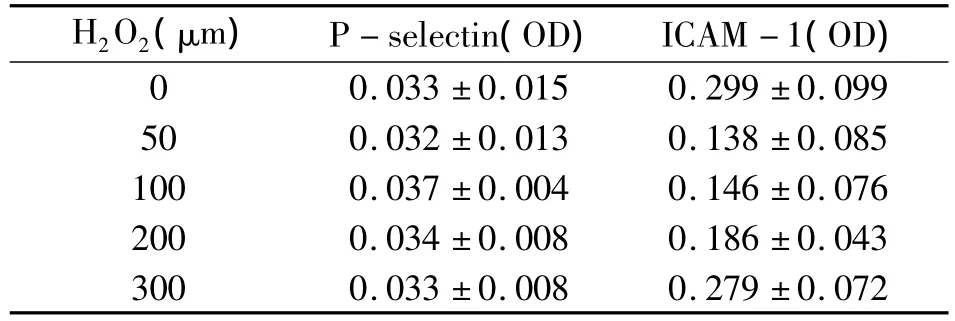
表1 H2O2对内皮细胞P-selectin、ICAM-1释放的影响(n=4)
3 讨论
动脉粥样硬化引起的心脑血管疾病是严重危害人类健康的常见疾病,研究证实,内皮细胞功能紊乱可促进动脉粥样硬化进展[7],而由氧化应激所致的内皮细胞损伤和凋亡在动脉粥样硬化的病理过程中广泛存在,被认为是动脉粥样硬化发生发展的始动环节[4]。
在氧化应激损伤细胞模型中,多采用H2O2、低氧、·O-2等来作用靶细胞。本实验采用H2O2损伤人微血管内皮细胞造成氧化应激损伤模型,并利用该模型评价阿托伐他汀钙对该损伤的保护作用。结果显示:经H2O2处理后人微血管内皮细胞出现明显的细胞形态改变,LDH的释放明显增加,细胞活力明显抑制。LDH是检测细胞膜受损较敏感的指标[8]。这与文献报道的 H2O2致内皮细胞ECV304损伤结果相似[9]。本结果表明H2O2能导致HMEC形态学改变和损伤。
针对H2O2对HMEC的损伤作用,我们采用阿托伐他汀钙对这种损伤进行保护作用研究。结果表明阿托伐他汀钙预处理细胞后再给予H2O2刺激,发现内皮细胞形态改变明显减轻,培养上清中LDH的释放明显减少,细胞活力增加。他汀类药物是3-羟基-3-甲基戊二酸单酰辅酶A(HMG-CoA)还原酶抑制剂,可通过阻断体内胆固醇的合成来降低血中胆固醇水平。他汀类药物除了通过治疗高胆固醇血症发挥其作用外,最新的研究表明还具有抗氧化和保护内源性抗氧化酶活性的作用[10-11]。本实验结果显示阿托伐他汀钙能减轻H2O2对HMEC的氧化应激损伤,提示阿托伐他汀钙在体内可能对氧化应激损伤人微血管内皮细胞具有保护作用。
在本研究中我们还测定了黏附分子P-selectin和ICAM-1。结果表明H2O2刺激内皮细胞后没有导致黏附分子P-selectin和ICAM-1蛋白的表达改变。P-selectin是位于内皮细胞Weibel-Palade小体的跨膜糖蛋白,在内皮细胞受到补体旁路激活产物[12-13]以及氧化型低密度脂蛋白[14]等刺激时从Weibel-Palade小体释放,是内皮细胞活化的标志。细胞间黏附分子ICAM-1属于免疫球蛋白超家族成员,ICAM-1持续表达于血管内皮。P-selectin与ICAM-1是中性粒细胞和内皮细胞黏附、聚集、浸润的重要分子,在促进动脉粥样硬化的形成和发展方面起决定作用[15-16]。我们之前的研究用补体激活产物刺激HMEC活化,检测到P-selectin、ICAM -1 蛋白表达上调[13,17]。也有文献研究显示H2O2能使HUVEC的ICAM-1蛋白表达增加[18]。上述情况提示同一来源的内皮细胞对不同的刺激反应不尽相同,而不同来源的内皮细胞对相同刺激的反应也不全相同。产生这种差别的原因其有待进一步深入研究。
本研究表明H2O2可致人微血管内皮细胞氧化应激损伤,阿托伐他汀钙对这种损伤具有一定的保护作用。本工作为阿托伐他汀钙抗氧化应激损伤内皮细胞的临床应用提供一定的参考依据。
[1]Jaffe E A.Cell biology of endothelial cells[J].Human Patholog,1988,18(3):234 -239.
[2]Doughan A K,Harrison D G.Dikalov S I.Molecular mechanisms of angiotensin II mediated mitochondrial dysfunction:linking-mitochondrial oxidative damage and vascular endothelial dysfunction[J].Circ Res,2008,102:488-496.
[3]Ren D L,Wang H K,Liu J Q,et al.ROS - induced ZNF580 expression:a key role for H2O2/NF-κB signaling pathway in vascular endothelial inflammation[J].Mol Cell Biochem,2012,359:183 -191.
[4]Fukai T,Fukai M U.Superoxide dismutases:role in redox signaling,vascular function,and diseases[J].Antioxid Redox Signal,2011,15(6):1583 – 1606.
[5]Heeba G,Moselhy M E,Hassan M,et al.Anti- atherogenic effect of statins:role of nitric oxide,peroxynitrite and haem oxygenase -1[J].Br J Pharmacol,2009,156(8):1256-1266.
[6]Dje N'Guessan P,Riediger F,Vardarova K,et al.Statins control oxidized LDL-mediated histone modifications and gene expression in cultured human endothelial cells[J].Arterioscler Thromb Vasc Biol,2009,29:380 -386.
[7]Briasoulis A,Tousoulis D,Androulakis E S,et al.Endothelial dysfunction and atherosclerosis:focus on novel therapeutic approaches[J].Recent Patents on Cardiovas cular Drug Discovery,2012,7(1):21 -32.
[8]Shimizu S,Nomoto M,Yamamoto T,et al.Reduction by NG-nitro-L-arginine of H2O2-induced endothelial cell injury[J].Br J Pharmacol,1994,113(2):564 - 568.
[9]Luo T,Xia Z Y.A small dose of hydrogen peroxide enhances tumor necrosis factor-alpha toxicity in inducing human vascular endothelial cell apoptosis:reversal with propofol[J].Anesth Analg,2006,103:110 -116.
[10]Mitsios J V,Papathanasiou A I,Goudevenos J A,et al.The antiplatelet and antithrombotic actions of statins[J].Current Pharmaceutical Design,2010,16(34):3808 -3814.
[11]Bertocchi C,Traunwieser M,Dǒrler J,et al.Atorvastatin inhibits functional expression of proatherogenic TLR2 in arterial endothelial cells[J].Cell Physiol Biochem,2011,28(4):625 -630.
[12]Foreman K E,Vaporciyan A A,Bonish B K,et al.C5a -induced Expression of P-selectin in Endothelial Cells[J].J Clin Invest,1994,94(3):1147 -1155.
[13]孙黔云,李敏,叶巧玲,等.补体旁路激活导致内皮细胞活化和损伤[J].中国药理学通报,2012,28(7):925-929.
[14]Gebujhrer V,Murphy J F,Bordet J C,et al.Oxidized low-density lipoprotein induces the expression of P-selectin(GMP140/PADGEM/CD62)on human endothelial cells[J].Biochem J,1995,306,293 -298.
[15]Malley T O,Ludlam C A,Riemermsa R A,et al.Early increase in levels of soluble inter-cellular adhesion molecule-1(sICAM-1)-Potential risk factor for the acute coronary syndromes[J].European Heart Journal,2001,22(14):1226 –1234.
[16]Blankenberg S,Barbaux S,Tiret L.Adhesion molecules and atherosclerosis[J].Atherosclerosis,2003,170:191–203.
[17]沈良贤,李敏,孙黔云,等.脂多糖激活补体诱导内皮细胞释放黏附分子和凋亡[J].中国药理学通报,2011,27(9):1245 -1249.
[18]陈槐卿,陈友琴,张文胜,等.过氧化氢对内皮细胞表面粘附分子表达的影响[J].华西医科大学学报,2002,33(3):364 -369.
