左归丸逆转Th1/Th2亚群偏移减轻雌激素缺乏骨丢失*
2013-06-09谢宝华鞠红梅周宪宾郭钰琪
谢宝华 鞠红梅 王 丽 周宪宾 郭钰琪 李 霞△
(1济南大学山东省医学科学院医学与生命科学学院,山东 济南250062;2济宁医学院基础学院,山东 济宁272067;3山东中医药大学附属医院,山东 济南250011)
正常骨代谢是成骨细胞(OB)与破骨细胞(OC)参与的骨形成和骨吸收的动态平衡过程,此过程受内分泌、免疫系统调节;内分泌—免疫—骨代谢网络失衡会导致多种骨代谢性疾病发生,如成骨不全、骨质疏松症(OP)等,严重危害患者健康。雌激素是人体重要的性激素,研究发现绝经后骨质疏松发病率随着年龄的增长而增高,并与雌二醇水平呈负相关[1]。T细胞是机体免疫系统中重要的细胞群体,Th1、Th2是经典的T细胞亚群,生理条件下,机体的Th1和Th2细胞处于平衡状态,如果Th1/Th2的极化发生偏移容易诱发病理改变[2]。雌激素—T细胞—骨代谢三者的关系成为本领域研究的焦点问题。我们前期研究证实骨密度与雌激素水平及T细胞亚群相关细胞因子表达存在显著相关性[3]。补肾经典方剂左归丸治疗骨代谢疾病效果显著,研究发现左归丸可明显改善Th1/Th2的漂移状态,显著提高Th2细胞因子IL-10的表达,逆转Th1优势[4]。本研究以逆转Th1/Th2亚群偏移为切入点,探讨雌激素缺乏导致的T细胞亚群偏移与骨代谢的相关性,阐释左归丸逆转Th1/Th2亚群偏移状态减轻雌激素缺乏骨丢失的作用与机制,为指导临床治疗提供实验依据。
1 材料与方法
1.1 研究对象
选择2010年1月至2012年11月在山东中医药大学附院查体的自然绝经妇女30例,年龄45~65岁,平均(55.93±5.61)岁,绝经时间最长18a,最短3a,随机分为绝经组与中药组,各15例。选取同期在妇科及骨科门诊查体的健康未绝经妇女15例,年龄25~45岁,平均(35.30±6.22)岁,平素月经规律,身体健康,未妊娠,纳入未绝经组。3组均排除其它影响骨代谢的疾病,未用雌激素替代治疗及其它治疗。本研究经山东中医药大学附院伦理委员会批准,所有研究对象签署知情同意书。
1.2 左归丸提取制备
采用水提、醇溶法提取左归丸溶液,左归丸由熟地黄、山药、枸杞、山茱萸、鹿角胶、龟板胶、川牛膝、菟丝子按8∶4∶4∶4∶4∶4∶4∶3配伍,煎煮滤取药液,加入烊化的龟板胶和鹿角胶,水浴浓缩,依次加入65%、75%、85%乙醇,沉淀过夜,滤取上清,水浴减压法回收乙醇,获取左归丸溶液。
1.3 方法
1.3.1 标本采集 空腹采集研究对象静脉血4ml,其中1.5ml离心后取血清,电化学发光法检测血清雌二醇(E2)水平;剩余2.5ml采用EDTA抗凝,Ficoll密度梯度离心法分离单个核细胞(PBMC),用于流式、Western blot及RT-PCR检测。
1.3.2 主要试剂 E2检测试剂盒购于德国罗氏公司;M-MLV购于Fermentas公司;RNA抑制剂购于上海生工生物有限公司;Ionomycin、PMA购于Sigma公司;DEPC、GIT、L-Gln购于AMRESCO公司;FBS购于杭州四季青生物公司;RPMI Medium 1640购于GIBCO公司。
1.3.3 流式细胞术检测 分离静脉血制备单个核细胞悬液,PBS洗2遍,用1640培养液调整细胞浓度为1×107/ml,接种于24孔板(1ml/孔),分别加入PMA 30ng/ml、Ionomycin 1μg/ml、Monensin 1.7μg/ml,37℃5%二氧化碳刺激培养4h后,收集培养细胞,PBA(PBS+0.1%NaN3+0.1%BSA)洗两遍,重悬于PBA缓冲液,按说明书加入CD4-FITC和CD3-Cy5荧光抗体,4℃避光染色30min,PBA清洗3遍,加入100μl固定液,4℃,避光固定30min;穿膜液清洗1次,重悬于100μl穿膜液中,加入新鲜小鼠血清20μl/管,4℃,避光封闭30min;分别加入PE标记的TNF-α、IL-4荧光抗体,室温避光染色1h,用穿膜液和PBA各洗1遍后重悬于PBA中,用于流式细胞术胞内外因子的检测。
1.3.4 Western blot法检测T细胞亚群特异性核转录因子蛋白水平 RIPA裂解液裂解PBMC蛋白,高速离心:12000g离心30min,吸取上清蛋白,混匀,沸水中煮3min,取出,12000g离心1min,取上清;电泳分离转膜;25ml TBS洗膜5min,室温,摇动;置膜于25ml封闭缓冲液中1h,室温,摇动,15ml TBS/T洗3次(5min/T);加入1∶250稀释的T-bet、GATA3一抗,室温孵育1h,缓慢摇动;15ml TBS/T洗3次(5min/T);加入1∶1000辣根过氧化酶(HRP)标记的二抗,室温孵育1h,缓慢摇动,15ml TBS/T洗3次(5min/T),15ml TBS洗1次;化学发光法检测蛋白表达。
1.3.5 RT-PCR检测T细胞亚群特征性细胞因子转录水平 RNA提取:采用异硫氰酸胍一步法提取PBMC总mRNA,紫外分光光度仪检测A260/A280比值,验证RNA浓度和纯度。RT反应:采用oligo dT为RT反应引物,取2.5μg总RNA按RT试剂盒说明书逆转录合成cDNA 20μl;PCR反应:总反应体系为25μl,包含RT产物5μl,10×PCR buffer 2.5μl,25mM MgCl22μl,上下 游 引 物 各0.25μl(25pmol),10mM DNPT 0.5μl,Taq DNA聚合酶0.5μl,DEPC水14μl。反应条件为95℃预变性5min,94℃1min,58~60℃1min,72℃1min,26个循环后,70℃延长10min。1.5%凝胶(EB染色)水平电泳,采用Alpha凝胶成像系统分析图像:以β-actin为内参照,计算目的基因与同步β-actin灰度值比值作为相对表达量。
1.3.6 腰椎骨矿物质密度(BMD)测定 研究对象平躺在测量床上,双能X线骨密度仪测定研究对象腰椎2~4(L2~4)前后位BMD。
1.4 统计学方法
所有实验数据采用SPSS 11.5软件做统计学处理,计量资料以±s表示。采用One Way-ANOVA方差分析,两组间比较采用Turkey法检验,数据间相关性用Pearson相关性分析。
2 结果
2.1 血清E2水平比较
未绝经组血清E2平均为(91.11±10.01)pg/ml,绝经组平均为(33.73±7.12)pg/ml,中药组平均为(37.09±6.23)pg/ml。与未绝经组比较,绝经后妇女血清E2水平明显降低(t=18.092,P<0.05);与绝经组比较,中药组绝经妇女E2表达无显著性差异(t=1.374,P>0.05),表明左归丸对绝经妇女E2表达无影响,无明显雌激素样作用。见图1。

图1 血清E2水平比较
2.2 腰椎L2~4BMD比较
未绝经组L2~4BMD平均为(1.28±0.07)g/cm2,绝经组平均为(0.87±0.14)g/cm2,中药组平均为(1.10±0.16)g/cm2。与未绝经组相比,绝经后妇女腰椎BMD明显降低(t=10.559,P<0.05);与绝经组比较,中药组绝经妇女腰椎BMD明显升高(t=4.304,P<0.05),见图2。

图2 腰椎2~4骨密度比较
2.3 Th1/Th2亚群比例比较
与未绝经组相比,绝经组Th1亚群比例明显升高(t=5.760,P<0.05),Th2亚群比例明显降低(t=3.605,P<0.05),T细胞向Th1亚群偏移。与绝经组相比,中药组绝经妇女Th1亚群比例明显降低(t=3.128,P<0.05),Th2亚群比例明显升高(t=2.424,P<0.05)。见图3。
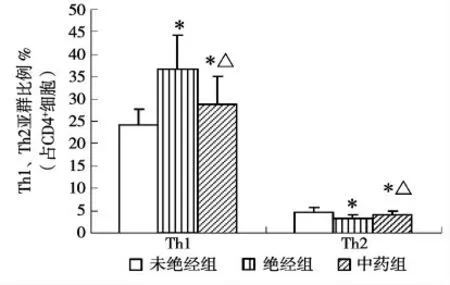
图3 Th1/Th2亚群比例比较
2.4 E2、骨密度、Th1/Th2亚群比例相关性分析
相关性分析显示E2表达与骨密度呈显著正相关(P<0.05);骨密度与Th1亚群比例呈显著负相关(P<0.05),与Th2亚群比例呈显著正相关(P<0.05);E2表达与Th1亚群比例呈显著负相关(P<0.05),与Th2亚群比例呈显著正相关(P<0.05),见表1。
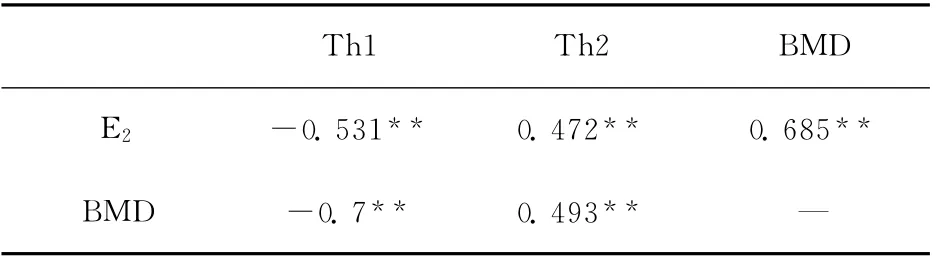
表1 E2、BMD与Th1/Th2亚群比例的相关性分析
2.5 Th1/Th2亚群特异性核转录因子(T-bet、GATA-3)蛋白表达比较
与未绝经组比较,绝经组Th1亚群特异性核转录因子(T-bet)蛋白表达明显升高(t=4.343,P<0.05),Th2亚群特异性核转录因子(GATA-3)蛋白表达明显降低(t=4.721,P<0.05);与绝经组比较,中药组绝经妇女T-bet蛋白表达明显降低(t=3.086,P<0.05),GATA-3蛋白表达明显升高(t=3.535,P<0.05)。见图4。

图4 T-bet、GATA-3蛋白表达比较
2.6 Th1/Th2亚群特征性细胞因子(TNF-α、IL-4)mRNA表达比较
与未绝经妇女比较,绝经后妇女Th1亚群特征性细胞因子(TNF-α)mRNA相对灰度值明显升高(t=4.557,P<0.05),Th2亚群特征性细胞因子(IL-4)mRNA相对灰度值明显降低(t=4.669,P<0.05);与绝经妇女相比,中药组绝经妇女TNF-αmRNA相对灰度值明显降低(t=3.092,P<0.05),IL-4mRNA相对灰度值明显升高(t=4.257,P<0.05)。见图5。

图5 TNF-α、IL-4mRNA表达比较
3 讨论
初始T细胞遇抗原刺激后在特异性核转录因子与分化诱导因子作用下,分化为不同亚群,分泌特征性细胞因子,介导不同的免疫反应,对骨代谢发挥正向和负向调控作用。RANKL是OC分化的关键调控因子,其受体是位于OC上的RANK,RANKL与RANK结合,启动OC的分化、成熟和活化过程[5]。Th1、Th2是经典的T细胞亚群。Th1类细胞因子TNF-α被称为溶骨性细胞因子,是一种多功能的炎症介质,可通过诱导OB表达RANKL,间接促进OC分化、成熟,也可直接促进RANKL诱导的OC形成和骨吸收[6]。Th2类细胞因子IL-4能抑制RANKL诱导的生理性骨吸收和病理情况下TNF-α诱导OC生成,体外研究显示IL-4一定条件下能抑制破骨细胞前体向OC分化及抑制成熟OC的活性,同时IL-4还抑制OC的RANK表达[7]。因此,影响T细胞极化的因素均可影响T细胞亚群细胞因子的表达,从而影响骨代谢。随着对神经—内分泌—免疫网络研究的不断深入,发现雌激素对T细胞亚群极化有重要调节作用。雌激素是重要的性激素,E2是女性和男性雌激素主要来源。衰老、应激、过度体力活动、低体重等状态均可出现雌激素缺乏,导致OP等骨代谢疾病发生,说明雌激素缺乏对骨代谢有重要影响。研究发现,T细胞上存在雌激素受体,雌激素水平变化可直接影响T细胞增殖、活化和极化,雌激素缺乏可诱导T细胞向Th1漂移,导致T细胞亚群失衡[8]。因此推断雌激素—T细胞—骨代谢三者间有密切的联系。临床上,雌激素替代及免疫调节疗法治疗骨代谢性疾病有确切疗效,但存在诱发子宫内膜癌、宫颈癌、乳腺癌、代谢紊乱、感染等危险,且不适用于男性骨代谢疾病患者。因次,寻找能够逆转或改善雌激素缺乏诱导的T细胞亚群极化、纠正骨代谢失调,又无雌激素样及免疫治疗副作用的药物具有良好的应用前景。
中医认为“肾主骨生髓”。现代医学研究发现中医“肾”的功能覆盖了神经、内分泌、免疫系统,构成了完整的人体调节网络,肾虚可导致神经—内分泌—免疫网络功能失调,引起骨代谢疾病发生[9]。以补肾法为原则治疗骨代谢疾病疗效确切。研究证实补肾中药能促进OB增殖,抑制OC形成,上调骨组织I型胶原和骨矿化相关蛋白表达,减少尿钙排泄,升高大鼠骨密度[10]。补肾经典方剂左归丸治疗OP等骨代谢疾病效果显著,可通过调节OB中RANKL表达实现对OC的抑制[11]。中药免疫药理研究证实左归丸能调节卵巢早衰雌激素缺乏小鼠CD4+/CD8+亚群平衡,改善卵巢早衰小鼠免疫功能[12]。但尚未见对左归丸及其它补肾方剂逆转或改善雌激素缺乏诱导的T细胞亚群极化异常调节骨代谢的研究报道。
本研究显示,妇女绝经后血清E2水平与骨密度均明显降低、Th1亚群比例升高、Th2亚群比例降低;血清E2表达与骨密度呈正相关;骨密度、E2表达与Th1亚群比例呈负相关,与Th2亚群比例呈正相关。此结果进一步证实雌激素缺乏状态诱导Th1/Th2亚群向Th1偏移,且与骨密度降低关系密切。同时绝经妇女T-bet蛋白表达、TNF-α mRNA表达升高,GATA-3蛋白表达、IL-4mRNA表达降低,表明雌激素缺乏状态下,促进骨吸收细胞因子表达升高,导致骨密度下降。绝经妇女服用左归丸后,血清E2水平无明显变化,表明左归丸对机体无明显雌激素样作用;骨密度、Th2亚群比例升高,Th1亚群比例降低,T-bet蛋白表达、TNF-αmRNA表达降低,GATA-3蛋白表达、IL-4 mRNA表达升高,表明左归丸通过下调T-bet蛋白表达、上调GATA-3蛋白表达,诱导T细胞向Th2亚群分化,进而抑制TNF-αmRNA与蛋白表达、促进IL-4mRNA与蛋白表达,抑制骨吸收,升高骨密度。综合以上研究结果,雌激素缺乏导致的Th1/Th2亚群向Th1偏移是骨丢失发生的原因;中药方剂左归丸通过干预T细胞亚群特异性核转录因子表达,逆转雌激素缺乏导致的Th1/Th2亚群偏移,抑制骨吸收细胞因子产生,促进骨形成细胞因子表达,从而减少骨丢失,促进骨形成。
[1] 李恩,闫素云,谷丽敏,等.原发性骨质疏松发病的相关因素[J].中国骨质疏松杂志,1997,3(2):1-3.
[2] 何维.医学免疫学[M].北京:人民卫生出版社,2005:197-198.
[3] 李霞,孙建丽,王彬,等.绝经妇女外周血单个核细胞骨代谢调控因子表达变化[J].中国免疫学杂志,2011,8:49-53.
[4] 姚成芳,王丽.阴虚阳亢小鼠Th1/Th2类细胞因子的漂移现象及中药左归丸的干预研究[J].山东大学学报,2004,42(3):349-352.
[5] Varenna M,Gatti D.The role of rank-ligand inhibition in the treatment of postmenopausal osteoporosis[J].Reumatismo,2010,62(3):163-171.
[6] Fuller K,Murphy C,Kirstein B,et al.TNF alpha potently activates osteoclasts,through a direct action independent of and strongly synergistic with RANKL[J].Endocrinology,2002,143:1108-1118.
[7] Moreno JL,Kaczmarek M,Keegan AD,et al.IL-4suppresses osteoclast development and mature osteoclast function by a STAT6-dependent mechanism:irreversible inhibition of the differentiation program activated by RANKL[J].Blood,2003,102(3):1078-1086.
[8] Wilder RL.Adrenal and gonadal steroid hormone deficiency in the pathogenesis of rheumatoid arthritis[J].J Rheumatol Suppl,1996,44:10-12.
[9] 杨裕华,李震.补肾中药对肾阳虚动物模型神经内分泌免疫系统影响的实验研究进展[J].天津中医药,2007,24(3):262-264.
[10]李恩,孔德娟.补肾方药对骨质疏松防治的实验研究[J].中国骨质疏松杂志,2002,8(2):166-170.
[11]刘梅洁,鞠大宏.“肾主骨”的机理研究-左归丸含药血清对破骨细胞分化调控因子OPG、RANKL蛋白表达的影响[J].中国中医基础医学杂志,2009,5(3):184-188.
[12]Shen JJ,Lin CJ.The effect of liu-wei-di-huang wan on cytokine gene expression from human peripheral blood lymphocytes[J].Am J Chin Med,2003;31(2):247-257.
