乳腺导管原位癌的MRI表现及与病理分级的关系
2013-06-09
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
乳腺导管原位癌的MRI表现及与病理分级的关系
姜婷婷 顾雅佳 彭卫军 尤超 刘芮
复旦大学附属肿瘤医院放射诊断科,复旦大学上海医学院肿瘤学系,上海 200032
背景与目的:乳腺导管原位癌(ductal carcinoma in situ,DCIS)的组织学分级是其预后的一个重要因素,高核级有较高的浸润趋势,且术后复发率高。本研究旨在评估DCIS的MRI表现及与病理学分级关系。方法:回顾性分析94例经病理证实为DCIS的MRI表现,分析其MRI形态学及动态增强表现,进一步讨论MRI特点与组织学核级别间的相关性。结果:94例患者中检出97个DCIS病灶,非肿块样强化病灶49个,其中节段样强化29个(59.18%);肿块样强化48个。动态增强表现:包括Ⅰ型曲线20个,Ⅱ型曲线50个,Ⅲ型曲线27个。BIRADS:BI-RADS 4A类22个,BI-RADS 4B类19个,BI-RADS 4C类29个,BI-RADS 5类27个。与组织病理学关系:HNG DCIS病变范围较non-HNG DCIS广(非肿块样强化:P=0.01;肿块样强化:P=0.03),而不同核级别DCIS的MRI形态学间差异无统计学意义(P>0.05),HNG DCIS时间信号强度曲线更易出现流出型(P=0.01),BI-RADS显示HNG DCIS更易被判定为BI-RADS 4C类及BI-RADS 5类(P=0.02)。结论:非肿块样强化DCIS以段样分布常见,结合形态学、血流动力学及BI-RADS分类,可较全面评价DCIS组织学核级别程度,对临床具有重要的指导意义。
乳腺导管原位癌;磁共振成像;BI-RADS;病理学
乳腺导管原位癌(ductal carcinoma in situ,DCIS)是一种肿瘤性导管内病变,特征为轻度至重度的细胞异型性,上皮增生明显,具有发展为浸润性乳腺癌的趋势[1]。随着DCIS检出率增高和对其生物学特性了解的深入,就如何治疗DCIS产生了越来越多的争议,对DCIS研究的焦点在于分辨出哪种病理类型易发展成浸润性癌[2]。病理学上,高级别的(high-nucleargrade,HNG)的DCIS发展为浸润性导管癌和局部复发的危险性显著高于非高级别(non-HNG)的DCIS[3]。乳腺MRI具有良好的软组织分辨力,特别是高分辨快速扫描和对比增强技术的应用,已成为乳腺疾病术前检查和术后复查的重要手段,对DCIS的检出亦有较高的敏感性[4]。本研究主要探讨DCIS的MRI表现,并进一步分析MRI表现与组织学核级别之间是否存在相关性,为临床诊疗提供影像学依据。
1 资料和方法
1.1 一般资料
收集复旦大学附属肿瘤医院2011年1—12月经手术病理证实的单纯性DCIS 58例,DCIS伴微浸润36例。前者包括低级别DCIS 13例,中级别DCIS 38例,高级别DCIS 7例。本研究将单纯性中、低级别DCIS定义为non-HGN DCIS(non-HGN组,n=51),单纯性高级别DCIS及DCIS伴微浸润定义为HNG DCIS(HNG组,n=43)。所有患者均为女性,年龄23~78岁,平均48岁。
1.2 设备与检查方法
GE Signal 1.5T或GE Signal HDX 3.0T线圈设备。常规采用乳腺专用相控阵表面线圈。患者常规俯卧位,双侧乳房自然悬垂于乳腺线圈洞穴中。常规包括FS T1WI轴面:TR 480~960 ms,TE 10 ms;FSE T2WI加脂肪抑制轴面+矢状面:TR 2 500~3 800 ms,TE 90~110 ms;层厚4~5 mm,层隔1 mm,矩阵320×160,或轴面,STIR T2WI:TR 4 500~5 000 ms,TE 45~50 ms。动态增强(DCEMRI)应用针对乳腺优化的并采集3D快速梯度回波(volume imaging for breast assessment,VIBRANT)序列双侧乳腺横断面及矢状面成像技术,扫描参数:TR 6.5 ms,TE 3.1 ms,层厚5 mm无间隔扫描,反转角15°矩阵256×128,FOV 32 cm×32 cm,激励次数1次。检查前用12 G静脉留置针建立静脉通道,对比剂采用Gd DTPA,用量 0.1~0.2 mg/kg,流率2~3 mL/s,于10 s内快速团注,然后快速推注10~20 mL 0.9%NaCl溶液,对比剂团注同时开始扫描,分别于注药前、注药后连续采集4~8次。采集图像传送至GE ADW4.3工作站,用Functool软件对病灶进行分析,将病灶早期强化最明显的区域选为ROI(应避开肉眼可见的出血、液化、坏死及囊变),绘制病灶的强度曲线。
1.3 影像评估
由2名专门从事乳腺研究的放射科医师,在确定DCIS但不知病理分级的情况下,根据ACR BI-RADS-MRI 标准[5]进行回顾性分析,描述每例病灶形态特征和动态增强表现,非肿块样强化从病灶的分布形式(局灶性、导管样和线样、节段样、区域性及弥漫性)和内部强化特征(均质、不均质、斑点状、成群小环状及网格状树枝状)对病变进行描述;肿块从形态学表现(形态、边缘)和内部强化特征(均匀、不均匀、边缘强化等)进行描述。将BI-RADS 4A类及BI-RADS 4B类定义为A组,BI-RADS 4C类及BI-RADS 5类定义为B组。
1.4 病理学检查
由2名有经验的病理学医师对病变进行描述及诊断,并对其病理学分级,分为单纯性DCIS及DCIS伴微浸润,组织病理学上根据细胞核的异型程度、管腔内坏死、核分裂象和钙化将DCIS分为分为高、中、低核级别。本院关于微浸润的定义为浸润灶最大径不超过1 mm,若有多处浸润灶,每处浸润最大径均不超过1 mm。
1.5 统计学处理
采用SPSS 13.0统计软件,用独立样本t检验对两组DCIS的年龄及病灶最大径进行分析,所有统计学数据用x±s表示,用χ2检验分析两组病灶形态、边缘、动态增强曲线及BI-RADS分类,P<0.05为差异有统计学意义,若有理论频数<5,则采用Fisher确切概率值。
2 结 果
2.1 年龄
non-HGN组年龄23~75岁,平均(48.25±12.47)岁,HGN组年龄26~78岁,平均(47.95±10.50)岁,差异无统计学意义(P=0.90)。
2.2 病灶位置
94例患者中共检出97个DCIS病灶,其中病灶位于右乳37个,左乳60个,病灶位于乳房外上象限42个,外下象限13个,内上象限27个,内下象限8个,乳头后方中央区5个,2例表现为弥漫性分布。
2.3 病灶MRI表现
HNG组病变最大径>non-HNG组(表1);非肿块样强化以节段性强化为主(59.18%,29/49),内部多不均质强化(42.86%,21/49,图1)。两组时间信号强度曲线间差异有统计学意义,进一步分析了两组上升型及流出型曲线的差异,HNG组较易出现流出型曲线,而non-HNG组易出现上升型曲线(χ2=6.76,P=0.01)。
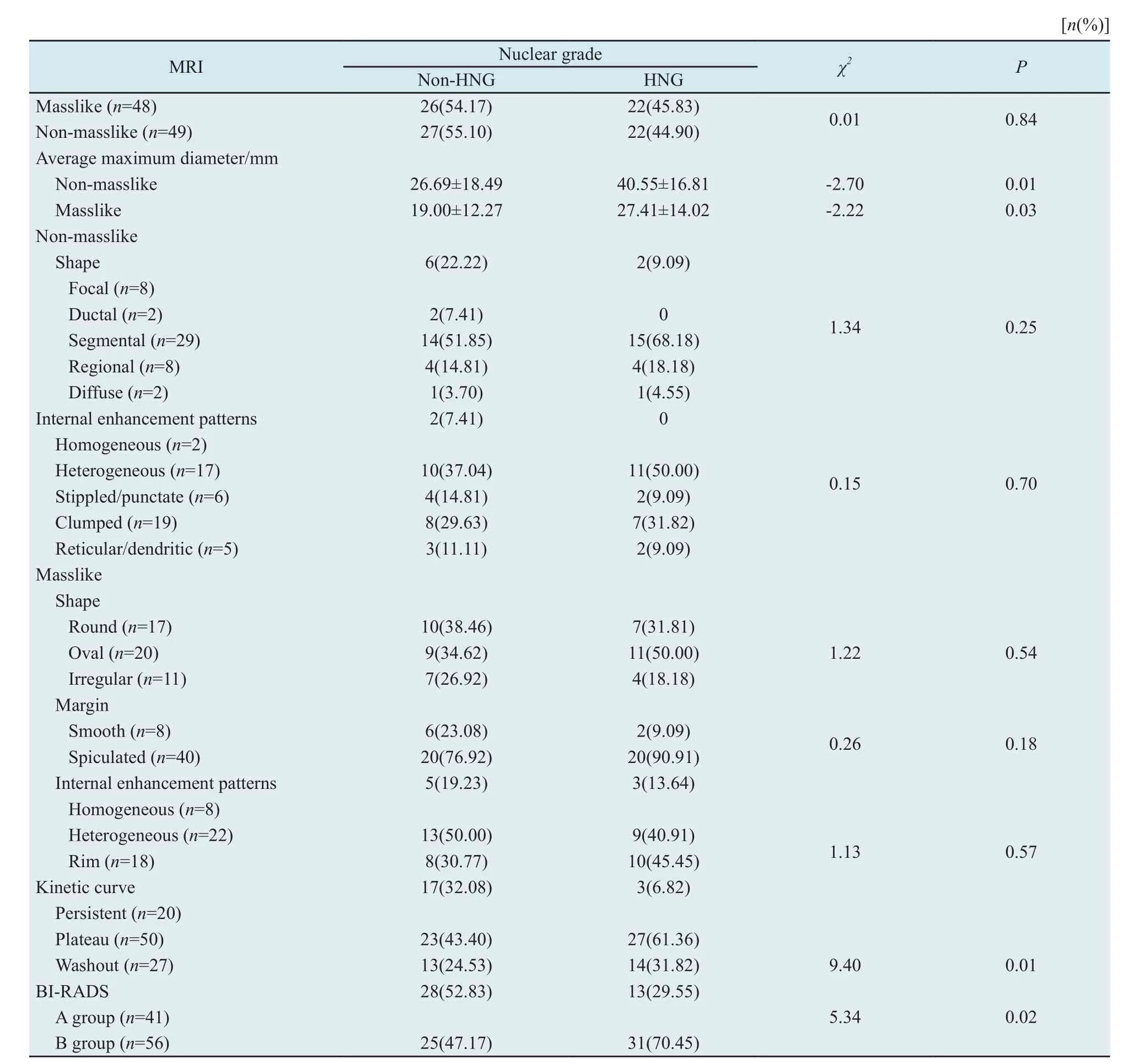
表 1 DCIS的MRI表现及与病理组织学核级别关系Tab. 1 MRI charactristics of DCIS and its relations with nuclear grade value
2.4 BI-RADS分类
所有病灶中,BI-RADS 4A类22个,BIRADS 4B类19个,BI-RADS 4C类29个,BIRADS 5类27个,差异有统计学意义(P<0.05,表1),HNG-DCIS更多被判定为BI-RADS 4C及BI-RADS 5类(χ2=5.34,P=0.02,图1、2)。

图 1 左乳高级别导管内癌,伴微浸润Fig. 1 High-nuclear-grade ductal carcinoma in situ of the left breast, with micro-invasive
图 2 左乳低级别导管内癌Fig. 2 Low- nuclear -grade ductal carcinoma in situ of the left breast
3 讨 论
DCIS多发生于终末导管小叶单位,通常起源于一个导管束,可沿导管进行播散,它既可位于近乳头的大导管内,也可位于远离乳头的小导管内。MRI增强扫描可以很好的反映DCIS的分布特点。Menell等[6]报道,MRI对DCIS的敏感率为77%~96%,非肿块样强化中的段样强化被认为是DCIS的MRI增强后的特征性表现[7],顾雅佳等[8]研究表明,在14例强化的病灶中有11例呈非肿块样强化,其中7例表现为节段样强化。本组资料中,49个病灶(50.52%)表现为非肿块样强化,其中29个(59.18%)表现为节段样强化,与文献报道一致。区域性强化范围往往较大,不沿导管走行,分布范围无明显特征性,不能用段样强化等征象来描述的一种分布方式,常表现为地图状或斑片状强化,本组8个病灶表现为区域性强化。本组资料中肿块样(图2)强化48个,大部分边缘毛刺或星芒状(83.33%),而肿块样强化为主的病灶,与浸润性导管癌不易鉴别。
DCIS的组织学分级是其预后的一个重要因素[4],高核级有较高的浸润趋势,肿块广泛切除后有较高的复发率,且高核级DCIS术后复发时间显著短于非高核级别,如能在手术前明确诊断,将为临床个性化治疗提供重要的参考依据。基于病理诊断及分型是手术后的结果,如能在术前通过影像学无创性表现给患者提供可能的病理诊断及亚型估计,则有利于临床医师对手术方式作出合理选择。Hughes等[9]最近的一项研究表明,在non-HNG DCIS组如果病变最大径<2.5 cm,只要手术切缘≥3 mm,术后不做放疗,5年局部复发率仅6%,而在HNG DCIS组的复发率为15%。
MRI 动态增强模式及形态学特征是否与DCIS 的核级别相关,国内相关报道罕见。Rahbar等[10]报道,MRI动态增强表现与不同核级别相关,高级别DCIS更容易出现恶性病变的强化模式,而非高核级别则很少出现。但Jansen等[11]的研究发现,MRI动态增强的定量指标与核级别无关。MRI动态增强曲线的类型与对比剂从血管到细胞外间隙的灌注与弥散相关,时间信号强度曲线多呈平台型或流出型[12],就本组资料而言,non-HNG组DCIS更容易出现上升型曲线(32.08% vs 6.82%),而HNG组DCIS容易出现流出型曲线(31.82% vs 24.53%),两组的时间信号强度曲线与组织学核级别间有相关性(χ2=6.76,P=0.01),这与Furman-Haran等[13]的研究结果一致。刘春玲等[14]的研究亦表明,DCIS的形态学表现与组织学核级别无相关性,而病灶大小与组织学核级别显著相关。本组结果示不同形态学DCIS,HNG组病变最大径>non-HNG组(非肿块样强化:t=-2.70,P=0.01;肿块样强化:t=-2.22,P=0.03),这一结果的原因可能为HNG DCIS更具侵袭性的生物学行为。
MRI BI-RADS提供了一个量化的、较为客观的标准,它把乳腺病变的形态学与血流动力学表现有效地结合,平衡了两者的不确定因素,较全面地描述了肿瘤特征。系统完整的BI-RADS可减少主观因素,本研究HNG组较non-HNG组更易判定为BI-RADS 4C及BI-RADS 5(χ2=5.34,P=0.02),这与Mahoney等[15]的研究结果一致。
需要与DCIS鉴别的有:①浸润性导管癌,乳腺MRI表现为不规则或星芒状肿块,强化明显,时间信号强度曲线常呈流出型或平台型,部分与高级别DCIS不易鉴别。②乳腺增生,病史较长,可单发或多发,T1WI上呈多发小片状低信号,T2WI为略高信号,增强后呈弥漫性中等持续强化,时间信号强度曲线常为上升型。③纤维腺瘤,MRI表现为边界清肿块,可呈分叶状,增强后肿块内部可见不强化纤维分隔。
综上所述,MRI表现非肿块样强化DCIS以段样分布多见,进一步分析发现不同病理分级的DCIS,MRI表现病变大小、时间信号强度曲线及BI-RADS有差异,与形态学特点无关。MRI在DCIS的诊断及提示组织学核分级中具有很大的优势,在术前诊断和预后判断方面也有临床应用价值,但是动态增强特点与核级别的相关性仍需大样本的进一步分析。
[1] 许玲辉, 彭卫军, 顾雅佳, 等. 乳腺导管原位癌的MRI表现[J]. 中华放射学杂志, 2011, 45(2): 159-163.
[2] 路红, 付丽. 乳腺导管内癌的影像学与病理学对照研究进展[J]. 中华乳腺病杂志(电子版), 2010, 4(6): 631-637.
[3] MOKBEL K, CUTULI B. Heterogeneity of ductal carcinoma in situ and its effects on management[J]. Lancet Oncol, 2006, 7(9): 756-765.
[4] FACIUS M, RENZ D M, NEUBAUER H, et al. Characteristics of ductal carcinoma in situ in magnetic resonance imaging[J]. Clin Imaging, 2007, 31(6): 394-400.
[5] AMERICAN COLLEGE OF RADIOLOGY. Breast imaging reporting and data system: BI-RADS atlas, 4th ed[M]. Reston, VA: American College of Radiology, 2003.
[6] MENELL J H, MORRIS E A, DERSHAW D D, et al. Determination of the presence and extent of pure ductal carcinoma in situ by mammography and magnetic resonance imaging[J]. Breast J, 2005, 11(6): 382-390.
[7] MORAKKABATI-SPITZ N, LEUTNER C, SCHILD H, et al. Diagnostic usefulness of segmental and linear enhancement in dynamic breast MRI[J]. Eur Radiol, 2005, 15(9): 2010-2017.
[8] 顾雅佳, 汪晓红, 肖勤, 等. 乳腺导管原位癌及其微浸润的磁共振成像评价[J]. 中华放射学杂志, 2007, 41(3): 248-253.
[9] HUGHES L L, WANG M, PAGE D L, et al. Local excision alone without irradiation for ductal carcinoma in situ of the breast: a trial of the Eastern Cooperative Oncology Group[J]. J Clin Oncol, 2009, 27(32): 5319-5324.
[10] RAHBAR H, PARTRIDGE S C, DEMARTINI W B, et al. In vivo assessment of ductal carcinoma in situ grade: a model incorporating dynamic contrast-enhanced and diffusionweighted breast MR imaging parameters[J]. Radiology, 2012, 263(2): 374-382.
[11] JANSEN S A, NEWSTEAD G M, ABE H, et al. Pure ductalcarcinoma in situ: kinetic and morphologic MR characteristics compared with mammographic appearance and nuclear grade[J]. Radiology, 2007, 245(3): 684-691.
[12] KELLER A. Noninvasive tissue oximetry[J]. Clin Plast Surg, 2011, 38(2): 313-324.
[13] FURMAN-HARAN E, SCHECHTMAN E, KELCZ F, et al. Magnetic resonance imaging reveals functional diversity of the vasculature in benign and malignant breast lesions[J]. Cancer, 2005, 104(4): 708-718.
[14] 刘春玲, 何晖, 张金娥, 等. 乳腺导管原位癌的MRI表现及其与组织学核级别的相关性分析[J]. 临床放射学杂志, 2012, 31(1): 29-33.
[15] MAHONEY M C, GATSONIS C, HANNA L, et al. Positive predictive value of BI-RADS MR imaging[J]. Radiology, 2012, 264(1): 51-58.
The MRI of ductal carcinoma in situ with pathology grade
JIANG Ting-ting, GU Ya-jia, PENG Wei-jun, YOU Chao, LIU Rui (Department of Radiology, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
GU Ya-jia E-mail: cjr.guyajia@vip.163.com
Background and purpose: Histological grade of DCIS is an important factor in the prognosis, high nuclear grade have higher infiltration trend and recurrence rate. This study aimed to evaluate the dynamic and morphological MRI charactristics of ductal carcinoma in situ (DCIS) of the breast, then analyze its relations with nuclear grade. Methods: Of the 94 patients, 97 lesions were proved DCIS by pathology. The morphology, maximum size, time- intensity curve of lesion were recorded or measured. Statistic was performed to identify MR imaging features that optimally discriminated HNG from non-HNG DCIS. Results: There were 49 non mass-like enhancement lesions, and 48 masses enhancement lesions. Among 49 non mass-like lesions, 29 were segmental enhancement (59.18%). Dynamic enhanced performance: 50 exhibited plateau curves and 27 were washout curves. BI-RADS categories: 22 BI-RADS 4A, 19 BI-RADS 4B, 29 BI-RADS 4C, and 27 BI-RADS 5. HNG lesions exhibited larger mean maximum lesion size (non-mass-like enhancement: P=0.01; mass: P=0.03), time- intensity curve was variable to approach significance (P=0.01), and BI-RADS can help to discriminate the nuclear grade (P=0.02). There were no differences in lesion morphology (P>0.05). Conclusion: The preliminary findings suggest that DCE MR imaging features may aid in identifying patients with high risk DCIS.
Ductal carcinoma in situ; MRI; BI-RADS; Nuclear grade
10.3969/j.issn.1007-3969.2013.08.012
R737.9
:A
:1007-3639(2013)08-0633-06
2013-06-25)
顾雅佳 E-mail:cjr.guyajia@vip.163.com
