局部区域复发乳腺癌的治疗进展
2013-06-09
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032
局部区域复发乳腺癌的治疗进展
陈佳艺
复旦大学附属肿瘤医院放疗科,复旦大学上海医学院肿瘤学系,上海 200032

陈佳艺,医学博士,主任医师,硕士生导师,复旦大学附属肿瘤医院放疗科副主任。1993年毕业于上海医科大学医学系临床医学专业英语班,1998—2000年在法国巴黎十二大学附属Henri-Mondor医院和Gustave Roussy肿瘤研究所学习,长期致力于乳腺癌的放射治疗和综合领域的临床和科研工作。现任中国抗癌协会乳腺癌专业委员常委,上海市抗癌协会乳腺癌专业委员会委员,NCCN中国版乳腺癌专家组成员,卫生部医政司乳腺癌诊疗常规修订专家组成员。目前主持国家自然基金面上项目1项,并以项目负责人完成上海市科委和卫生局课题各1项,以第一作者或通信作者在国内权威、核心期刊和国际SCI杂志上发表论文30篇。
和初治的乳腺癌相比,局部区域复发性患者的预后分析和挽救治疗策略选择存在更多的不确定性。本文首先分析了影响保乳手术和乳房切除术后局部-区域复发的高危因素以及相应的复发模式。以再次手术和包括完整复发灶及相应亚临床病灶的放射治疗为主要形式的局部治疗是综合治疗策略的基础,合理的局部治疗可以达到有效的局部疾病控制率并降低二次局部区域复发。虽然既往的前瞻性或回顾性资料对于全身治疗在局部-区域复发乳腺癌治疗中的价值始终没有确认,由多个国际乳腺癌研究组织联合发起的CALOR研究结果的公布第一次证实,在保留合理的内分泌治疗和靶向治疗的前提下,手术+放射治疗联合后续的全身化疗可以进一步提高无病生存率和总生存率,尤其在激素受体阴性的患者中获益更显著。所以结合原发病灶和复发灶的肿瘤标志物给予合理的全身治疗将成为局部区域复发患者综合治疗重要的组成部分。
局部区域复发;乳腺癌;治疗进展
乳腺癌的局部复发定义为在已接受过手术和(或)放射治疗的患侧的乳房和(或)胸壁,包括术后胸壁的皮肤再次出现肿瘤,区域复发定义为患侧的淋巴引流区,包括腋窝、锁骨上及内乳淋巴结区域出现肿瘤。孤立性局部-区域性复发为复发时通过常规检查没有发现合并其他部位的转移(isolated local-regional recurrence,ILRR),本文后续所讨论的复发均为ILRR。因为疾病的初始病期、分子分型和综合治疗的不同,影响局部-区域复发患者预后的因素也较初次治疗的患者更复杂多样。由于在这个领域的前瞻性研究数据非常稀少,在治疗模式的优化,尤其是全身治疗的合理应用中仍然存在一定的争议。本文希望在总结接受乳房保留手术和乳房切除手术患者局部-区域复发模式的基础上,就近年来在局部治疗和全身治疗方面的共识和争议作一综述。
1 早期乳腺癌保乳治疗后的复发模式及治疗进展
1.1 影响早期乳腺癌保乳术后局部复发的因素
保乳术后局部复发的预测因素在过去的30余年中经过大量的探索,得到共识的复发高危因素可以归纳为患者因素(低龄和遗传易患因素)、肿瘤因素(广泛导管内癌成分和脉管侵犯)和治疗因素(手术切缘阳性、灶性阳性或接近,缺少瘤床加量以及全身治疗强度不足)[1]。分子分型是否可以成为局部复发的预测因素近年来受到较多关注,Nguyen等[2]在793例保乳患者中发现,5年局部复发率在Luminal A、Luminal B、HER-2阳性和基底型患者分别为0.8%、1.5%、8.4%和7.1%,多因素分析证实,以Luminal A型作参照,HER-2阳性和基底型为局部复发的独立高危因素。21基因复发指数(recurrence score,RS)在激素受体阳性、腋窝淋巴结阴性的乳腺癌患者中可以较单个预后因素更综合地判断预后并指导全身治疗策略,同时在NSABP B-14和B-20试验纳入的患者中,回顾性研究结果显示,10年局部区域复发率在低、中、高RS患者中分别为4.0%、7.2%和15.8%[3]。但是这方面的争议仍持续存在。Solin等[4]对E2197试验纳入的患者做了类似的验证,发现虽然在激素受体阳性的患者中观察到局部复发风险随着RS增高而增高,但总体而言,无论RS还是分子分型都不能成为局部复发或局部区域复发的独立预后因素。这些长期随访的资料都是早于抗HER-2靶向治疗和新一代内分泌治疗药物应用,相信随着新的临床研究随访资料的成熟,对保乳术后局部复发的预测会更完善。
1.2 非挽救性乳房切除在保乳术后复发患者的可行性
约70%的保乳术后复发情况发生在原瘤床范围。5%~10%的复发患者诊断发现时即表现为弥散的皮下结节,其预后类似于乳房切除术后胸壁弥散复发或炎性乳癌患者;大部分患者都可以接受挽救性乳房切除,总体预后相对较好[5]。可手术的孤立性复发患者通过挽救性乳房切除可以获得60%~70%的5年局部控制率和约85%的总生存率[6]。影响复发患者生存率的主要预后因素包括:复发的组织学类型(浸润性癌vs导管内癌)、年龄、有无挽救性乳房切除的指征、复发距术后放疗的无病间期、腋窝淋巴结转移数目以及原发肿瘤组织学类型等[7]。
虽然乳房切除是主要的挽救性治疗措施,但是其他局部治疗的手段也是在不断的探索中,再次乳房保留治疗的主要理论依据是复发患者的后续乳房复发比例(19%~50%),所以可能不是所有的复发患者必须接受全乳切除[8]。考虑再次乳房保留治疗,尤其是再次乳房照射,需要采用其他技术,如近距离插植或三维适形外照射,使得重复照射的正常组织高剂量区域不完全叠加,减少后期损伤[9]。部分乳腺短程照射随着技术上的日渐成熟,也可作为非乳房切除的挽救治疗。来自GEC-EORTC的多中心研究对217保乳术后复发患者给予多管插植的近距离治疗作为挽救治疗,5年和10年的再次复发率分别为5.6%和7.2%,3~4度并发症发生率为11%,85%的患者获得了优秀或优良美容效果[10]。
2 乳房切除术后的复发模式及治疗进展
2.1 乳房切除术后胸壁和区域淋巴结的复发模式和时间规律
影响乳房切除术后复发高危因素主要包括原发肿瘤分期、切缘有无累及、腋窝淋巴结的阳性数目、年龄、激素受体、有无淋巴脉管侵犯以及侵犯范围等。由于乳房切除术后复发的影响因素更复杂,分子分型和以21基因为代表的复发风险归类在乳房切除术后的复发预测上的资料非常少。根据不同的病期和复发风险,5%~30%的乳腺癌在接受乳房切除术后会出现胸壁和区域淋巴结的复发,其中约2/3的患者表现为孤立性复发[11-13]。了解影响复发的高危因素以及局部-区域各个解剖亚结构的累及规律既有助于判断最可能从术后放疗中获益的患者群,同时也对于术后放疗的靶区勾画或界定有重要的参考价值。
在同时接受腋窝淋巴结清扫术后的患者中,胸壁复发频率最高,占所有复发的40%以上,其次为锁骨上淋巴结,低位腋淋巴结和内乳淋巴结次之。Strom等[14]在1 031例没有接受过术后放疗的T1~T3期N0~N≥10的患者中,180例复发患者有完整的随访资料,总计215例复发部位,其中120处位于患侧胸壁,95处位于区域淋巴结,分别包含77处高位腋窝和锁骨上淋巴结和21处低位腋窝淋巴结。术后至首次胸壁复发的中位无病间期小于至首次区域淋巴结复发的时间(27个月vs 38个月)。胸壁复发经典的表现为胸壁皮肤或皮下无痛性小结节,在疤痕附近出现的概率更高,少数可表现为多发小结节或弥散的红斑,“铠甲型”(en cuirasse)复发是弥散型复发的一个特殊类型。约30%同时合并区域淋巴结的复发。虽然大部分的复发发生在首次治疗后5年内,但仍然可以表现相当长的时间跨度。
复旦大学附属肿瘤医院在255例乳房切除术后ILRR的患者中发现了304处复发,手术到复发的中位无病间期为22(2~260)个月。109例(42.7%)为单纯胸壁复发,114例(44.7%)为区域淋巴结复发,32例(12.5%)同时累及胸壁和淋巴引流区。区域淋巴结复发的患者中,69例位于锁骨上区,19例位于腋窝,9例位于内乳,17例同时累及两个淋巴引流区。在更新文献中,对总计170处淋巴引流区复发灶按照解剖亚结构归类,分布频率依次为:锁骨上(29.4%)、锁骨下及第三站腋窝(17.6%)、内乳(16.5%)、胸肌间(14.1%)、第二站腋窝(11.8%)和第一站腋窝(10.6%),以腋静脉作为分界发现,腋静脉头侧与腋静脉尾侧累及的比例为2.3∶1[15]。这些资料的时间跨度虽然比较长,但高度一致的结果证实,胸壁是复发频率最高的部位,其次是位于腋静脉头侧,即腋窝淋巴结清扫没有累及高位腋窝和锁骨上淋巴引流区,这也是目前国内外指南一致推荐的术后放疗靶区。
2.2 影响乳房切除术后局部-区域复发的预后因素
乳房切除术后的局部区域复发的总体预后远不如乳房保留治疗后单纯的同侧乳房复发。即使经过积极的局部治疗或联合一定程度的全身治疗,复发后约2/3患者后续会发生远处转移,5年生存率为10%~50%[16-18],5年局部控制率为27%~75%[19-21]。
在过去30多年内,陆续有文献分析了影响局部区域复发患者生存预后的主要因素,包括复发灶的部位、大小、数目、至复发的无病间期、激素受体和年龄。其中复发灶的部位中预后最好的是胸壁或腋下的单灶复发,多个单独结节次之,弥散复发或同时累及胸壁和区域淋巴结的最差,在淋巴结复发的患者中,有锁骨上累及者生存率下降。虽然大部分复发患者难以逃脱远处转移的转归,但仍然有一部分预后良好的患者可以获得长期无病生存,M.D.Anderson中心对130例孤立性胸壁复发患者进行随访发现,在初始分期为N0,无病生存期达2年及以上并且在复发后接受胸壁放射治疗的患者中,5年无远处转移生存率和总生存率分别为79.5%和86.1%[22];Hsi等[20]也发现,在局限于胸壁复发的患者中存在潜在可治愈的亚群,所以对初次复发患者的预后进行全面地评估非常关键。Willner等[18]报道5年生存率在单纯胸壁或腋窝复发者、锁骨上淋巴结复发和同时累及胸壁+区域淋巴结者分别为50%、28%和28%;胸壁复发灶单个、两个、多个和弥散结节者5年生存率分别为59%、41%、12%和6%。无病间期也是个共识的预后因素,对复旦大学附属肿瘤医院临床资料进行回顾性研究发现,无病间期1年以内、1~2年和2年以上的生存率分别为18.2%、58.5%和74.3%[23]。
3 合理的局部治疗技术在疾病控制方面的价值
局部区域复发的治疗目的在于一方面有效地控制局部疾病,另一方面为尽可能地减少或延迟后续的远处转移的发生。积极合理的局部治疗是首要的治疗原则,包括尽可能的手术切除和放射治疗。大多数复发灶单纯切除的后续再次复发率可达60%~75%[24],挽救性放射治疗是局部区域性复发患者综合治疗的主要手段之一。在胸壁复发的放射治疗方面,局部小野照射会使再次复发率显著增高,Halverson等[25]报道,小野照射和全胸壁照射的5年胸壁复发率分别为64%和25%,小野照射引起的复发中有2/3位于原射野以外。复旦大学附属肿瘤医院的报道也发现,如果采用胸壁小野照射,会使照射野之外的复发率显著增高[23,26]。
局部区域复发患者病程发展的另一项特点是其他部位的再次局部-区域性复发。胸壁和锁骨上区是再次复发最常累及的区域,其中以胸壁后续复发最常见,提示对淋巴引流区复发患者进行胸壁预防性照射是必要的[27]。与胸壁的预防性照射相比,淋巴引流区的预防性照射方面的争议更多。胸壁复发患者后续锁骨上复发的概率在不同的报道中为 5%~28%[28-29],进行50 Gy的预防性照射可以降低约2/3的后续复发率。
放射治疗的合理剂量也是影响复发患者疗效的重要因素,亚临床病灶需要给予总剂量为50 Gy,分为25~28次的照射才能达到90%以上的肿瘤控制率。当存在大体病灶时,需要复发灶剂量追加至60 Gy及以上。加热配合局部放疗可以在一定程度上改善局部控制率。荟萃分析发现,热疗合并放疗可以将单纯放疗49%的局部控制率提高到59%[30]。
4 全身治疗在局部-区域复发患者治疗中的价值
从ILRR患者的自然病程分析,既然远处转移是大部分患者后续失败原因,那么全身治疗应该是综合治疗策略中至关重要的部分。既往一些回顾性或前瞻性但非随机研究对全身治疗价值的结论始终模棱两可,Haylock等[31]对120例既往无辅助化疗史的首次复发患者非随机对比了化疗和非化疗的疗效,发现非化疗组的死亡风险是化疗组的1.39倍,但可能限于样本量,差异无统计学意义。Kuo等[32]分析了115例乳房切除术后ILRR的患者资料,发现接受积极的局部区域治疗(手术和完整的放射治疗)以及全身治疗的患者5年无浸润性癌复发和总生存明显优于只接受其中一个方面治疗的患者(52% vs 39%,P=0.011和63% vs 50%,P=0.026)。由于复发患者治疗的复杂性,在接近30年的年限内只有3个临床Ⅲ期研究结果发表,对照组都 是单纯放射治疗(表1)[33-35]。其中更生霉素和他莫昔芬的实验均在研究组中发现,局部控制率显著提高,尤其在绝经后患者有比较明确的获益,但没有反映到生存率的获益。α-干扰素的研究则没有发现局控率和生存率的获益。
由于这些研究不但时间跨度大,而且入组标准异质性大,主要研究终点也不一致,导致在2009年时Cochrane分析无法对该问题作出解释[36]。同时研究药物中除了他莫昔芬以外,另外两个药物都不再包括在乳腺癌综合治疗的指南之内;更重要的是第三代芳香化酶抑制剂和抗HER-2治疗药物的普及显著改善了复发转移性乳腺癌的预后,所以由多个国际乳腺癌研究组织共同发起的CALOR研究希望在现代综合治疗背景下,评价在局部治疗基础上联合化疗的价值。研究对象为保乳手术或乳房切除术后以乳房、胸壁或区域淋巴结(不包括锁骨上淋巴结)为首次复发部位的患者,复发部位接受手术切除,同时放射治疗包括完整的亚临床病灶范围,剂量≥40 Gy。在此基础上随机分为化疗组和无化疗组,不限定化疗方案,但推荐两药及以上的联合方案,疗程为3~6个月,在结束化疗以后两组均根据激素受体和HER-2状态完善其他的全身治疗。预期样本量为977例,主要和次要研究终点分别为无病生存率和总生存率。在2008年经过修订后样本量需求降为265例,最后在2010年1月入组162例后关闭。全组13%的复发部位为区域淋巴结。全组和ER阴性患者中化疗组和非化疗的5年无病生存率差异均有统计学意义(69% vs 57%,P=0.046和67% vs 35%,P=0.007)。化疗和非化疗组的5年总生存率差异有统计学意义(88% vs 76%,P=0.02)。多因素分析发现无病间期和有无全身化疗是影响无病生存率和总生存率的独立预后因素[37]。该研究第一次证实在积极局部治疗基础上增加化疗可以提高无病生存率甚至总生存率,也在相当程度上改变了对局部区域复发患者的治疗理念。
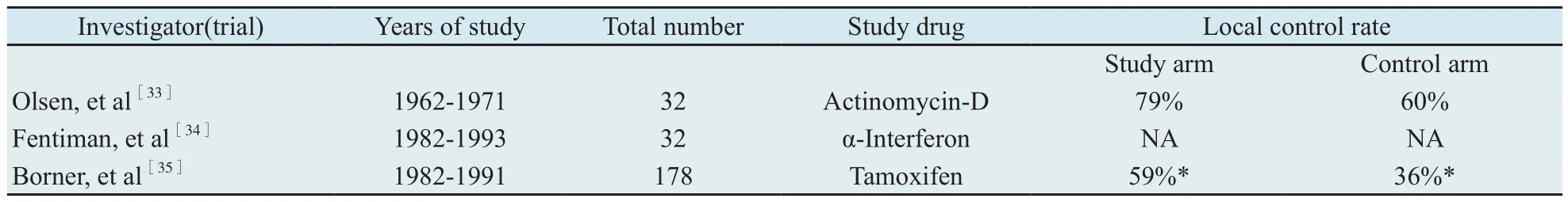
表 1 关于孤立性局部区域复发患者全身治疗价值的临床Ⅲ期研究Tab. 1 Phase Ⅲ trial evaluating the role of drug therapy in isolated-local regional recurrent breast cancer

图 1 局部区域复发性乳腺癌的诊断、治疗策略推荐Fig. 1 Flow-diagram of diagnosis and therapeutic strategy for isolated local-regional recurrent breast cancer
5 小 结
局部区域复发性乳腺癌的诊断治疗策略见图1。局部区域复发性乳腺癌代表了一组预后相当异质性的疾病,虽然总体乳房保留术后局部复发患者的预后优于乳房切除术后复发者,但在后者人群中仍然可以通过各项预后因素综合筛选出潜在可治愈的人群。包括再次手术和放射治疗在内的积极局部区域治疗是首选的治疗原则。高级别循证医学证据已提示,在相当程度上,局部区域复发代表着远处转移风险的增高,随着CALOR研究结果的报道,合理的全身治疗有望在局部疾病控制的基础上有效地降低后续的远处转移并提高生存率。
[1] CLARKE D H, MARTINEZ A A. Identification of patients who are at high risk for locoregional breast cancer recurrence after conservative surgery and radiotherapy: a review article for surgeons, pathologists, and radiation and medical oncologists[J]. J Clin Oncol, 1992, 10(3): 474-483.
[2] NGUYEN P L, TAGHIAN A G, KATZ M S, et al. Breast cancer subtype approximated by estrogen receptor, progesterone receptor, and HER-2 is associated with local and distant recurrence after breast-conserving therapy [J]. J Clin Oncol, 2008, 26: 2373-2378.
[3] MAMOUNAS E P, TANG G, FISHER B, et al. Association between the 21-gene recurrence score assay and risk of locoregional recurrence in node-negative, estrogen receptorpositive breast cancer: Results from NSABP B-14 and NSABP B-20 [J]. J Clin Oncol, 2010, 28(10): 1677-1683.
[4] SOLIN L J, GRAY R, GOLDSTEIN L J, et al. Prognostic value of biologic subtype and the 21-gene recurrence score relative to local recurrence after breast conservation treatment with radiation for early stage breast carcinoma: results from the Eastern Cooperative Oncology Group E2197 study [J]. Breast Cancer Res Treat, 2012, 134: 683-692.
[5] TENNVALL-NITTBY L, TENEGRUP L, LANDBERG T. The total incidence of loco-regional recurrence in a randomized trial of breast cancer TNM stage Ⅱ: The South Sweden Breast Cancer Trial [J]. Acta Oncol, 1993, 32: 641-647.
[6] VERONESI U, MARUBINI E, DEL VECCHIO M, et al. Local recurrence and distant metastasis after conservative breast cancer treatments: partly independent events [J]. J Natl Cancer Inst, 1995, 87: 19-29.
[7] GALPER S, BLOOD E, GELMAN, et al. Prognosis after local recurrence after conservative surgery and radiation for earlystage breast cancer [J]. Int J Radiat Oncol Biol Phys, 2005, 61: 348-357.
[8] KEURER H M, ARTHUR D W, HAFFTY B G, et al. Repeat breast conserving surgery for local in-breast carcinoma recurrence: the potential role of partial breast irradiation [J]. Cancer, 2004, 100: 2269-2280.
[9] GUIX B N, LEJÁ RCEGUI J A, TELLO J I, et al. Exeresis and brachytherapy as salvage treatment for local recurrence after conservative treatment for breast cancer: results of a tenyear pilot study [J]. Int J Radiat Oncol Biol Phys, 2010, 78: 804-810.
[10] HANNOUN-LEVI J M, RESCH A, GAL J, et al. Accelerated partial breast irradiation with interstitial brachytherapy as second conservative treatment for ipsilateral breast tumour recurrence: Multicentric study of the GEC-ESTRO Breast Cancer Working Group [J]. Radiother Oncol, doi: 10.1016/ j.radonc.2013.03.026. [Epub ahead of print]
[11] KATZ A, STROM E A, BUCHHOLZ T A, et al. Locoregional recurrence patterns after mastectomy and doxorubicin-based chemotherapy: implications for postoperative irradiation [J]. J Clin Oncol, 2000, 18: 2817-2827.
[12] PIERCE L J. The use of radiotherapy after mastectomy: a review of the literature [J]. J Clin Oncol, 2005, 23(8): 1706-1717.
[13] 王淑莲, 李晔雄, 余子豪. 早期乳腺癌根治术后放射治疗靶区的确定[J]. 中华放射肿瘤学杂志, 2001, 10: 223-227.
[14] STROM E A, WOODWARD W A, KATZ A, et al. Clinical investigation: regional nodal failure patterns in breast cancer patients treated with mastectomy without radiotherapy [J]. Int J Radiat Oncol Biol Phys, 2005, 63: 1508-1513.
[15] 陈剑, 马金利, 张盛箭, 等. 局部晚期和复发性乳腺癌患者区域淋巴结转移分布特点及靶区勾画意义[J]. 中华放射肿瘤学杂志, 2011, 20(2): 123-127.87.
[16] KENDA R, LOZZA L, ZUCALI R. Results of irradiation in the treatment of chest wall recurrent breast cancer [J]. Radiother Oncol, 1992, 24(suppl 1): 41.
[17] SCHMOOR C, SAUERBREI W, BASTERT G, et al. Role of isolated locoregional recurrence of breast cancer, Results of four prospective studies [J]. J Clin Oncol, 2000, 18(8): 1696-1708.
[18] WILLNER J, KIRICUTA I C, KOLBL O. Locoregional recurrence of breast cancer following mastectomy: Always a fatal event? Results of univariate and multivariate analysis[J]. Int J Radiat Oncol Biol Phys, 1997, 37: 853-863.
[19] ABERIZK W J, SILVER B, HEDERSON I C, et al. The use of radiotherapy for treatment of isolated locoregional recurrence of breast carcinoma after mastectomy[J]. Cancer, 1986, 58: 1214-1218.
[20] HSI R A, ANTELL A, SCHULTZ D J, et al. Radiation therapy for chest wall recurrence of breast cancer after mastectomy in a favorable subgroup of patients [J]. Int J Radiat Oncol Biol Phys, 1998, 42: 495-499.
[21] MAGNO L, BIGNARDI M, MICHELETTI E, et al. Analysisof prognostic factors in patients with isolated chest wall recurrence of breast cancer [J]. Cancer, 1987, 60: 240-244.
[22] CHAGPAR A, FUNDA MERIC-BERNSTAM F, HUNT K K, et al. Chest wall recurrence after mastectomy does not always portend a dismal outcome[J]. Ann Surg Oncol, 2003, 10(6): 628-634.
[23] 陈佳艺, 郭小毛, 章真, 等. 影响乳腺癌根治术后局部-区域性复发放射治疗后局部控制的因素 [J]. 中华放射肿瘤学杂志, 2008, 17: 11-16.
[24] FOWBLE B, FREEDMAN G. Cancer of the breast. In Wang C.C, eds[M]//Clinical radiation oncology: indications, techniques, and results. 2nd ed. New York: Wiley-Liss, 2000: 189-294.
[25] HALVERSON K J, PEREZ C A, KUSKE R R, et al. Locoregional recurrence of breast cancer: a retrospective comparison of irradiation alone versus irradiation and systemic therapy [J]. Am J Clin Oncol, 1992, 15: 93-101.
[26] 陈佳艺, 冯炎. 乳腺癌术后胸壁复发的放射治疗 [J]. 中华放射肿瘤学杂志, 2004, 13: 196-199.
[27] SCHWAIBOLD F, FOWBLE B L, SOLIN L J, et al. The results of radiation therapy for isolated local regional recurrence after mastectomy [J]. Int J Radiat Oncol Biol Phys, 1991, 21: 299-391.
[28] BEDWINEK J M, FINEBERG B, LEE J, et al. Analysis of failures following local treatment of isolated local regional recurrence of breast cancer [J]. Int J Radiat Oncol Biol Phys, 1981, 7: 581-585.
[29] HALVERSON K J, PEREZ C A, KUSKE R R, et al. Isolated local regional recurrence of breast cancer following mastectomy: radiotherapeutic management [J]. Int J Radiat Oncol Biol Phys, 1990, 19: 851-858.
[30] INTERNATIONAL COLLABORATIVE HYPERTHERMIA GROUP. Radiotherapy with or without hyperthermia in the treatment of superficial localized breast cancer: results from five randomized controlled trials [J]. Int J Radiat Oncol Biol Phys, 1996, 35: 731-740.
[31] HAYLOCK B J, COPPIN C M, JACKSON J, et al. Locoregional first recurrence after mastectomy: prospective cohort studies with and without immediate chemotherapy[J]. Int J Radiat Oncol Biol Phys, 2000, 46(2): 355-362.
[32] KUO S H, HUANG C S, KUO W H, et al. Comprehensive locoregional treatment and systemic therapy for postmastectomy isolated locoregional recurrence [J]. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1456-1464.
[33] OLSON C E, ANSFIELD F J, RICHARDS M J, et al. Review of local soft tissue recurrence of breast cancer irradiated with and without actinomycin-D [J]. Cancer, 1977, 39(5): 1981-1983.
[34] FENTIMAN I S, BALKWILL F R, CUZICK J, et al. A trial of human alpha interferon as an adjuvant agent in breast cancer after loco-regional recurrence [J]. Eur J Surg Oncol, 1987, 13(5): 425-428.
[35] BORNER M, BACCHI M, GOLDHIRSCH A, et al. First isolated locoregional recurrence following mastectomy for breast cancer: results of a phase Ⅲ multicenter study comparing systemic treatment with observation after excision and radiation [J]. J Clin Oncol, 1994, 12: 2071-2077.
[36] http://www.thecochranelibrary.com[EB/OL]
[37] AEBI S, GELBER S, LÁNG I, et al. Chemotherapy prolongs survival for isolated local or regional recurrence of breast cancer: the CALOR Trial. S3-2[C]. San Antonio Breast Cancer Symposium, 2012.
Treatment progress of local recurrence of breast cancer
CHEN Jia-yi(Department of Radiotherapy, Fudan University Shanghai Cancer Center, Department of Oncology, Shanghai Medical College, Fudan University, Shanghai 200032, China)
CHEN Jia-yi E-mail:chenjiayi0188@gmail.com
Compared with initial treatment of primary breast cancer, more uncertainties exist regarding to the prognosis and salvage therapy of local-regional recurrent breast cancer. This article summarized the pattern of recurrence after breast conservative therapy and mastectomy respectively. Comprehensive local treatment comprising re-excision and entire-field radiotherapy are the mainstay of multi-disciplinary treatment. Optimized local treatment is efficient not only in local disease control but also in preventing subsequent recurrence. Although past data did not fully justify the role of systemic treatment in local-regional recurrent patients, the result of CALOR trial, which was initiated by several international breast cancer co-operative groups has confirmed that based on individualized endocrine and targeted therapy, salvage surgery plus radiotherapy followed by systemic chemotherapy improved the disease-free survival and overall survival compared to surgery + radiotherapy alone, especially in estrogen receptor negative patients.Thus, systemic treatment based on biomarkers from primary as well as recurrent disease will become an integrated part in the therapeutic strategy of local-regional recurrent breast cancer.
Local recurrence; Breast cancer; Treatment progress
10.3969/j.issn.1007-3969.2013.08.006
R737.9
:A
:1007-3639(2013)08-0596-07
2013-06-25 )
陈佳艺 E-mail:chenjiayi0188@gmail.com
